肝内窦前性非肝硬化性门静脉高压症的研究进展
夏 帅, 吴晓宁, 王冰琼, 何志颖, 尤 红
1 首都医科大学附属北京友谊医院 肝病中心, 北京 100050;2 国家消化系统疾病临床医学研究中心, 北京 100050
肝硬化是导致门静脉高压症的最常见病因,占80%~85%[1],当出现门静脉高压的症状和体征,但生化、影像学或组织学无肝硬化证据时的一组疾病,被称为非肝硬化性门静脉高压症[2-3]。通常以肝小叶内的肝窦为分界,临床上非肝硬化性门静脉高压症可分为肝窦前性非肝硬化性门静脉高压症和肝窦后性非肝硬化性门静脉高压症,前者又包括肝前性(如肝外门静脉阻塞和门静脉血栓等)和肝内窦前性(如特发性非肝硬化性门静脉高压症、门静脉肝窦血管性疾病和先天性肝纤维化等)[4],具有门静脉高压突出但肝静脉压力梯度(hepatic venous pressure gradient, HVPG)正常或轻微异常的临床特点。本文着重对常见的肝内窦前性非肝硬化性门静脉高压的临床诊治要点及进展进行阐述,期待有助于提高临床医生对该类疾病的认识。
1 特发性非肝硬化性门静脉高压症治疗以延缓门静脉高压进展为主,远期预后较肝硬化好
特发性非肝硬化性门静脉高压症(idiopathic non-cirrhotic portal hypertension, INCPH)又称门静脉纤维化、肝内门静脉硬化症,是在没有肝纤维化/肝硬化或其他可能导致门静脉高压进展的潜在肝脏疾病(如病毒性肝炎、脂肪性肝炎等病因),以门静脉高压及相关症状为主要表现的一种疾病类型[5]。目前病因不明确,慢性或复发性感染、药物或毒物暴露、免疫性疾病、遗传性疾病和高凝状态被认为和INCPH相关,建议根据病史、临床特征、影像学和实验室特征仔细考虑这些疾病的可能(表1)。
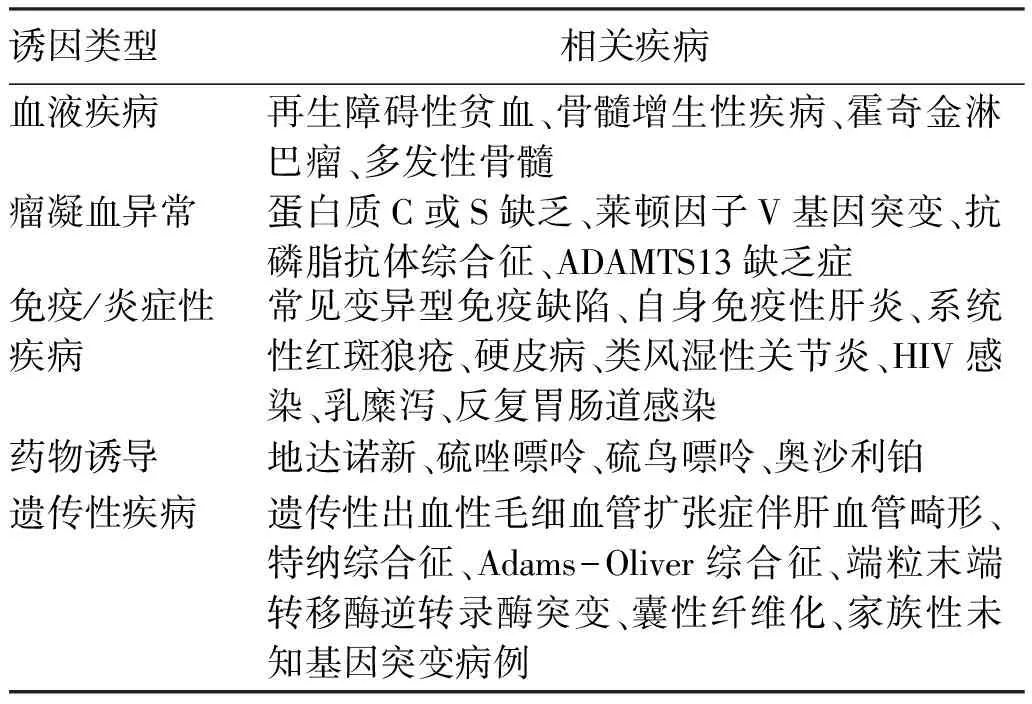
表1 美国肝病学会推荐的INCPH和PSVD的相关疾病[6]
INCPH的主要临床特征为门静脉高压症状重,而肝功能受损较轻[7-8],主要表现为脾肿大、脾功能亢进、食管静脉曲张、非恶性腹水、门体侧支循环开放,HVPG轻度升高,INCPH患者发生胃食管静脉曲张破裂继发出血的发生风险高达50%[9],较少出现肝性脑病、肝肾综合征等并发症[10]。在大部分INCPH患者中,反映肝损伤及合成功能的血清学指标如血清转氨酶、碱性磷酸酶和血清胆红素的水平正常或轻度升高。然而,也有部分患者可能完全无症状,通过影像学检查或内镜手术下偶然发现[11]。
肝穿刺活检是明确INCPH诊断的金标准。INCPH典型的组织学病变包括闭塞性门静脉病变、结节性再生性增生和不全间隔肝硬化[10]。闭塞性门静脉病变被认为是INCPH的标志,70%患者会出现,特点是门静脉分支壁纤维化和不规则增厚,随后出现管腔偏心性狭窄、闭塞,门静脉主干或左右分支出现阻塞性血栓,门静脉消失[12]。结节性再生性增生的特点是中央静脉周围肝细胞萎缩,门静脉周围区域肝细胞代偿性肥大,从而出现肝实质性小结节;不全间隔肝硬化以出现细纤维间隔为特征,在INCPH患者中不会见到完整的肝硬化型结节[13]。
INCPH诊断肝活检必不可少,主要诊断标准包括以下几方面:(1)显著的门静脉高压临床表现,如食管胃底静脉曲张或其他侧支循环开放,出现腹水,血小板减少、脾肿大,肝功能酶轻度异常等;(2)肝组织学检查排除肝硬化或除外其他病因导致的门静脉高压,门静脉闭塞性改变、结节再生性增生等典型表现提示INCPH;(3)影像学检查缺乏足够的特异性,但结合影像学特征可以辅助排除其他疾病,如血吸虫病、门静脉系统血栓等。超声检查是排除门静脉及肝静脉系统血栓形成的首选方法。影像学门周纤维化[14]或出现闭塞性门静脉病变改变,腹部CT检查观察到突然狭窄的肝内门静脉分支、肝内门静脉系统异常(如管径减小或闭塞性血栓等)[15]等呈现“枯树“样外观闭塞性门静脉改变具有一定提示意义。HVPG正常或轻度升高,或瞬时弹性成像发现肝脏硬度正常或轻度升高对于除外肝硬化具有鉴别诊断意义[16]。
目前对INCPH没有特效治疗方法,推荐参考肝硬化门静脉高压患者的管理进行门静脉高压及相关并发症的治疗[17]。食管胃静脉曲张破裂出血是INCPH患者最常见的并发症,而腹水、肝性脑病和肝细胞癌较肝硬化少见,应定期筛查食管胃静脉曲张,采用非选择性β受体阻滞剂(non-selective β-blocker,NSBB)或/和内镜下静脉曲张治疗术(套扎或硬化治疗)用于食管静脉曲张的预防性治疗;保守治疗失败的反复静脉曲张出血和难治性腹水患者采用经颈静脉肝内门体分流术(TIPS)治疗[2];INCPH患者进行肝移植治疗的证据相对较少,可参考肝硬化患者明确肝移植治疗指征,总体患者移植后远期生存率较高[18];对于极少数发生严重脾功能亢进(自发性出血发作、反复脾梗死)的INCPH患者可考虑行脾切除。
预防性抗凝治疗在INCPH患者中的效果尚不明确,不常规推荐抗凝药物,仅在伴有门静脉血栓形成或高风险高凝状态的患者推荐抗凝治疗[19-20]。但定期筛查门静脉血栓的形成是必要的,目前指南推荐至少每6个月行1次多普勒超声检查以早期发现门静脉血栓[20]。目前有关INCPH远期随访的临床研究表明,其远期预后优于肝硬化患者,10年生存率可达82%[11],出现腹水可能是预后不良的临床表现[18]。
2 门静脉肝窦血管性疾病进一步补充了INCPH疾病谱
随着对非肝硬化性门静脉高压认识的深入,2017年欧洲肝病学会血管性肝病研究小组提出PSVD的概念[10],定义为无肝硬化但以门静脉或肝血窦异常为病变基础的具有结节性再生性增生、闭塞性门静脉病变、肝门静脉硬化、不全间隔肝硬化等特征性病理改变的一类疾病,对非肝硬化性门静脉高压症进行进一步补充[10]。这一概念囊括了HVPG正常,即使合并其他常见慢性肝病(如病毒性肝炎、过度饮酒、代谢综合征等)、合并不伴门静脉海绵状血管瘤的门静脉血栓但有PSVD特征性病理改变的类型,成为完整的疾病谱,范围包括INCPH及不合并门静脉高压但有INCPH肝组织学特征的患者。
2021年Baveno Ⅶ国际门静脉高压专家会议上再次明确了关于PSVD的定义、诊断和治疗的共识意见[21]。出现下列情况时应考虑诊断PSVD:(1)有门静脉高压迹象,但肝硬化特征不典型(如HVPG<10 mmHg,肝硬度测量<10 kPa且肝表面光滑未见萎缩);(2)出现不能解释的肝功能异常,即使没有门静脉高压的迹象。并提出PSVD的诊断需要结合临床、实验室或影像学检查,其中满足肝穿刺标本长度>2 cm且无明显断裂的前提下除外肝硬化,并符合下列标准之一:至少有一种特征性门静脉高压征象或一种特征性病理改变,或具有一种非特异性门静脉高压临床表现伴一种非特征性病理改变(表2)。

表2 肝门窦性血管性疾病的诊断标准
PSVD合并门静脉高压的处理原则与INCPH相同,整体上PSVD的远期预后明显优于INCPH的患者。一项研究[22]纳入91例PSVD的患者,同时符合INCPH诊断的患者30.8%,长期随访发现符合INCPH诊断的PSVD患者Child-Pugh评分较高,失代偿发生率较高(57.1% vs 28.6%,P=0.009), 因此PSVD诊断提出包含了一部分预后良好的非肝硬化性门静脉高压患者。但PSVD仍存在较多尚未解决的问题,无门静脉高压的PSVD的自然病史尚不清楚,影像学、脾脏硬度作为无创方法用于筛查PSVD的价值仍需进一步完善。PSVD患者门静脉血栓的发生率和预测因素,是否需要预防性抗凝及治疗效果仍需要更多的临床证据证实。
3 先天性肝纤维化(congenital hepatic fibrosis, CHF)存在遗传易感因素,门静脉高压综合干预可延缓疾病进展
CHF与常染色体隐性遗传性多囊肾和Caroli’s病具有相同的遗传背景,是由多囊性肝肾疾病1基因突变造成的一种常染色体隐性遗传性疾病,胆管板发育畸形导致胆道系统的异常重构是CHF发病的主要机制[23]。胆管板成熟受阻的时期决定病变累及的部位,累及小叶间小胆管表现为CHF,累及肝内大胆管导致Caroli’s病,或同时累及两种胆管而表现为胆管扩张伴CHF则称为Caroli’s综合征[24](表3)。

表3 根据胆道系统累及部位分类的纤维囊性肝脏疾病
CHF根据疾病的分型可以分为门静脉高压型、胆管炎型、混合型和隐匿型四种。门静脉高压型CHF是最常见的类型,主要表现为脾肿大、脾功能亢进、门脾静脉扩张、侧支循环开放、上消化道出血、腹水等;胆管炎型CHF以碱性磷酸酶、转肽酶升高的胆汁淤积为主要表现,可能存在复发感染和肝内胆管结石,使得发生胆管细胞癌的风险增加,可高达7%。混合型CHF兼有门静脉高压和胆管炎两型的共同特征,而隐匿性CHF常无门静脉高压和胆管炎等相关临床表现,需经肝穿刺病理活组织检查得以诊断。CHF通常在儿童时期被诊断[25],在成年之后可能进而发展成肝硬化,易漏诊或误诊[26]。
肝活检是诊断CHF的金标准,其特征性病理改变包括[27]:(1)弥漫性汇管区桥接纤维化(七巧板样),纤维间隔内可见形态不规则、囊性扩张的胆管结构。(2)与肝硬化假小叶区别,在肝小叶保持完整无损的状况下汇管区极度纤维化,但中央静脉仍位于肝小叶中央而不破坏其微循环正常结构;(3)肝细胞板排列大致正常,一般无肝细胞结节性再生,无典型的假小叶结构,可伴有肝内胆管发育畸形或海绵状扩张。
CHF特异性影像学表现是肝内可见不规则囊性扩张并伴有囊性和实性病变(再生结节)[28]。除上述特异性表现外,腹部彩超和计算机断层扫描、磁共振成像还可见畸形肝(通常为左叶肥厚、右叶萎缩)[29],以及门静脉高压导致的脾肿大、食管胃底静脉曲张、侧支循环开放等表现,尤其是当CHF表现为Caroli’s综合征而增加胆管癌的发生风险时,影像学检查需格外关注胆管癌的相关表现,胆道磁共振可对胆道系统进行全面、细致的评估。
CHF缺乏有效的病因治疗手段,目前根据不同年龄、疾病严重程度不同综合采取有侧重点的对症支持治疗以延缓疾病进展,主要包括抗纤维化治疗、并发症治疗和针对门静脉高压的治疗等[30]。对门静脉高压引起的食管胃底静脉曲张,使用非选择性β受体阻滞剂或内镜治疗进行一级预防;对食管胃底静脉曲张破裂出血的患者需要及时控制出血,有效止血后选择应用NSBB、内镜下治疗、TIPS或外科手术治疗对破裂出血进行二级预防;对于严重的门静脉高压和肝功能失代偿,肝移植手术才能有效的延长患者的生命,对于合并多囊肾患者必要时需要肝肾联合移植。
4 其他肝窦前性非硬化性门静脉高压病因借助影像学和/或组织学检查仔细鉴别
肝脏遗传性出血性毛细血管扩张症也是造成肝窦前性门静脉高压的原因之一[31]。肝动脉与门静脉或肝静脉之间存在异常分流通道形成肝内动脉-门静脉分流、肝内门静脉-肝静脉瘘,通常伴随肝内异常分流,肝动脉-门静脉分流或肝窦血流增加可导致肝纤维组织沉积增加和假性肝硬化,引起门静脉高压和肝性脑病,可通过计算机断层扫描、磁共振成像、多普勒超声或血管造影检查来诊断,不推荐肝活检。对于严重肝功能异常达到肝移植指征患者,小样本研究证实远期预后良好,但需要长期随访监测预防复发[32-33]。
肉芽肿性疾病(结节病、结核病等),由于炎症浸润和非干酪样肉芽肿性炎症破坏,肝活检病理可见胆管损伤及胆管消失,引起局灶性肝内胆管周围纤维化,临床表现为胆汁淤积伴非肝硬化性门静脉高压。血吸虫病由于虫卵在汇管区的沉积也造成门静脉周围纤维化从而出现显著门静脉高压,均应仔细鉴别。
5 总结
引起肝内窦前性非肝硬化性门静脉高压的疾病在临床相对少见,但此类疾病发病机制及临床表现复杂,对于临床肝硬化不突出而门静脉高压表现显著的患者,要尽可能完善相关检查予以细致甄别。影像学对该类疾病鉴别诊断具有重要意义,而确诊常须肝穿刺病理检查,临床医生需全面综合临床、结合影像学资料和病理学资料,尽早对患者做出诊断,避免误诊。NSBB、抗凝治疗以及肝移植临床应用价值及对患者远期预后的改善仍需要更多的临床研究证实。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:夏帅、王冰琼负责课题设计,撰写论文;王冰琼、何志颖参与收集数据和修改论文;尤红、吴晓宁负责拟定写作思路,指导撰写文章并最后定稿。

