离子色谱-脉冲安培法测定糖果中的D-甘露糖醇
俞所银,聂 磊,闫 晴
(1.上海市质量监督检验技术研究院,上海 200233;2.国家保洁产品质量监督检验中心(上海),上海 200233;3.上海食品快速检测工程技术研究中心,上海 200233)
0 引言
D-甘露糖醇(D-Mannitol)又叫己六醇、甘露醇等,广泛存在于多种陆地和海洋植物中,如橄榄、柿子树和藻类等。因保湿补水、双糖代用剂和制备利尿剂等功效在医药、食品和饲料等领域被广泛使用。目前针对D-甘露糖醇分离检测的研究不多,更多的是作为某一种方法同时测定、分离多种糖或糖醇中的一种[1]。市场上出现了很多添加了D-甘露糖醇的无糖食品,已经成为糖尿病患者饮食行业的一个销售亮点,企业将其作为代糖食品为宣传卖点,实际产品中添加的量由于没有相应的检测而不得而知。D-甘露糖醇在产品中的添加,可能涉及到产品标签整改,虚假宣传;且添加量高则可能不被人体代谢,造成肾脏损伤。目前,市场中使用D-甘露糖醇的糖果很多,尤其是无糖薄荷糖和口香糖,但是由于缺乏相应的检测方法,政府部门对其监管以及企业对产品质量的提升均缺少有力的手段,因此建立一种适用食品中D-甘露糖醇的检测方法显得尤为重要。
现行有效的GB 1886.177-2016《食品添加剂D-甘露糖醇》只规定了淀粉、淀粉糖或蔗糖为原料制得的食品添加剂D-甘露糖醇的鉴别试验、理化指标的测定[2],操作相对复杂,且对低含量添加灵敏度和准确性不高。而现行食品中D-甘露糖醇含量尚无检测方法。针对糖醇类物质的检测,主要是比色法[3]、高效液相色谱法和高效离子色谱法等[4-10]。比色法操作简单,成本低,但是抗干扰性差,对于复杂样品定量不准确;高效液相色谱法使用示差或者蒸发光检测器,稳定性好,前处理方便,但是对于糖类检测的灵敏度不够,难以满足低含量样品的检测;离子色谱法前处理简单,灵敏度高,适合复杂样品的分析。
本文采取离子色谱脉冲安培检测器(ion chromatography with pulsed amperometricdetection,IC-PAD),利用糖类在强碱性条件下呈现离子状态,可在阴离子色谱柱上被分离出来的特性进行检测,实现对糖果中D-甘露糖醇含量的定量分析,方法快速高效,适用于大批量样品的检测。
1 材料与方法
1.1 材料和仪器
ICS-5000 型离子色谱仪(美国赛默飞世尔科技公司,配备电化学检测器);电子分析天平(上海梅特勒-托利多仪器公司);SK8210LHC 型超声波清洗仪(上海科导超声仪器有限公司);Milli-Q 型超纯水器(美国 Millipore 公司);G560E型涡旋振荡器(美国Scientific Industries 公司);5804 型高速离心机(德国 Eppendorf 公司);0.22µm Filter Unit 滤膜(天津博纳艾杰尔科技有限公司)。
D- 甘露糖醇标准品(纯度99%,德国Dr.ehrenstorfer 公司);山梨糖醇、麦芽糖醇、赤藓糖醇、木糖醇、麦芽糖、果糖、葡萄糖、蔗糖标准品(纯度>98%,美国A ChemTek,Inc 公司);亚铁氰化钾、乙酸锌(优级纯,国药集团化学试剂有限公司),乙腈(色谱纯,美国Sigma 公司)。
1.2 试验方法
1.2.1 样品处理
胶基糖果(口香糖):准确称取样品1 g(精确到0.001 g)于50 mL 具塞玻璃管中,加入6 mL 水,涡旋1 min;80 ℃水浴加热至全溶,涡旋1 min;冷却至室温后,缓慢加入亚铁氰化钾(106 mg/mL)和乙酸锌(219 mg/mL)各1 mL,用水定容到10 mL,涡旋1 min;以9 000 rad/min 离心作用2 min,过0.22 µm(PTFE)微孔滤膜至样品瓶,待测。
其他糖果(硬糖、软糖、凝胶糖果):准确称取样品1 g(精确到0.001 g)于50 mL具塞玻璃管中,加入6 mL 水,涡旋1 min;80 ℃水浴加热至全溶,涡旋1 min;冷却至室温后,用水定容到10 mL,涡旋1 min;以9 000 rad/min 离心作用2 min,过0.22µm(PTFE)微孔滤膜至样品瓶,待测。
1.2.2 标准曲线的配制
D-甘露糖醇标准储备液(1.0 mg/mL):称取0.010 0 g(精确到0.000 1 g)D-甘露糖醇于10.0 mL 容量瓶中,用水溶解并定容到刻度,4 ℃冰箱中保存一个月。
D-甘露糖醇标准中间液(100 µg/mL):吸取D-甘露糖醇标准储备液1 mL 于10.0 mL 容量瓶,加水定容至刻度。
D-甘露糖醇标准工作液:分别吸取0.10,0.20,0.50,0.80,1.00 mL 甘露糖醇标准中间液于10.0 mL 容量瓶中,用水定容至刻度,相当于1.0,2.0,5.0,8.0,10.0 µg/mL 浓度标准工作溶液。
1.2.3 离子色谱分析条件
色谱柱为Dionex CarboPacTMMA1 BioLCTM(4×250 mm)分离柱,流动相为500 mmol/L 氢氧化钠,等度洗脱;流速为0.45 mL/min;进样量25 µL;柱温为30 ℃;检测器为安培电化学检测器。脉冲积分安培检测器(工作电极:Au 电极;参比电极:Ag/AgCl 电极)。
2 结果与讨论
2.1 色谱条件的确定
对于食品中的糖醇测定,目前现行标准中只有GB 5009.279-2016《食品中木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇的测定》,使用该液相方法测定D-甘露糖醇时,山梨糖醇和D-甘露糖醇出峰时间重合,无法分离,如图1所示。
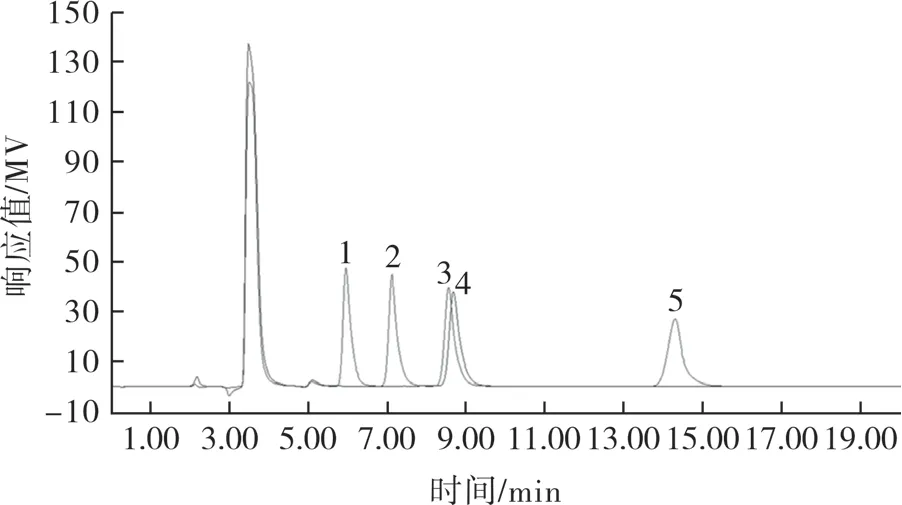
图1 D-甘露糖醇、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇的混合标准溶液HPLC 色谱图Fig.1 Liquid chromatograms of the mixed standard solutions of D-mannitol,erythritol,xylitol,sorbitol and maltitol
离子色谱分离糖醇常用的色谱柱有PA1、PA20 和MA1 等,分别使用上述3 种色谱柱对D-甘露糖醇进行分析。使用PA1 和PA20 色谱柱分离时,由于糖醇的保留时间较短,出峰时间过早(5 min 前),如图2、图3所示。在对实际样品分析时,基质干扰很大,不适于复杂样品分析。

图2 D-甘露糖醇、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇混合标准溶液的PA1 柱色谱图Fig.2 Chromatograms of the mixed standard solutions of D-mannitol,erythritol,xylitol,sorbitol and maltitol by PA1 column

图3 D-甘露糖醇、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇混合标准溶液的PA20 柱色谱图Fig.3 Chromatograms of the mixed standard solutions of D-mannitol,erythritol,xylitol,sorbitol and maltitol by PA20 column
MA1 色谱柱保留时间适中,更适用于糖醇的分析。由于MA1 色谱柱对于氢氧化钠梯度变化不敏感,且不适于使用醋酸钠,所以选择氢氧化钠等度洗脱。通过比较不同浓度的氢氧化钠浓度(500,300,250,200 mmol/L),考察保留时间、峰形和抗干扰情况,最终选择500 mmol/L 氢氧化钠等度洗脱50 min 作为流动相条件。在此条件下D-甘露糖醇的峰形对称且具有良好的保留时间,不受常见的果糖、葡萄糖、蔗糖和麦芽糖的干扰。对于无糖食品中经常使用的木糖醇、山梨糖醇、麦芽糖醇和赤藓糖醇也可以有效分离,如图4所示。

图4 D-甘露糖醇、赤藓糖醇、木糖醇、山梨糖醇和麦芽糖醇的混合标准溶液的MA1 柱色谱图Fig.4 Chromatograms of the mixed standard solutions of D-mannitol,erythritol,xylitol,sorbitol and maltitol by MA1 column
2.2 加热温度的确定
选择成分比较复杂的基质糖果(口香糖)作为空白基质,加入相同质量浓度的D-甘露糖醇标准溶液,分别选取60,80,100 ℃作为低、中、高3 个温度点[11],在相同条件下对分析物进行测定,结果如图5所示。加热20 min 后80,100 ℃样品全部溶解,提取率分别为98.29%,98.63%,而60 ℃加热20 min 的样品没有完全溶解,提取率仅为62.33%。综合考虑选择80 ℃作为提取温度。

图5 不同提取温度对D-甘露糖醇提取效率的影响Fig.5 The effect of extraction temperature on D-mannitol extraction efficiency
2.3 前处理条件的优化
在糖果中除去琼脂、变性淀粉、明胶和果胶等凝固剂、色素和蛋白质后,再进行后续分析,有利于延长色谱柱寿命和降低分析干扰。本文通过不同的沉淀方法,考察其提取效率。在空白的胶基糖果中,加入相同质量浓度的D-甘露糖醇,分别使用乙酸锌溶液和亚铁氰化钾溶液(1∶1;V∶V)、3%的乙酸溶液、乙腈和乙醇作为沉淀蛋白质的试剂[12],在相同的条件下对D-甘露糖醇进行测定。使用乙酸锌溶液和亚铁氰化钾溶液的样品的D-甘露糖醇提取率最好,结果如图6所示。故选择乙酸锌溶液和亚铁氰化钾溶液作为沉淀试剂。

图6 不同沉淀方式对D-甘露糖醇提取效率的影响Fig.6 The effects of precipitation methods on D-mannitol extraction efficiency
2.4 方法学验证
2.4.1 方法的线性范围、检出限和定量限
将甘露糖醇的标准工作溶液按离子色谱条件进行分析,以峰面积对浓度作标准曲线。其中以对应的色谱峰面积为纵坐标y,待测组分的质量浓度为横坐标x,绘制标准工作曲线。经线性回归后求得相关系数,以及分别计算出检出限(LOD)、定量限(LOQ),结果如表1所示。

表1 D-甘露糖醇的线性方程、检出限和定量限Tab.1 Linear equation,limits of detection and limits of quantification of D-mannitol
2.4.2 方法的准确度和精密度
选取3 种有代表性的阴性空白样品基质(凝胶糖果、口香糖、硬糖),分别按0.001%,0.002%,0.005%水平进行加标回收试验,每个添加水平做6 次平行试验。检测结果如表2所示,方法回收率在77.8%~117.9%之间,相对标准偏差(relative standard deviation,RSD)(n=6)为1.77%~9.41%,均小于10%,具有较高的准确性。

表2 3 种糖果中D-甘露糖醇含量的回收率和精密度实验结果(n=6)Tab.2 Recoveries and relative standard deviations of D-mannitol in three kinds of candies (n=6) (单位:%)
2.5 实际样品测定
采用已建立的方法对上海市和苏州市抽查糖果30 份(凝胶糖果10 份、口香糖10 份、硬糖10 份)进行D-甘露糖醇检测,其中凝胶糖果7 份样品被检测出D-甘露糖醇,含量在0.001 099%~0.836 8%,3 份未检出。口香糖9 份样品被检测出D-甘露糖醇,含量在1.018 1%~1.817%,仅1 份未检出。硬糖9 份样品被检测出D-甘露糖醇,含量在0.000 519%~0.605 8%,1份未检出。
3 结语
本文建立离子色谱-脉冲安培检测器测定糖果中D-甘露糖醇含量的方法,前处理简单,抗干扰性强,稳定性高,适合大批量样品的检测。该方法的建立填补现行检测方法的空白,可以为企业提高产品质量提供技术支持,同时为政府监管部门进行风险监测提供有效的技术支撑。

