基于美拉德反应的大豆分离蛋白-普鲁兰多糖可食膜构建及特性研究
林秋汛,王淑瑞,唐 学,潘世会,陈 浩,甘 晶
(1.山东大学 海洋学院,山东威海 264209;2.烟台大学 生命科学学院,山东烟台 264005)
0 引言
大豆分离蛋白(soy protein isolate,SPI)是由脱皮脱脂的大豆进一步去除所含非蛋白成分后得到的一种蛋白产品,价格低廉、富含营养且具有良好的成膜性[1]。但阻水性能差等缺点限制了它的应用[2]。研究表明,美拉德反应可用于蛋白质改性,其通过还原糖的羰基与蛋白质的氨基缩合重排,改变蛋白质结构进而改善蛋白质的功能[3]。美拉德反应对 SPI 进行改进的方法已有研究,但选用何种多糖能更好地发挥其协同作用、美拉德反应程度与蛋白-多糖产物的性能有何联系等问题仍待深入探讨。普鲁兰多糖(pullulan,PUL)是一种由麦芽三糖单元通过α-(1,6)糖苷键相互连接组成的线性聚合物[4],具有良好的阻隔性、抑菌性以及抗氧化能力等,是一种性能优异的成膜材料[5-6],能有效弥补大豆分离蛋白的缺陷。
有鉴于此,试验以大豆分离蛋白和普鲁兰多糖为原料,探究pH 值和配比对美拉德反应程度的影响,进而从配比角度研究 SPI-PUL 成膜性质,探索美拉德反应与膜性能之间的关系,为后续研究提供借鉴。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,普鲁兰多糖(食品级,华豫生物科技有限公司);甘油(分析纯,天津市河东区红岩试剂厂);其他试剂均为分析纯。
1.2 仪器与设备
B-260 型恒温水浴锅(上海亚荣生化仪器厂);RH-KT/C 型磁力搅拌器(艾卡(广州)仪器设备有限公司);YP601N 型电子天平(上海精密科学仪器有限公司);DHG-9140A 型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);T6 新世纪型紫外可见分光光度计(北京普析通用仪器有限责任公司);NR110 型精密色差仪(深圳市三恩驰科技有限公司);211-101 型数显千分尺(东莞市景有模具五金有限公司)。
1.3 方法
1.3.1 美拉德反应产物的制备
1.3.1.1 不同pH 值的影响
参考王鲁慧等[7]方法,略作修改。步骤如下:SPI∶PUL=1∶1 混合→蒸馏水溶解→搅拌15 h →调节pH 值分别为7.0,8.0,9.0,10.0,11.0 →80 ℃搅拌1 h →冷却待测。
1.3.1.2 不同混合比例的影响
SPI∶PUL 配比分别为1∶1,2∶1,3∶1,4∶1,5∶1,调节pH=9.0,其余操作同1.3.1.1。
1.3.2 美拉德反应产物的检测
因美拉德中间反应产物在290 nm 波长处有特征性吸收[8],取1.3.1.1 和1.3.1.2 反应产物,稀释美拉德反应产物浓度至0.06%,用紫外可见分光光度计测定其在290 nm 处的吸光度值。
1.3.3 膜的制备
样液配制步骤同1.3.1.2,向配好的样液加入体积分数3%的甘油,搅拌30 min,然后取20 g 膜液倒入直径为90 mm 的培养皿中,50 ℃烘箱干燥17 h。取出后置于盛有饱和KBr 溶液的干燥皿(60% RH,室温)中,平衡24 h 后检测膜性能。
1.3.4 膜性能检测
1.3.4.1 色差值的测定
使用色差仪测量薄膜色度值,测量Hunter 值L、a、b[9]。根据下式计算膜的总色差ΔE:
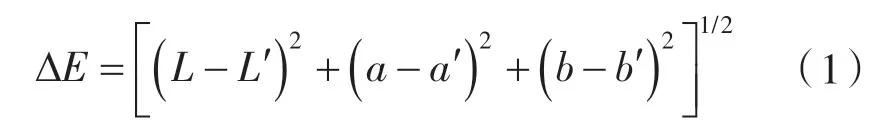
式中 L'、a'、b'——标准样品的Hunter 色度值;
L、a、b—— 膜的明亮程度、红绿度和黄蓝度。
1.3.4.2 厚度的测定
取膜的4 个顶点及中心,使用数显千分尺测量5 点厚度[10]。
1.3.4.3 含水率的测定
取200 mg 膜样品放入铝盒中,干燥至恒重,测量干燥前后的重量[11]。计算含水率:

式中 m0——初始膜重,g;
m'f——干燥后膜重,g。
1.3.4.4 水蒸气透过率的测定
根据ASTM E96-80 标准进行测定。以下式计算水蒸气透过率:

式中 Δm/Δt—— 单位时间内损失水分的重量,g/h;
A—— 密封在玻璃瓶口上的膜面积,m2;
Δp——膜两侧的水蒸气分压差,MPa;
e——膜厚度,m。
1.3.4.5 溶解度的测定
参照WANG 等[9]方法。将膜样品切成3×3 cm 的矩形,烘干至恒重,称重后于蒸馏水中浸泡24 h,溶解后将剩余膜样品再干燥至恒重。以下式计算其在水中的溶解度:

式中 ma——溶解前质量,g;
m1——溶解后质量,g。
1.4 数据分析
每种样品设置3 组平行,结果以平均值±标准偏差表示。采用SPSS 进行统计分析,组间差异显著性采用方差分析,p<0.05 时认为有显著差异。采用MATLAB 进行图形绘制。
2 结果与分析
2.1 反应条件对美拉德反应的影响
2.1.1 pH 值的影响
美拉德反应初级阶段经历Amadori 重排,重排产物的形成条件为pH>7[12],试验以290 nm 处吸光值的大小来表征中间阶段产物的生成数量,进而衡量美拉德反应程度。
由图1所示,不同pH 值条件下SPI-PUL 反应产物紫外吸光值差异显著(p<0.05)。当pH=9时吸光值达最大值,表明在此pH 值下SPI-PUL美拉德反应程度最大,过高或过低的pH 值均会抑制美拉德反应,可能是因为pH 值较低时会抑制美拉德反应中有机酸的生成,从而抑制后续反应的进行[13];而当pH 值较高时缺乏足够的H+催化Amadori 重排[14],故反应程度较小。因此,在后续的研究中,为充分发生美拉德反应,选择pH=9 的反应条件。

图1 pH 值对SPI-PUL 美拉德反应的影响Fig.1 Effect of pH on the Maillard reaction of SPI-PUL
2.1.2 混合比例的影响
如图2所示,随着SPI 比例的增大,吸光值随之增大(p<0.05),表明美拉德反应程度随SPI 比例的升高而增大。可能是因为当SPI∶PUL=1∶1 时,SPI 含量是反应的限制因素,当SPI 占比增加,蛋白分子与多糖分子间碰撞几率增大[15],反应速度加快。

图2 混合比例对SPI-PUL 美拉德反应的影响Fig.2 Effect of mixing ratio on Maillard reaction of SPI-PUL
2.2 美拉德反应对膜性能的影响
2.2.1 美拉德反应对膜色差值的影响
由图3感官评定可知,SPI∶PUL=1∶1 时,膜色泽偏白且亮度高;SPI∶PUL=5∶1 时,膜颜色偏黄绿色,且色泽较深暗。

图3 不同混合比例的SPI-PUL 可食膜Fig.3 SPI-PUL edible films with different mixing ratios
将5 种混合比例的样品根据美拉德反应程度由小到大设置编号为1-5,并将1 号样品作为标准样,计算2-5 样品相对于标准品的ΔL、Δa、Δb和ΔE。
由表1可知,随着美拉德反应程度增大,ΔL为负值且逐渐减小,说明膜的亮度逐渐减小;Δa总体呈增大趋势但仍然为负值,说明膜绿色程度有所减少,但与标准品相比,整体仍偏向绿色;Δb为正值且逐渐增大,说明膜黄色程度加深。随着SPI 混合比例的增加,ΔE 也逐渐增大,与图3所示结果一致,原因是作为蛋白-多糖可食膜,膜颜色受美拉德反应影响较大,随着SPI 浓度升高,美拉德反应程度增大,非酶促褐变程度增加,以至膜ΔE 增加。

表1 SPI-PUL 美拉德反应程度对膜色差值的影响Tab.1 Effect of SPI-PUL Maillard reaction degree on the value of film color difference
2.2.2 美拉德反应对膜厚度的影响
如表2所示,不同反应程度下所制可食膜厚度无显著差异(p>0.05)。膜厚度最小为0.25 mm,最大为0.31 mm,均符合日常可食膜使用厚度标准。猜测可能是由于SPI 微观上为球状结构,分子间产生较多的空隙与通道,PUL 与SPI 混合后能填补其空隙,以至厚度变化不明显[16]。

表2 SPI-PUL 美拉德反应程度对膜厚度的影响Tab.2 Effect of SPI-PUL Maillard reaction degree on films thickness
2.2.3 美拉德反应对膜含水率的影响
如图4所示,随着美拉德反应程度的增大,可食膜的含水率逐渐降低(p<0.05)。SPI∶PUL 由1∶1变为2∶1 时降低幅度最大,当SPI∶PUL=5∶1 时可食膜含水率最低,为14.80%。这可能是因为PUL含有较多羟基,可与水作用形成氢键,具有较高持水性能,但当SPI 占比增加时,会影响PUL 分子舒展,氢键形成数量减少,导致其持水性能下降[17]。

图4 SPI-PUL 美拉德反应程度对膜含水率的影响Fig.4 Effect of SPI-PUL Maillard reaction degrees on water content of films
2.2.4 美拉德反应对膜水蒸气透过率的影响
如图5所示,SPI-PUL 可食膜的水蒸气透过率呈先减小后增大的趋势,不同配比的可食膜水蒸气透过率有显著区别(p<0.05)。当SPI∶PUL=2∶1时水蒸气透过率为3.77 g·m-1·h-1·MPa-1,达到最小值。从成膜原料的角度分析原因,SPI∶PUL由1∶1变为5∶1 的过程中,随着SPI 占比增加,SPI 与PUL 两者氢键作用增强,可食膜结构更加致密,水蒸气透过率降低;当SPI∶PUL=2∶1 时,达最低值;SPI 占比继续增加,成膜性质受SPI 影响更大,膜液粘度变高,导致脱气效果差,形成的膜孔隙多,同时,具有良好保湿能力的PUL 含量降低后,膜液水分蒸发大,在成膜网络结构中形成的空洞数量多,因此膜的水蒸气透过率较高[18]。以普鲁兰多糖为成膜基质的复合膜,如吴佳[19]制备的普鲁兰多糖-壳聚糖复合膜、高翔[20]制备的普鲁兰多糖-结冷胶复合膜等,膜水蒸气透过率随PUL 含量的降低均呈现先减小后增大的趋势,与本试验结果相似。从美拉德反应的角度看,美拉德反应高级阶段会生成不溶于水的大分子聚合物,根据2.1.2 结果可知,SPI∶PUL=3∶1 至5∶1 时,美拉德反应较大,因此膜液中所含的不溶性大分子聚合物较多,阻碍了SPU-PUL 交联,使膜含有较多的空隙,故水蒸气透过率大。

图5 SPI-PUL 美拉德反应程度对膜水蒸气透过率的影响Fig.5 Effect of SPI-PUL Maillard reaction degrees on water vapor permeability rate of films
2.2.5 美拉德反应对膜溶解度的影响
如图6所示,随着SPI 配比增加,美拉德反应程度增大,膜溶解度逐渐减小(p<0.05)。当SPI∶PUL=1∶1 时溶解度为33.09%,为最大值;当SPI∶PUL=5∶1 时溶解度为23.44%,达到最小值。

图6 SPI-PUL 美拉德反应程度对膜溶解度的影响Fig.6 Effect of SPI-PUL Maillard reaction degree on film solubility
可食膜溶解度随美拉德反应程度增加而减小。一方面是因为美拉德反应进入高级阶段后,会形成不溶于水的大分子聚合物,反应程度越大,生成的不溶物也越多,以至膜的溶解度降低。另一方面,由于PUL 主链上含有高浓度羟基[21],亲水性强,但随着SPI 占比增加,SPI 与PUL 复合后掩盖了PUL 的亲水性,水分难以向膜内扩散从而导致溶解度降低。KCHAOU 等[11]研究鱼明胶-葡萄糖美拉德复合膜的溶解度,发现美拉德反应能够降低膜的溶解度。HAMDI 等[22]通过美拉德反应修饰蓝蟹壳聚糖基膜,发现随着美拉德反应程度的增大,可食膜的溶解度降低。
2.2.6 综合指标评价
综合色差、厚度、含水率、水蒸气透过率和溶解度指标,发现SPI∶PUL=5∶1 时可食膜性能最优。此外,王强[23]在研究不同SPI-PUL 配比对膜抗拉伸强度的影响时发现,随着配比中SPI 含量的增加,膜抗拉伸强度增大。借鉴到本试验可知,SPI∶PUL=5∶1 的膜抗拉伸强度最大。综上所述,最佳成膜配比为SPI∶PUL=5∶1。
3 结语
(1)SPI-PUL 美拉德反应程度与pH 值和配比密切相关。当pH=9 时,美拉德反应程度最大;美拉德反应程度随SPI 占比的增加而增大。
(2)美拉德反应程度影响膜的性质。随着膜基质中 SPI 占比的增加,美拉德反应程度增大,膜颜色加深,色差加大;膜的厚度无显著变化;膜的含水率和溶解度均减小;水蒸气透过率先减小后增大再减小。当SPI∶PUL=2∶1 时,水蒸气透过率最小,为3.77 g·m-1·h-1·MPa-1。综合评价得出,SPI-PUL 可食膜最佳成膜工艺为pH=9,混合比例为SPI∶PUL=5∶1。
(3)本文从pH 值、配比2 个方面探究影响美拉德反应程度的因素,检测膜的物理性质,构建膜的性能与美拉德反应程度间的关系。但美拉德反应过程较为复杂,影响因素繁多,且该反应如何影响膜性质机理仍较为模糊,需待进一步研究。试验还未对膜的抗氧化性、抑菌性等化学性质及机械强度进行研究,待后续进一步探讨。

