circRNA_103809 对结肠癌SW480 细胞线粒体功能和炎症因子水平的调节作用①
李 毅 李文忠 师 路 高志勇 王聆宇
(西南医科大学附属成都三六三医院胃肠外科,成都 610097)
结肠癌(colon cancer,CC)是人类最常见、最具侵袭性的恶性肿瘤之一,其病死率在恶性肿瘤中排名第二[1]。由于其发展速度快及高度转移性,治疗策略受到限制[2]。因此,急需发现用于早期检测、术后监测和管理的新型生物标志物。环状RNA(circular RNAs,circRNAs)是一类新型的非编码RNA,具有闭环结构且缺乏编码潜力[3]。随着高通量测序方法的发展,circRNAs 在各种动物组织和细胞样品中表现出高丰度和高组织特异性表达[4]。重要的是,已有研究证明circRNA 失调与多种人类疾病(如神经系统疾病和癌症)有关[5-6]。据报道,circRNA_103809 可促进肺癌发展[7]。circRNA_103809 参与调控与肝癌和结直肠癌的发生[8-9]。在既往研究中,ZHANG 等[10]发现hsa_circRNA_103809在结直肠癌中下调,且与肿瘤分期和淋巴结转移有关。然而hsa_circRNA_103809 在结直肠癌中的功能和机制尚未在体内或体外深入研究。本文主要探究hsa_circRNA_103809 在结肠癌中的表达及circRNA_103809对结肠癌SW480细胞的作用。
1 材料与方法
1.1 材料 DMEM培养基、Trizol试剂和4%多聚甲醛溶液(美国Invitrogen);10%胎牛血清(FBS,美国Gibco);牛血清白蛋白(bovine serum albumin,BSA)(美国Sigma);CCK8试剂盒、RIPA裂解液、BCA试剂盒、ECL 发光液和DAPI 染色液(上海碧云天);Lipo⁃fectamine2000转染试剂和反转录试剂盒(美国Thermo Fisher);SybGreenⅠ(上海捷瑞生物);Annexin-V-PI(美国BD Pharmingen);聚偏二氟乙烯(PVDF)膜(美国Millipore);兔抗胱天蛋白酶(caspase,cas)-3 抗体多克隆抗体(ab13847)、兔抗caspase-9 单克隆抗体(ab185719)、兔抗Bcl-2单克隆抗体兔抗(ab32124)、兔抗Bax 单克隆抗体兔抗(ab32503)、辣根过氧化物酶(HRP)标记的山羊抗兔IgG(ab205718)、HRP-兔抗小鼠IgG(ab6728)、山羊抗兔IgG(Alexa Fluor®488,ab150077)(英国Abcam);小鼠抗Lamin A 单克隆抗体(#86846)、p65 单克隆抗体(#8242)(美国CST);BD MitoScreen(JC1)试剂盒(美国BD Biosci⁃ences);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malonaldehyde,MDA)测定试剂盒(美国Sigma-Aldrich);IL-1β、IL-6和IL-4 ELISA试剂盒(美国R&D Systems 公司);酶标仪(美国BioTek);SmartSpec Plus 分光光度计Accuri C6 流式细胞仪(美国BD Biosciences);ABI PRISM7500PCR 仪(美国Applied Biosystems);光学显微镜(日本尼康);LV-circRNA_103809、LV-scramble(中国广州锐博生物)。
1.2 方法
1.2.1 细胞培养 人正常结肠上皮细胞FHC 及结肠癌细胞系HCT116、SW620、SW480和HT29均购自美国典型培养物保藏中心(ATCC)。细胞均在37 ℃、5%CO2的潮湿空气中,在添加有10%FBS 和1%青霉素-链霉素的DMEM培养基中培养。
1.2.2 结肠癌患者样品检测 临床获取25例结肠癌组织样本和癌旁组织样本,qRT-PCR 检测circ-RNA_103809的表达水平。
1.2.3 细胞分组及转染 将SW480 细胞分为对照组(不转染),circRNA_103809 过表达组(LV-circ-RNA_103809组)及其阴性对照组(LV-scramble组)。SW480细胞(1×106个/孔)接种于6个孔板,培养24 h后,使用Lipofectamine2000 转染试剂分别对应分组将100 nmol/L LV-circRNA_103809和LV-scramble转染细胞。
1.2.4 CCK8 检测细胞增殖能力 将SW480 细胞按1.2.3 分组转染24 h,10 µl CCK8 溶液添加到平板的每个孔中。37 ℃下孵育1 h,使用酶标仪测量450 nm 处吸光度,孵育4 d,通过测量450 nm 处的吸光度评估活细胞数量。
1.2.5 qRT-PCR 检测circRNA_103809、Ki67 和p21mRNA 的表达 根据制造商的说明,使用TRIzol试剂从结肠癌组织、癌旁组织和结肠癌细胞中提取总RNA。SmartSpec Plus 分光光度计中测量RNA 浓度和纯度。A260/A280在1.8~2.0 之间表示RNA 纯度高,用于进一步检测。按照cDNA 逆转录试剂盒和qPCR 试剂试剂盒的说明书分别将RNA 逆转录成cDNA 并制备qPCR 体系。使用ABI PRISM7500 系统定量,反应条件:95 ℃预变性5 min,95 ℃变性10 s,65 ℃退火延伸30 s,40个循环。引物序列如下:circRNA_103809 正向引物为5'-ACGCATTCTTC⁃GAGACCTCT-3',反向引物为5'-TGCCTGTAACTCCTCTTCAGT-3';GAPDH 正向引物为5'-GAAGGT⁃GAAGGTCGGAGTC-3',反向引物为5'-GAAGATG⁃GTGATGGGATTTC-3';Ki67 正向引物为5'-ACGCCTGGTTACTATCAAAAGG-3',反向引物为5'-CAGACCCATTTACTTGTGTTGGA-3';p21 正向引物为5'-CCTGGTGATGTCCGACCTG-3',反向引物为5'-CCATGAGCGCATCGCAATC-3'。将GAPDH 水平用于标准化circRNA 和mRNA 相对表达,应用2-ΔΔCt计算。每个样品进行重复分析3次。
1.2.6 Annexin-V-FITC/PI 染色 收集按1.2.3 步骤转染的48 h 的各组SW480 细胞,PBS 洗涤3 次,4 ℃、1 000 g 离心5 min,弃上清液,将细胞重悬于膜联蛋白结合溶液,10µl膜联蛋白V 悬浮。室温下避光添加异硫氰酸荧光素(FITC)和碘化丙啶(PI)溶液。15 min后,采用流式细胞仪检测凋亡。
1.2.7 蛋白质印迹分析 收获SW480 细胞并用细胞裂解缓冲液裂解以进行免疫印迹。蛋白质(每泳道30 µg)以10%SDS-PAGE 凝胶分离,转移至聚偏二氟乙烯膜。含5%牛奶Tween20(TBST)的Tris 缓冲盐水室温封闭膜1 h,与一抗β-actin(1∶1 000)、Lamin A(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、caspase3(1∶500)、caspase9(1∶1 000)、p65(1∶1 000)4 ℃孵育过夜。TBST 洗涤3次后,将膜与抗兔、抗鼠IgG-HRP 偶联的二抗(1∶4 000)37 ℃孵育1 h。TBST 洗涤3 次后,使用ECL 发光液检测免疫反应带。
1.2.8 线粒体膜电位的测量 根据制造商的说明,使用BD MitoScreen 试剂盒评估ΔΨm 的变化。将SW480 细胞按照1.2.3 分组转染48 h 后,收获细胞并用PBS 洗涤2 次。然后将细胞悬浮在500 µl JC-1 工作溶液中,并在37 ℃孵育30 min。通过流式细胞仪记录总共1×104个细胞,采用BD CFlow 软件分析。
1.2.9 SOD 和MDA 测定 SW480 细胞按照1.2.3分组转染48 h 后,离心获取细胞并裂解,收集上清液,并通过BCA 试剂盒测定蛋白质浓度。根据生产商的说明,将裂解液(35 µg)用于测定SOD 和MDA活性。
1.2.10 ELISA 检测炎症因子IL-1β、IL-6 和IL-4收集各组转染SW480 细胞,离心10 min。收集上清液,使用ELISA 试剂盒检测IL-1β、IL-6、TNF-α,每个样品重复3次。
1.2.11 免疫荧光染色检测NF-κBp65 的核定位将各组转染SW480 细胞用溶于0.1%Triton100-PBS的4%多聚甲醛溶液固定20 min,5%BSA-PBS 封闭1 h。细胞与抗NF-κBp65 抗体在2%BSA-PBS 中于4 ℃孵育过夜。Alex Fluor 488 山羊抗兔IgG 的2%BSA-PBS 溶液作为二抗,避光孵育1 h。DAPI 对细胞核染色1 min,荧光显微镜拍摄图像。
1.3 统计学分析 所有数据均表示为至少3 个独立实验的±s,使用SPSS19.0 软件的单因素方差分析(one-way ANOVA)统计分析,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 circRNA_103809 对结肠癌细胞增殖能力的影响 如图1 所示,与人正常结肠组织及上皮细胞相比,结肠癌组织及各结肠癌细胞中circRNA_103809的表达显著下调(P<0.05),选择表达相对低的SW480 继续实验。与对照组相比,LV-circRNA_103809 组SW480 细胞中circRNA_103809 表达显著上调(P<0.05),细胞活性显著降低(P<0.05),Ki67表达显著下调(P<0.05),p21 表达显著上调(P<0.05),LV-scramble组差异无统计学意义(P>0.05)。
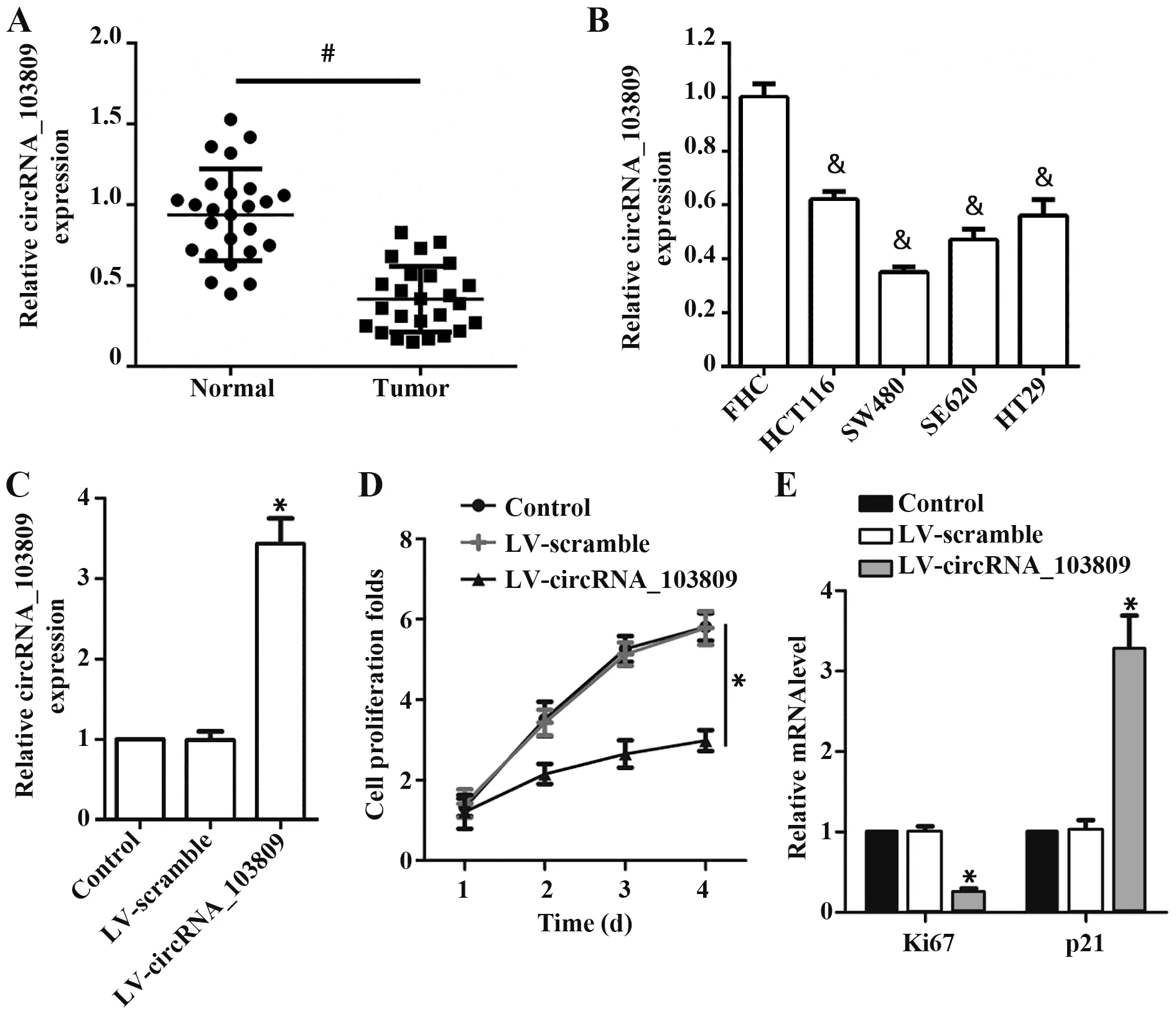
图1 circRNA_103809抑制结肠癌SW480细胞增殖Fig.1 circRNA_103809 inhibits proliferation of colon can⁃cer SW480 cells
2.2 circRNA_103809 对结肠癌SW480 细胞凋亡的影响 如图2 所示,与对照组相比,LV-circRNA_103809 组SW480 细胞凋亡率显著升高(P<0.05),LV-scramble 组细胞凋亡率差异无统计学意义(P>0.05)。
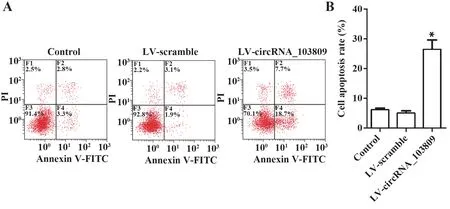
图2 circRNA_103809诱导结肠癌SW480细胞凋亡Fig.2 circRNA_103809 induces apoptosis of colon cancer SW480 cells
2.3 circRNA_103809 对结肠癌细胞线粒体功能的影响 如图3所示,与对照组相比,过表达circRNA_103809降低SW480细胞线粒体膜电位,并显著上调Bax/Bcl-2、cleaved cas9/cas9 和cleaved cas3/cas3(P<0.05)。LV-scramble组差异无统计学意义(P>0.05)。

图3 circRNA_103809 对结肠癌SW480 细胞线粒体功能的影响Fig.3 Effect of circRNA_103809 on mitochondrial func⁃tion of colon cancer SW480 cells
2.4 circRNA_103809 对结肠癌细胞氧化应激的影响 如图4 所示,与对照组相比,过表达circRNA_103809减少SW480细胞中SOD含量(P<0.05),增加MDA 含量(P<0.05),LV-scramble 组差异无统计学意义(P>0.05)。
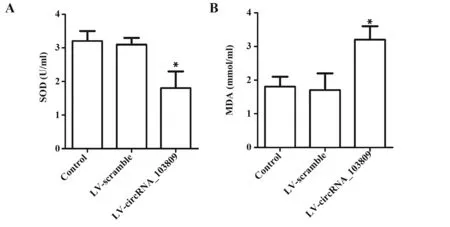
图4 circRNA_103809对结肠癌SW480细胞氧化应激的影响Fig.4 Effect of circRNA_103809 on oxidative stress of colon cancer SW480 cells
2.5 circRNA_103809 对结肠癌SW480 细胞炎症反应的影响 如图5 所示,与对照组相比,LV-circ-RNA_103809 组SW480 细胞上清液中IL-1β 和IL-6水平显著降低(P<0.05),IL-4 水平显著升高(P<0.05),SW480 细胞核中p65 表达显著下调,免疫荧光结果显示过表达circRNA_103809 减少p65 的细胞核定位。LV-scramble 组差异无统计学意义(P>0.05)。
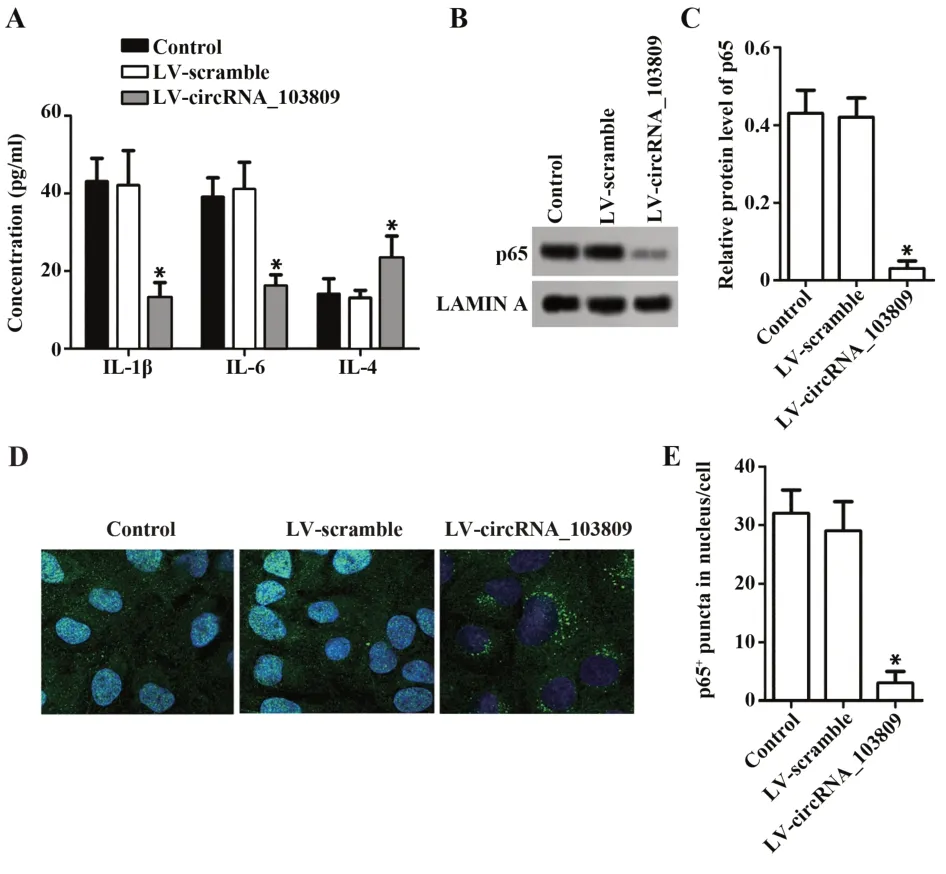
图5 circRNA_103809 对结肠癌SW480 细胞炎症反应的影响Fig.5 Effect of circRNA_103809 on inflammatory response of colon cancer SW480 cells
3 讨论
结肠癌是一种恶性肿瘤,发病率高,一般认为与环境因素、遗传因素有关[11]。结肠癌常规治疗包括手术,辅助治疗和分子靶向治疗,但预后不理想[12-13]。因此有必要进一步研究结肠癌的发生发展及其潜在分子机制,为结肠癌的诊断和治疗提供理论依据,以改善患者预后并减轻患者痛苦。越来越多的研究表明,circRNA 在生命过程中许多方面都发挥至关重要的作用,例如分化、增殖、转移和侵袭。例如circRNA-CDR1as(与小脑变性相关蛋白1转录物反义)可通过影响miR-7 表达参与多种癌症生物学功能[14]。BIAN 等[8]研究表明Hsa_circRNA_103809 在大肠癌组织中的表达显著下调,并通过miR-532e3p/FOXO4轴调控大肠癌细胞增殖和迁移。本研究结果与之一致,结果显示circRNA_103809 在结肠癌组织与细胞中的表达较正常组织和细胞显著降低。进一步过表达circRNA_103809,则SW480细胞活力显著下降,Ki67 表达显著下调,p21 表达显著上调。因此,过表达circRNA_103809 能抑制SW480细胞增殖。
凋亡是消除癌细胞的主要机制,可以用作癌症药物开发研究的重要靶标[15]。本研究表明过表达circRNA_103809 可诱导SW480 凋亡,线粒体膜电位降低,促进凋亡蛋白表达上调,Bax/Bcl-2、cleaved cas9/cas9 和cleaved cas3/cas3 比值显著升高。线粒体跨膜电位降低是细胞凋亡早期的不可逆事件[16]。抗凋亡蛋白Bcl-2 和促凋亡蛋白Bax 同属于Bcl-2 家族,是细胞凋亡内源性线粒体途径的重要调节因子[17]。线粒体膜通透性增加,线粒体释放细胞色素到细胞质中,会激活cas-9,进而导致cas-3 的裂解,最终导致细胞凋亡[18]。
肿瘤治疗过程中常以抗氧化酶为作用靶点,通过降低抗氧化剂(如SOD)水平导致细胞损伤和死亡而具有抗癌作用[19]。MDA 水平作为脂质过氧化的标志物,通常用作细胞和组织中氧化损伤的标志[20]。本研究表明过表达circRNA_103809 降低SW480 细胞中SOD 水平,升高MDA 水平,通过增强氧化应激诱导细胞凋亡。
炎症在癌症发展中发挥重要作用,其不仅具有肿瘤促进剂的作用,还能通过诱导血管生成、侵袭和转移而影响肿瘤发生的进程[21-22]。本研究结果表明过表达circRNA_103809 可显著下调促炎因子IL-1β 和IL-6 表达,上调抗炎因子IL-4 表达,显著下调NF-κB p65 表达并减少p65 的核定位。NF-κB 对许多控制各种细胞反应(例如凋亡,应激和炎症)的靶基因发挥作用。临床和实验室研究表明NF-κB途径参与多种人类疾病,例如心肌病、糖尿病肾病、白内障和癌症[23-26]。NF-κBp65 作为NF-κB 家族重要成员,与各种刺激、应激有关,尤其是氧化应激[27]。受刺激时,NF-κB被激活并转移到细胞核中。因此circRNA_103809 通过调控NF-κBp65 的核定位抑制炎症反应,从而阻止肿瘤发生进程。
综上所述,circRNA_103809 在结肠癌中表达下调,并通过降低细胞增殖、诱导细胞凋亡、增强应激反应和抑制炎症发挥抑癌功能。这些结果提示circRNA_103809可能是一种新型治疗靶标。

