SERS纳米探针对电刺激过程中细胞内产生活性氧的检测
陈嘉敏, 曲孝章,4, 齐国华, 徐蔚青, 金永东, 徐抒平
SERS纳米探针对电刺激过程中细胞内产生活性氧的检测
陈嘉敏1,2, 曲孝章1,2,4, 齐国华3, 徐蔚青1,2, 金永东3, 徐抒平1,2
(1. 吉林大学化学学院, 超分子结构与材料国家重点实验室, 2.理论化学研究所, 长春 130012; 3. 中国科学院长春应用化学研究所, 电分析化学国家重点实验室, 长春 130022; 4. 吉林大学第一医院, 长春 130031)
电刺激是用于细胞内紊乱电活动引起疾病的一类重要治疗方式. 在电刺激过程中是否会诱导细胞内活性氧(ROS)水平的改变, 以及常规抗氧化抑制药物与电刺激治疗同时运用带来的影响, 目前尚未有相关研究. 本文设计了一种具有较好生物相容性的金/银核壳纳米棒表面增强拉曼(SERS)活性探针, 用于电刺激过程中细胞内产生ROS的检测. 将该探针与细胞共孵育, 使其内化入细胞, 对细胞进行不同时间的电刺激, 利用拉曼光谱对SERS探针的信号进行检测. 实验结果表明, 随着电刺激时间的延长, SERS信号减弱, 说明细胞内产生ROS的量明显增加. 该传感机制是利用ROS能刻蚀金/银核壳纳米棒的银壳, 从而使其变薄引起SERS信号减弱. 抗坏血酸(AA)和谷胱甘肽(GSH)两种抗氧化抑制剂类药物与电刺激同时运用时, 可观察到它们会对电刺激过程产生的ROS有清除作用. 该研究发展了一类用于细胞内ROS检测的光谱方法, 也为异常的氧化应激和肿瘤治疗过程中的组合用药提供了建议.
活性氧; 表面增强拉曼光谱; 电刺激; 原位检测
生物电场和电流广泛存在于细胞中, 在调节各种生物过程中起着重要作用. 细胞内紊乱的电活动会引起各种疾病(如癫痫、 帕金森病、 心脏病等). 为了调整紊乱的电活动, 电刺激(Electrostimulus, ES)成为一种有效的治疗方法[7]. 与药物治疗相比, ES是一种快速可控的方法, 可以避免化学药物的缺点, 即外源性物质进入细胞后, 需要较长的作用时间以及产生无法控制的副作用. Qi等发现ES可导致细胞色素c的释放[8]、 Caspase-3的激活[7]和磷酸化丝氨酸的外化[9], 可加速细胞凋亡. 因此, ES也有可能成为肿瘤治疗的有效手段. ES在导致细胞凋亡过程中, 细胞内ROS的产生是否存在动态改变, 目前尚未有文献进行探讨. 此外, 在ES治疗中, 如果同时有一些抗氧化药物的辅助治疗, 是否会对肿瘤治疗产生干扰, 这也需要ROS响应型探针进行原位评价.
由于ROS寿命短、 生理浓度低, 所以检测和量化ROS具有较高的挑战性. 目前检测方法有分光光度法[10]、 荧光[11~13]、 化学发光[14]、 电子顺磁共振[15,16]、 电子自旋共振波[17~19]和电化学法[20,21]等. 表面增强拉曼光谱(SERS)技术由于具有独特的指纹信息、 灵敏度高、 操作简单、 对生物样品近乎无损的特点, 在细胞分析中得到了广泛应用[9]. 由于ROS几乎没有拉曼信号, 因此大多采用间接SERS技术检测ROS. 目前SERS检测ROS的方法主要有两种: (1)基于拉曼报告分子(如对氨基苯硫酚、 4-巯基苯硼酸)与ROS发生化学反应而产生拉曼信号改变进行传感[22,23]; (2)基于SERS物理增强机制的调控方法, 即利用ROS刻蚀银壳并使银壳变薄导致SERS信号减弱的策略[5].
本文设计了具有较好生物相容性的金/银核壳纳米棒SERS活性探针, 利用该探针对ROS响应的特性检测电刺激过程中细胞内产生的ROS. 其传感机制是利用ROS刻蚀银壳后使银壳变薄, 导致SERS信号减弱形成ROS的turn-off检测方式(Scheme 1); 研究了抗坏血酸(AA)和谷胱甘肽(GSH)两种药物对清除电刺激过程产生ROS的可能性. 本研究发展了一类新型的ROS检测纳米探针, 揭示了电刺激可导致细胞内ROS上调的现象, 为异常的氧化应激用药提供了建议.
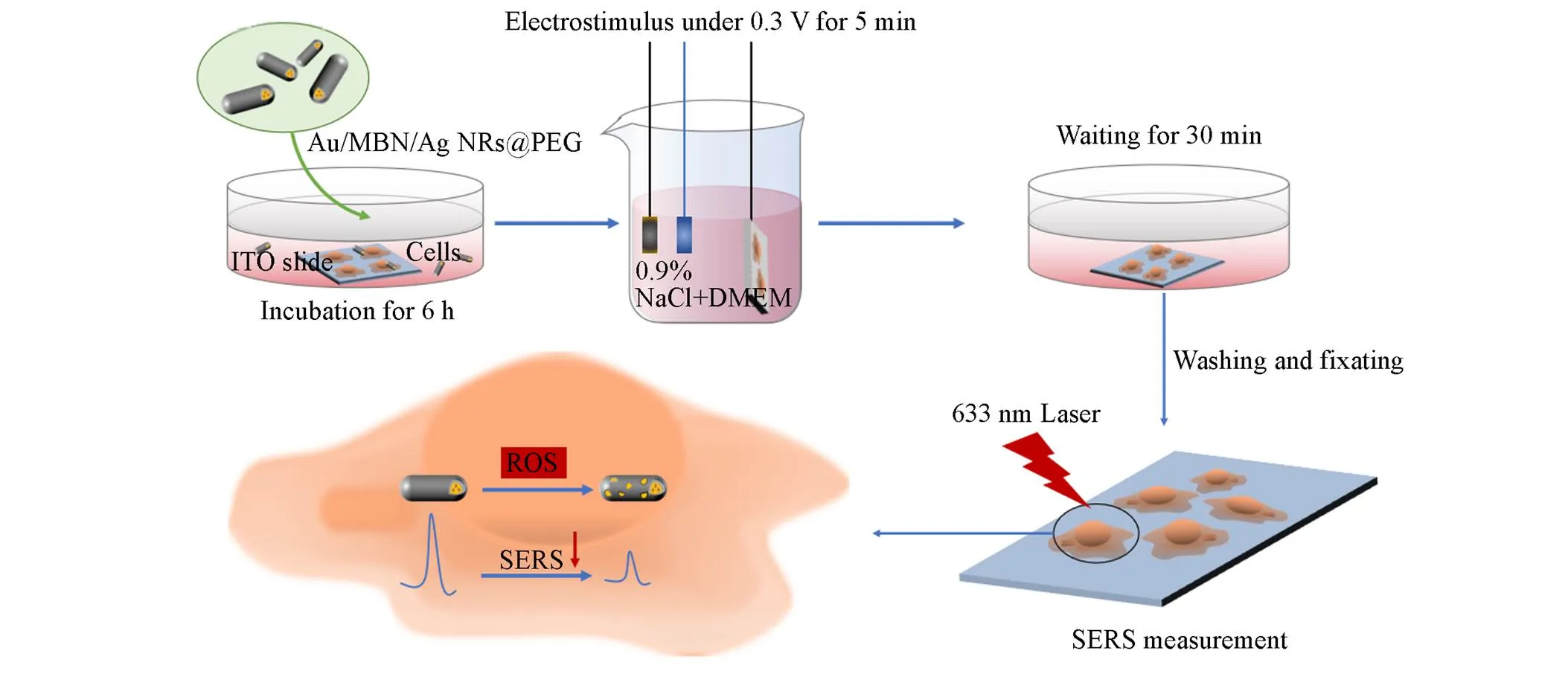
Scheme 1Process of electrostimulus after the probe and cell incubation and SERS sensing of ROS
1 实验部分
1.1 试剂与仪器
三水合氯金酸(HAuCl4·3H2O, 分析纯)、 十六烷基三甲基溴化铵(CTAB, 纯度99%)、 十六烷基三甲基氯化铵(CTAC, 纯度99%)、 4-巯基苯腈(MBN, 纯度96%)和二甲基亚砜(DMSO, 分析纯)均购自阿拉丁试剂公司; 硼氢化钠(NaBH4, 纯度98%)购自天津市福晨化学试剂厂; 抗坏血酸(AA, 纯度98%)、 过氧化氢(H2O2, 质量分数30%)和硝酸银(AgNO3, 分析纯)均购自北京化工厂; 0.25% 胰蛋白酶溶液(EDTA)、 牛血清蛋白(FBS)、 细胞培养基(DMEM, Invitrogen)、 磷酸盐缓冲溶液(PBS, 0.1 mol/L, pH=7.4)和Hank平衡盐溶液(HBSS)缓冲溶液(0.1 mol/L)均购自赛默飞世尔生物化学制品有限公司; 噻唑蓝(MTT, 纯度98%)购自Sigma公司; 细胞组织固定液(质量分数4%多聚甲醛)购自索莱宝试剂; 活性氧(ROS)检测试剂盒(DHCFH-DA)购自上海贝博生物科技有限公司; L⁃还原型谷胱甘肽(GSH, 纯度98%)购自Sigma⁃Aldrich公司; 甲氧基聚乙二醇-硫醇(mPEG-SH, 分子量5000)购自天津红太阳金博达生物技术有限公司; 氧化铟锡(ITO)导电玻璃购自珠海凯为光电有限公司.
JEM-2100F型透射电子显微镜(TEM, 日本电子株式会社); LAMBDA365型紫外-可见光光度计(UV-Vis, 美国PerkinElmer公司); Zetasizer Nano ZS型动态光散射粒度仪(DLS, 英国Malvem公司); LabRAM Aramis型共聚焦拉曼系统(Raman, 美国Horiba Jobin Yvon公司); FV1000型共聚焦荧光显微镜(日本Olympus公司); GF-M3000型酶标仪(山东高密彩虹分析仪器有限公司); CHI660E型电化学工作站(上海辰华仪器有限公司).
1.2 SERS纳米探针的合成
首先, 根据文献[24]方法合成了金纳米棒(Au NRs). 将5.0 mL Au NRs加入16.4 μL 1.0 mmol/L MBN溶液, 搅拌12 h. 离心(6000 r/min, 8 min)去除未反应的MBN, 制得MBN@Au NRs粒子.
在搅拌下, 向12 mL 80 mmol/L CTAC溶液中加入1.2 mL 1.8 nmol/L MBN@Au NRs、 0.9 mL 10 mmol/L AgNO3水溶液和0.9 mL 0.1 mol/L AA溶液. 将该混合液恒温加热至60 ℃保持反应3 h. 将该反应液离心(5000 r/min, 5 min)洗涤. 向沉淀中加水至4.0 mL, 重悬浮可得Au/MBN/Ag NRs.
为了提高Au/MBN/Ag NRs的生物相容性, 在Au/MBN/Ag NRs表面修饰了mPEG-SH分子. 向3 mL Au/MBN/Ag NRs中加入3 μL吐温后, 搅拌20 min. 400 r/min离心5 min去除多余的吐温; 然后加入 3 μL 1 mmol/L mPEG-SH溶液, 搅拌12 h后离心(4000 r/min, 5 min)清洗; 将获得的探针重悬浮于1.0 mL水中, 得到1.0 mg/mL SERS纳米探针(Au/MBN/Ag NRs@PEG).
1.3 细胞毒性实验
采用 MTT实验来评估SERS探针对细胞的毒性. 首先, 将乳腺癌细胞(MCF-7)和肝癌细胞(HepG2)分别接种在96孔微量滴定板上. 向每个孔中加入200 μL细胞, 然后在37 ℃下孵育12 h. 使用冷PBS缓冲溶液洗涤细胞3次. 将不同浓度的SERS纳米探针(0, 0.1, 0.2, 0.4 mg/mL, 各100 μL)分别加入到孔中. 将细胞放入细胞培养箱中, 在37 ℃下培养24 h. 用冷PBS缓冲溶液洗涤细胞3次后, 向每个孔中加入5 μL 5.0 mg/mL MTT溶液, 之后在37 ℃下孵育4 h. 除去上述含有MTT的培养基后, 向孔内加入150 μL DMSO. 通过酶标仪微孔板读取器读取578 nm下的吸光度值. 以不加纳米探针的细胞组作为空白对照组. 利用公式[细胞存活率(%)=(实验值OD均值/对照组OD均值)×100%, 其中, OD为吸光度]求出存活率, 并将其做出柱状图.
1.4 ROS对SERS纳米探针的刻蚀效应
在水溶液加入H2O2来验证SERS纳米探针用于ROS传感的可行性. 首先配制不同浓度(0, 200, 400, 600和1000 μmol/L)的H2O2溶液. 将20 μL H2O2溶液与20 μL SERS纳米探针在室温下混合反应30 min. 将样品滴在玻璃片上, 在60 ℃下烘干. 用激光共聚焦拉曼系统采集样品处的SERS光谱. 采集15个点的SERS光谱做平均谱处理.
1.5 电刺激后细胞中ROS的荧光成像检测
如Scheme 1所示, 首先将MCF-7细胞接种于ITO导电玻璃上, 然后保持0.3 V的电压, 电刺激不同的时间(0, 1, 3, 5, 7和9 min). 待刺激结束后30 min, 加入2 μL DCFH-DA荧光探针孵育30 min, 用PBS缓冲溶液洗涤3次, 加入细胞组织固定液固定20 min, 再用PBS缓冲溶液洗涤3次. 用激光共聚焦荧光显微镜进行荧光成像(激发波长为488 nm). DCFH-DA荧光探针本身没有荧光. 当进入细胞后被细胞内的酯酶水解生成DCFH. 而DCFH不能穿透细胞膜, 使探针被标记到细胞内. 在ROS存在下, DCFH被氧化生成发绿色荧光的DCF. 绿色荧光强度与细胞内的ROS水平成正比.
1.6 电刺激后细胞及细胞内ROS的SERS检测
将ITO玻璃(直径1 cm的正方形)平放于六孔板内, 将细胞接种于ITO玻璃上. 待细胞增殖至ITO玻璃的80%, 向2 mL培养基中加入SERS活性探针(1.0 mg/L, 800 μL). 放入细胞培养箱中孵育6 h后, 用PBS缓冲溶液洗涤3次.
通过Scheme 1所示的装置, 对ITO玻璃上的细胞进行不同的时间(0, 1, 3, 5, 7和9 min)的电刺激, 电压设定为0.3 V. 等待30 min之后, 用PBS缓冲溶液洗涤3次. 加入细胞组织固定液反应20 min, 再用PBS缓冲溶液洗涤3次. 最后, 用激光共聚焦拉曼系统对电刺激后浸泡在PBS缓冲溶液(pH=7.4)中的细胞进行SERS检测. 每组样品选取10个以上细胞, 每个细胞上采集5~8个点的SERS光谱, 做平均谱处理.
1.7 药物消除电刺激作用的检测
首先将细胞接种于ITO玻璃上, 加入不同浓度的SERS探针孵育6 h后, 用PBS缓冲溶液洗涤3次. 然后加入不同浓度的AA与谷胱甘肽(GSH)(0.1, 0.5, 1.0 mmol/L)孵育20 min, 之后用PBS缓冲溶液洗涤3次. 采用0.3 V的电压进行电刺激5 min. 等待30 min之后, 采用PBS缓冲溶液洗涤3次, 加入细胞组织固定液反应20 min, 再用PBS缓冲溶液洗涤3次. 最后, 用激光共聚焦拉曼系统对电刺激后的细胞进行SERS检测.
2 结果与讨论
2.1 SERS纳米探针的表征
采用了银包金纳米棒的核壳型纳米粒子作为SERS探针. 在银壳和金核之间引入了拉曼报告分子MBN. 首先, 对合成的探针进行了紫外-可见光谱表征. 如图1(A)所示, 制备的金纳米棒的等离激元共振峰位于645 nm处. 修饰MBN后, Au NR的等离激元共振峰从645 nm蓝移至635 nm. 在此基础上包裹银壳层后, 在400 nm左右出现了银的吸收带. 修饰mPEG后, Au/MBN/Ag NRs蓝移了2 nm.

Fig.1 UV⁃Vis spectra(A) and Zeta potentials(B) of Au NRs, MBN@Au NRs, Au/MBN/Ag NRs, and Au/MBN/Ag NRs@PEG, and the SERS spectra of MBN@Au NRs(a) and Au/MBN/Ag NRs(b)(C)
采用动态光散射粒度仪对Au NRs, MBN@Au NRs, Au/MBN/Ag NRs和Au/MBN/Ag NRs@PEG进行了表征. 由图1(B)中电位测量结果可见, 修饰MBN前后的Au NRs、 合成的Au/MBN/Ag NRs以及修饰mPEG后的Au/MBN/Ag NRs都带正电. MBN@Au NRs(7.2 mV)的电位相较于AuNRs(6.4 mV)增大了0.8 mV, 表明MBN@Au NRs表面的化学环境发生微小变化, MBN成功地修饰在Au NRs上. Au/MBN/Ag NRs的电位(9.4 mV)相较于MBN@Au NRs(7.2 mV)增大了2.2 mV. Au/MBN/ Ag NRs@PEG的电位(4.1 mV)相较于Au/MBN/Ag NRs的电位(9.4 mV)减小了5.3 mV, 表明 m-PEG成功修饰在Au/MBN/Ag NRs的表面.
对MBN@Au NRs和Au/MBN/Ag NRs进行了SERS表征. 图1(C)显示, Au/MBN/Ag NRs的SERS信号强度比MBN@Au NRs明显增强. 根据文献[25]对拉曼光谱峰进行归属可知, 587 cm-1处的峰为 Au—CN摇摆振动, 1072 cm-1处的峰为苯环C—C面外弯曲振动, 1178 cm-1处的峰为C—N伸缩振动, 1580 cm-1处的峰为C=C伸缩振动, 2226 cm-1处的峰为C≡N伸缩振动.
采用TEM对获得的金纳米棒以及Au/MBN/Ag NRs进行表征. 由图2(A)可见, 所合成的Au NRs的平均尺寸约为55 nm×23 nm. 图2(B)为Au/MBN/Ag NRs的TEM照片. 可见, 在AuNRs的外侧实现了一层平均厚度为6 nm的银壳包裹. 所获得Au/MBN/Ag NRs的尺寸为60 nm×38 nm.

Fig.2 TEM images of MBN@Au NRs(A) and Au/MBN/Ag NRs(B)
2.2 纳米探针的毒性
研究选取了MCF-7和HepG2进行细胞相关实验. 首先, 采用MTT实验评价了制得的SERS纳米探针对细胞的毒性. 以不加SERS纳米探针组为控制组. 图3(A)比较了修饰了mPEG-SH前后MCF-7细胞存活率的差异. 通过对比可发现, Au/MBN/Ag NRs@PEG与细胞共孵育后的存活率明显提高, 说明PEG能提高生物相容性. 在Au/MBN/Ag NRs@PEG的浓度为0.4 mg/mL时, 细胞存活率达到80%. 当再增加探针的浓度时, 细胞存活率低于80%. 因此, 选取0.4 mg/mL的Au/MBN/Ag NRs@PEG探针浓度进行后续实验. 图3(B)为HepG2与不同浓度(0, 0.1, 0.2, 0.4 mg/mL)的Au/MBN/Ag NRs@PEG孵育24 h后的细胞存率活柱状图, 可见, 随着Au/MBN/Ag NRs@PEG浓度的增加, 细胞的存活率降低, 并且当Au/MBN/Ag NRs@PEG浓度为0.4 mg/mL时, 细胞的存活率在80%以上, 说明探针具有低毒性.

Fig.3 Cell viabilities of MCF⁃7 cells after incubated with different concentrations of Au/MBN/Ag NRs, and Au/MBN/Ag NRs@PEG for 24 h(A) and cell viabilities of HepG2 cells after incubated with Au/MBN/Ag NRs@PEG for 24 h(B)
2.3 ROS对纳米探针的刻蚀作用
已有研究表明, ROS对银壳有刻蚀的作用, 导致银壳变薄, SERS信号减弱[5,26]. 利用H2O2代表ROS, 进行ROS传感可行性的评价. 向含有0.4 mg/mL探针的细胞培养基中加入不同浓度的H2O2, 进而评价其对银壳层的刻蚀效果. 如图4(A)所示, 随H2O2浓度的增加紫外吸收发生蓝移. 由于银壳变薄, 导致其等离激元带位移, 且金纳米棒与银壳之间的耦合也减弱, 进一步降低拉曼报告分子的SERS信号[26]. 因此, 可以通过SERS光谱强度的下降来传感H2O2. 由图4(B)可知, 随着H2O2浓度的增加, SERS信号逐渐减弱. 图4(C)为SERS光谱在1072 cm-1处的强度图, 同样体现出SERS信号随H2O2浓度的增加而减弱的规律. 该结果显示, 利用Au/MBN/Ag NRs@PEG对H2O2的最低检测浓度为200 μmol/L. TEM照片显示, 经1.0 mmol/L H2O2刻蚀后银壳变薄, 由原来的6.0 nm降为3.5 nm左右[图4(C)插图].

Fig.4 UV⁃Vis spectra(A) and SERS spectra(B) of Au/MBN/Ag NRs@PEG after incubated with different concentrations of H2O2(0, 200, 400, 600, and 1000 μmol/L) for 30 min, histogram of SERS intensities at 1072 cm-1 and TEM images(inset) before and after the nanoprobe etched with 1 mmol/L of H2O2(C)
2.4 电刺激后细胞中ROS的荧光成像和SERS检测
为了验证细胞经过电刺激后会产生ROS, 使用ROS检测试剂盒(DCFH-DA)检测细胞内的ROS, 并通过共聚焦荧光成像来观察ROS产生量. 图5(A)~(F)为MCF-7细胞经过不同的电刺激时间(0, 1, 3, 5, 7, 9 min)后, 加入DCFH-DA染料的共聚焦荧光成像图片. 可见, 随着电刺激的时间延长, 氧化产物DCF的荧光强度增强. 图5(G)为荧光强度的统计图. 可见, 随着电刺激时间增加, ROS产生得越来越多.
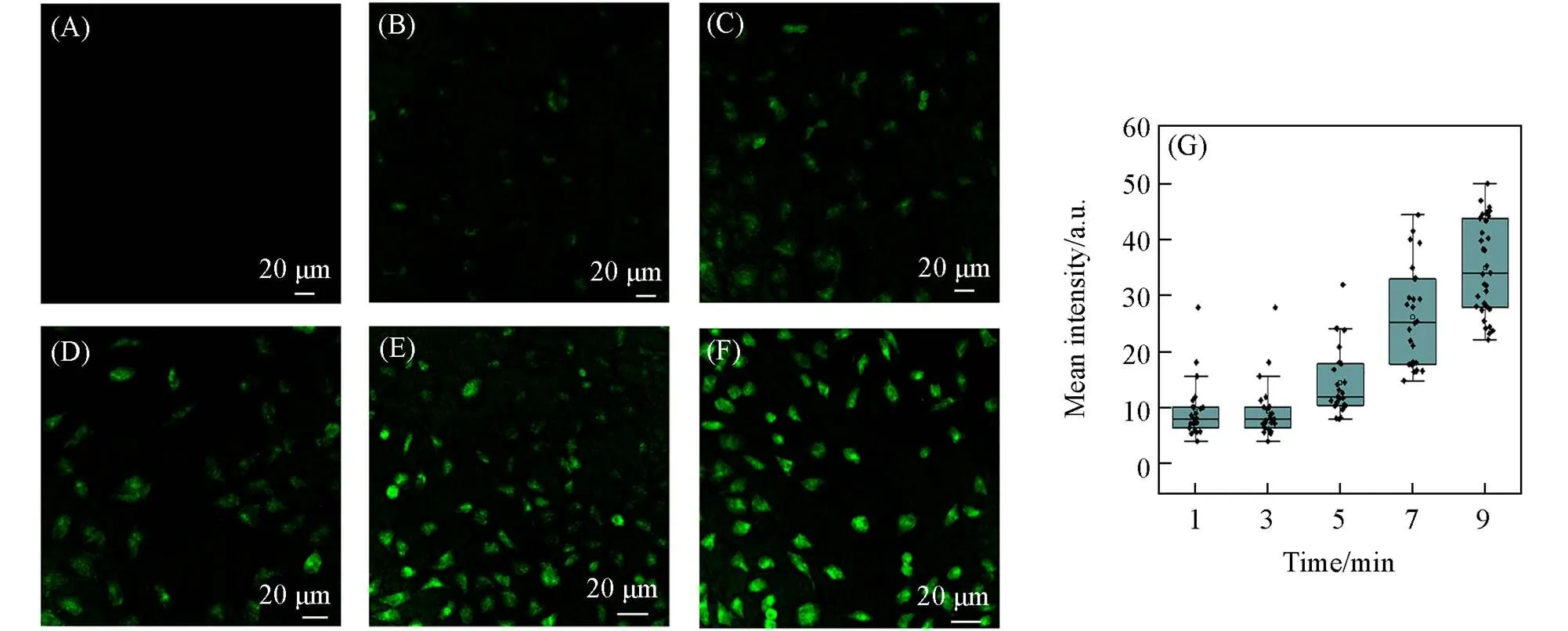
Fig.5 Confocal fluorescence images of MCF⁃7 cells after different ES time of 0(A), 1 min(B), 3 min(C), 5 min(D), 7 min(E) and 9 min(F) and stained by DCFH⁃DA kit, and corresponding statistics of the mean fluorescence intensity(G)
将SERS活性探针分别与MCF-7和HepG2细胞共孵育6 h后, 对细胞进行了不同时间的电刺激. 刺激后产生的ROS对SERS活性探针进行刻蚀反应. 响应30 min后, 用激光共聚焦拉曼系统检测了该过程中探针的SERS信号变化, 从而探测ROS含量的波动变化. 图6(A)和(C)分别为MCF-7和HepG2细胞上获得的电刺激后SERS探针信号. 随着电刺激时间的延长, SERS信号强度减弱. 图6(B)和(D)分别为SERS光谱在1072 cm-1处的柱状图. 同样显示出细胞随着电刺激时间的延长, SERS信号强度减弱, 证明了ROS的产生量变大, 与DCFH-DA染料的共聚焦荧光成像结果(图5)的规律一致. 由此可以说明, 电刺激会导致细胞内部ROS上调, 达到杀伤肿瘤的目的. 利用平均荧光强度比的计算, 可得电刺激9 min后ROS的产生量相较未受电刺激的细胞内部, 可提高35%.

Fig.6 SERS spectra of MCF⁃7 cells(A) and HepG2 cells(C) after different time of ES(0, 1, 3, 5, 7, 9 min), and the histograms of SERS intensity of MCF⁃7 cells(B) and HepG2 cells(D) at 1072 cm-1
2.5 外加药物抵抗电刺激的副作用

Fig.7 SERS spectra of nanoprobes obtained from HepG2 cells after incubated with AA(A) and GSH(C), and ES for 5 min, the histograms of SERS intensity of AA(B) and GSH(D) at 1072 cm-1
研究表明, 抗坏血酸和谷胱甘肽等物质能有效清除ROS[6]. 为了探讨这些药物与ES肿瘤治疗过程中是否可以同时使用, 加入不同浓度的AA与GSH与细胞共孵育, 再对HepG2细胞进行5 min电刺激, 对刺激后的细胞内ROS水平进行SERS检测, 如图7(A)和(C)所示. 将未加药物与加1 mmol/L药物在1072 cm-1处的平均SERS强度[图7(B)和(D)]进行对比, 可见, HepG2细胞随着药物浓度的增加, SERS信号强度增强, 证明了抗坏血酸和谷胱甘肽等物质能一定程度抵消掉生成的ROS. 两种药物相比可知, GSH的抗氧化作用更为显著. 将加1 mmol/L GSH与未加药物组相比可知, 该浓度GSH可抵消63%的电刺激过程中细胞产生的ROS. 结果证明, 抗氧化药物的使用会削弱肿瘤ES治疗的效果. 但对异常的氧化应激过程中产生的ROS的消除将有一定帮助.
3 结 论
设计了通过金/银核壳纳米棒SERS探针, 实现了细胞内ROS的检测. 该探针在0.4 mg/mL浓度下具有低毒性. 将该探针与细胞共培养, 可以使其较好地内化进入细胞, 可进行胞内检测. 将该探针用于电刺激治疗过程中细胞内产生ROS的评价, 结果证实, 电刺激能增加细胞内ROS的产生, 且随着电刺激时间的延长, 细胞内ROS的产量明显增加. 抗坏血酸(AA)和谷胱甘肽(GSH)两种药物可削弱电刺激肿瘤治疗过程产生的ROS, 与未加药物的ROS产量相比, 可抵消63%的ROS, 对肿瘤的治疗有一定的干预作用. 该研究将ES治疗与ROS产生建立了直接关联, 也从一定程度上证实, ES对癌症的治疗机制有可能与其ROS产生相关. 抗氧化药物的运用将一定程度上抵消了细胞内的ROS产生量, 可用于异常的氧化应激过程中产生ROS的消除, 但对ES治疗肿瘤的杀伤力有一定的削弱, 为ES治疗中辅助用药提供了建议. 同时可证明, 电刺激可引发细胞走向凋亡, 有可能成为肿瘤治疗的一种方式.
[1] Cui K., Fan C. C., Chen G. X., Qiu Y. Y., Li M. W., Lin M., Wan J. B., Cai C. S., Xiao Z. Y.,.,2018,, 12137—12144
[2] Noubade R., Wong K., Ota N., Rutz S., Eidenschenk C., Valdez P. A., Ding J., Peng I., Sebrell A., Caplazi P., deVoss J., Soriano R. H., Sai T., Lu R., Modrusan Z., Hackney J., Ouyang W.,, 2014,, 235
[3] Pizzino G., Irrera N., Cucinotta M., Pallio G., Mannino F., Arcoraci V., Squadrito F., Altavilla D., Bitto A.,, 2017,8416763
[4] Wang Y. Q., Li L. L., Zhao W. B., Dou Y., An H. J., Tao H., Xu X. Q., Jia Y., Lu S., Zhang J. X., Hu H. Y.,, 2018,, 8943—8960
[5] Yue J., Shen Y. T., Wang J. Q., Xu W. Q., Xu S. P.,, 2019,, 317—325 (岳静, 申燕婷, 王佳琪, 徐蔚青, 徐抒平. 光散射学报, 2019,, 317—325)
[6] Wang H., Wan K., Shi X.,., 2019,, 1805368
[7] Qi G. H., Sun D., Tian Y., Xu C., Zhang Y., Wang D. D., Ma K. S., Xu S. P., Jin Y. D.,., 2020,, 7861—7868
[8] Qi G. H., Li H. J., Zhang Y., Li C. P., Xu S. P., Wang M. M., Jin Y. D.,., 2019,, 1408—1415
[9] Qi G. H., Wang J. F., Ma K. S., Zhang Y., Zhang J., Xu W. Q., Jin Y. D.,., 2021,, 2183—2190
[10] Wang L.Y., Zhu B. H., Deng Y. T., Li T. T., Tian Q. Y., Yuan Z. G., Ma L., Cheng C., Guo Q. Y., Qiu L.,, 2021,2101804
[11] Zhang Y., Li J. H., Bai J., Li L. S., Xia L. G., Chen S., Zhou B. X.,., 2017,, 259—269
[12] Chen X., Wang T. G., Le W. J., Huang X., Gao M. H., Chen Q., Xu S. H., Yin D. T., Fu Q. G., Shao C. G., Chen B. D., Shi D. L.,, 2020,, 3430—3450
[13] Li Z. Y., Xiao L.,, 2017,, 1920—1927
[14] Ye S., Hananya N., Green O., Chen H. S.,Zhao A. Q., Shen J. G., Shabat D., Yang D.,, 2020,, 14326—14330
[15] Tan H. N., Zhao Y. X., Xu X. T., Sun Y., Li Y. H., Du J. X.,, 2020,, 42
[16] Misak A., Brezova V., Chovanec M., Luspai K., Nasim M. J., Grman M., Tomasova L., Jacob C., Ondrias K.,, 2021,, 1286
[17] Cui K., Fan C. C., Chen G. X., Qiu Y. Y., Li M. W., Lin M., Wan J. B., Cai C. S., Xiao Z. Y.,., 2018,, 12137—12144
[18] Rota C., Chignell C. F., Mason R. P.,, 1999,, 873—881
[19] Moore T. A., Samson K., Ahmad I. M., Case A. J., Zimmerman M. C.,, 2020,, 244—248
[20] Yagi M., Takemoto S., Sasase R.,, 2004,, 152—153
[21] Yun Y. J., Lu Z. S., Jiao X. D., Xue P., Sun W., Qiao Y., Liu Y.,, 2022,, 108049
[22] Zou Z., Shi Z. Z., Wu J. G., Wu C., Zeng Q. X., Zhang Y. Y., Zhou G. D., Wu X. S., Li J., Chen H., Yang H. B., Li C. M.,, 2021,, 10789—10797
[23] Si Y. M., Li L. L., Qin X. J., Bai Y. C., Li J. S., Yin Y. D.,, 2019,, 1—10
[24] Nikoobakht B., El⁃Sayed M. A.,., 2003,, 1957—1962
[25] Wang Y., Yan B., Chen L.,., 2013,, 1391—1428
[26] Shen Y. T., Liang L. J., Zhang J., Li, Z. Y., Yue J., Wang J. Q., Xu W. Q., Shi W., Xu S. P.,:., 2019,, 84—89
SERS Nanoprobe for the Detection of Reactive Oxygen Species in Cells Produced by Electrostimulus
CHENJiamin1,2, QUXiaozhang1,2,4, QIGuohua3, XUWeiqing1,2, JINYongdong3, XUShuping1,2*
(,,,,130012,;,,,130022,;,130031,)
Electrostimulus(ES) is an important therapeutic method for diseases caused by abnormal intracellular electrical activity. Also, ES can induce apoptosis of cells, which is a potential tumor treatment method. At present, there are no relevant studies on the intracellular reactive oxygen species(ROS) levels produced in the process of ES, and what effects will be brought by the simultaneous implementation of conventional antioxidant inhibitor drugs and ES therapy. In this study, a kind of gold/silver core-shell nanorod-based surface-enhanced Raman(SERS)-active probe with good biocompatibility was designed for the detection of intracellular ROS generated during ES. The sensing mechanism realized the quantitative analysis of ROS based on the principle that ROS could etch the silver shell, leading to a decrease of the SERS signal of the SERS probe. The probe was co-incubated with cells and was internalized into cells. The cells were then electrically stimulated for different periods of time. Finally, the signal of the SERS probe was detected in vivo. The experimental results show that the SERS signal weakens with the extension of ES time, indicating that the amount of ROS produced in cells increases significantly. In addition, two antioxidation inhibitors, ascorbic acid(AA) and glutathione(GSH), were studied when combined with ES. It was observed that they could eliminate reactive oxygen species(ROS) produced by electrical stimulation. This study developed a new method for intracellular ROS detection and suggests a combination of drugs for abnormal oxidative stress and tumor therapy. Also, ES can induce apoptosis of cells, which is a potential tumor treatment method.
Reactive oxygen species; Surface-enhanced Raman spectroscopy; Electrostimulus;Detection
O657.37
A
10.7503/cjcu20220033
2022-01-13
2022-02-18.
徐抒平, 女, 博士, 教授, 主要从事表面增强拉曼光谱方面的研究. E-mail: xusp@jlu.edu.cn
国家自然科学基金(批准号: 21873039, 22173035)、 2021年度应用光学国家重点实验室开放基金(批准号: SKLAO2021001A)和吉林大学学科交叉融合创新项目(批准号: JLUXKJC2020106)资助.
Supported by the National Natural Science Foundation of China(Nos. 21873039, 22173035), the Open Project of State Key Laboratory of Applied Optics, China(No.SKLAO2021001A14) and the Interdisciplinary Integration Innovation Project of Jilin University, China(No.JLUXKJC2020106).
(Ed.: Y, K, S)

