DNA银纳米簇在功能核酸荧光生物传感器中的应用
王君旸, 刘争, 张茜, 孙春燕, 李红霞
DNA银纳米簇在功能核酸荧光生物传感器中的应用
王君旸, 刘争, 张茜, 孙春燕, 李红霞
(吉林大学食品科学与工程学院, 长春 130062)
DNA银纳米簇(DNA-AgNCs)是以DNA为模板, 通过碱基杂环上的N原子与Ag+结合, 用NaBH4将Ag+还原得到的具有荧光性质的新兴纳米探针. 由于DNA-AgNCs具有合成方法简单、 生物相容性好和荧光发射波长可调等优点, 使其在分析检测等领域具有广泛的应用. 本文对DNA-AgNCs的合成和荧光性质两个方面进行了综述, 分类总结了以DNA-AgNCs为无标记荧光探针在功能核酸荧光生物传感器方面的应用, 对其不足与应用潜力进行展望, 以期为未来的研究与应用提供借鉴.
DNA银纳米簇; 功能核酸; 荧光; 生物传感器
金属纳米簇(Metal nanoclusters, MNCs)通常由几个到几十个金属原子组成, 直径小于2 nm, 尺寸接近于电子的费米波长[1,2]; 超小尺寸诱导的量子限制效应使金属纳米团簇具有离散的能级水平和分子状特性(如非同寻常的光学、 电化学、 催化、 磁性和手性等), 其能够通过能级间电子跃迁实现光吸收和发射[3,4], 弥合了传统有机金属化合物和晶体金属粒子之间的差距, 被认为是单金属原子和等离子金属纳米粒子间的桥梁[5]. MNCs常被用于传感、 成像、 催化、 生物偶联及电子设备等领域. 在传感方面, Au, Ag, Cu及Pt纳米簇已被用作传感探针, 其中银纳米簇(AgNCs)由于其更加优异的性质, 受到了广泛关注. 与容易光致漂白的有机染料相比, AgNCs具有更高的量子产率、 更强的光稳定性、 更低的制备成本及简单的合成方法, 与半导体量子点相比, AgNCs毒性低、 更加绿色环保, 且不会发生荧光闪烁. 此外, AgNCs具有较好的抗氧化性、 高表面活性、 较大的斯托克位移、 良好的生物相容性、 优良的催化性质、 手性以及抗菌活性性质, 且避免了传统荧光探针分子在应用中需要分离等困难, 已成为纳米团簇领域发展前景最好的材料之一. 但由于AgNCs尺寸超小、 活性很高, 易发生不可逆的团聚而降低其表面能, 形成无荧光的银纳米颗粒, 因此需要利用稳定剂防止其聚集, 保持光学活性[6~8]. 在溶液中制备MNCs可以利用树枝状大分子、 蛋白质、 DNA和硫醇(如谷胱甘肽)等作为模板, 而以DNA作为模板则具有可调控光学信号变化、 可将纳米团簇模板与分子识别相结合等优势. 由于DNA中碱基杂环上的N原子能与Ag+相结合, 用NaBH4作为还原剂, 将Ag+还原即可得到具有稳定荧光性质的DNA银纳米簇(DNA-AgNCs)[9], 具有合成方法简单、 制备条件温和、 生物相容性好、 生物毒性低和荧光发射波长可调等优点, 使其在理化分析、 生物检测和生物成像方面得到广泛应用.
功能核酸是具有特定功能和特殊结构及序列的核酸, 被广泛应用于生物传感器的构建. 随着对功能核酸和纳米材料的结构和功能特性研究的不断发展, 越来越多基于纳米材料的功能核酸传感器被报道, DNA-AgNCs也得到了研究者的广泛关注. 以DNA为模板生成的AgNCs不仅能够作为无标记荧光探针, 还由于其光谱特性高度依赖于DNA的序列和结构, 已被广泛应用于构建功能核酸荧光生物传感器来进行生物分析. 目前, 已有的关于DNA银纳米簇的综述大多是对检测的目标物种类进行归纳, 本综述结合本课题组的研究工作, 从银纳米簇合成与荧光调控的视角, 对DNA-AgNCs作为无标记荧光探针在功能核酸荧光生物传感器中的应用进行了分类总结, 并对DNA-AgNCs目前面临的挑战和未来的发展作了简要的展望(Scheme 1), 以期为未来的研究工作提供借鉴.
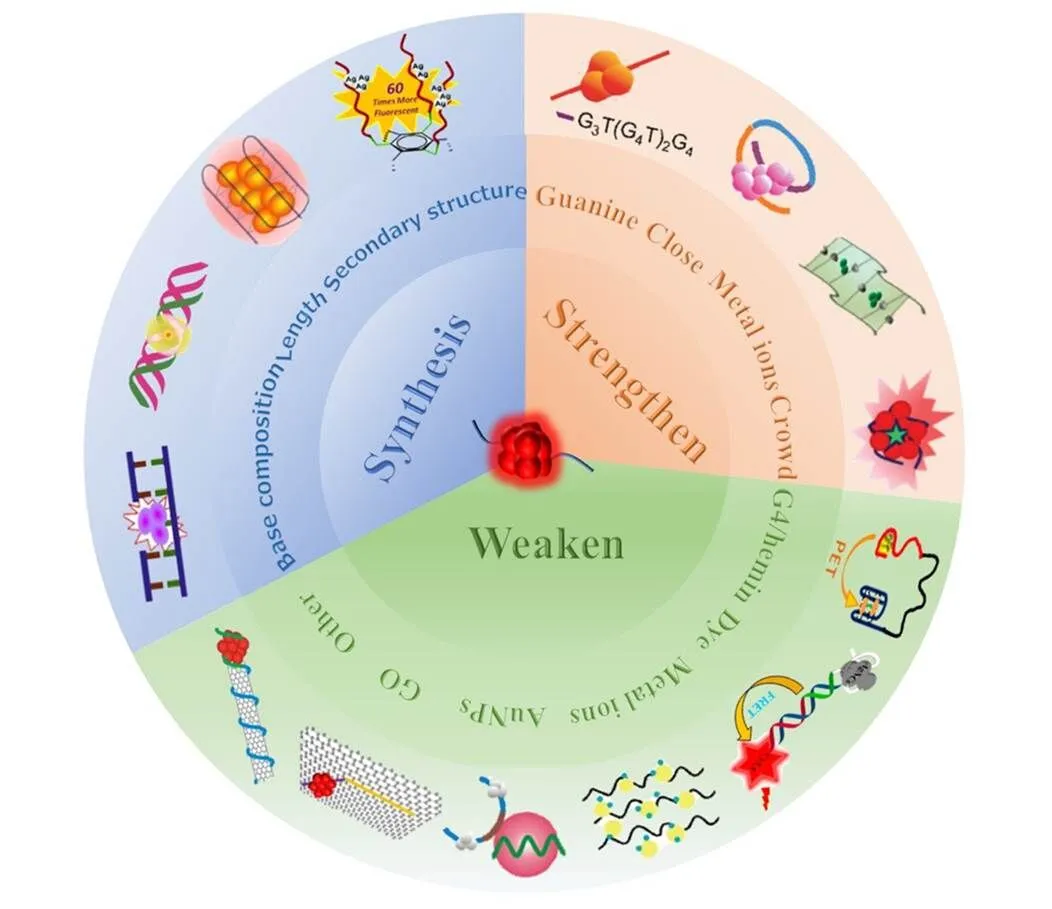
Scheme 1Application of DNA silver nanoclusters in the fluorescence biosensors based on functional nucleic acids
1 DNA银纳米簇的制备与表征
2004年, Dickson等[9]首次报道了利用寡核苷酸5'-AGGTCGCCGCCC-3'为模板, 在5 mmol/L磷酸盐缓冲液(pH=7.5)中与AgNO3混合并冷却至0 ℃, 然后加入NaBH4剧烈振摇, 从而合成DNA-AgNCs. 通过质谱分析可知, 添加NaBH4会导致1~4个Ag原子与12个碱基的寡核苷酸结合. DNA-AgNCs的大小随时间变化, 从Ag1到Ag4/寡核苷酸的团簇尺寸随时间变化, 在400~600 nm之间具有强烈的特征性电子跃迁. 在260 nm激发波长下, 在630 nm处附近可观察到明显的荧光发射.
用于构建AgNCs的DNA可以是单链DNA、 双链DNA或DNA纳米结构. Ag+与不同碱基的亲和性不同, 亲和性大小遵循胞嘧啶(C)>鸟嘌呤(G)>腺嘌呤(A)>胸腺嘧啶(T)的规律[图1(A)和(B)], 其中Ag+与C上的N3之间作用最强, G和A上的N7及T上的N3次之, 因此常用富C序列作为DNA-AgNCs的模板, 形成稳定的C-Ag+-C结构, 同时Ag+被包覆于碱基之间, 限制了银核生长[10~12]. DNA-AgNCs的合成需要银盐(AgNO3)、 富C序列的寡核苷酸模板及适当比例的还原剂(NaBH4), 最常用的DNA∶Ag+摩尔比为1∶6, 过量的Ag+可能有助于形成等离子体纳米粒子. 不同的DNA模板、 缓冲液、 pH值、 温度及孵育时间会导致DNA-AgNCs的荧光存在差异[图1(D)和(E)]. Ag+与DNA上的C碱基有较强亲和力, 在还原剂的作用下Ag+被还原, Ag0团簇成核. 虽然DNA-AgNCs形成的具体过程尚不清楚, 但有足够的证据证明荧光DNA-AgNCs的簇状结构为杆状[图1(C)], 具有自由电子核[13].
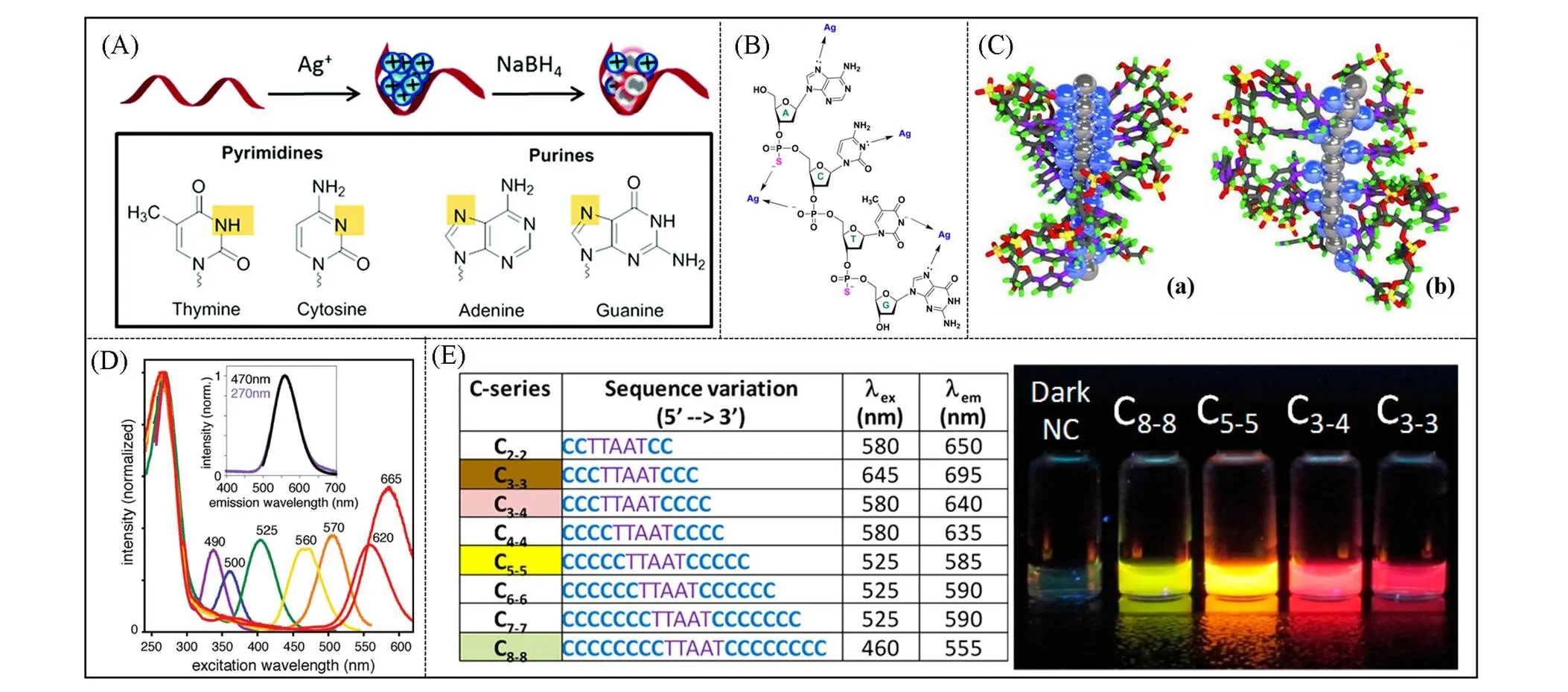
Fig.1 (A) The synthesis process of DNA⁃AgNCs and the binding site of base and Ag+[10]. Copyright 2016, the Royal Society of Chemistry. (B) Schematic illustrating the potential sites of interaction between single stranded DNA and silver ions[12]. Copyright 2013 MDPI. (C) A proposed rod⁃like model of AgNCs, with the neutral core(grey) peripherally surrounded by base⁃bound Ag+(blue)[13]. Copyright 2013, Wiley⁃VCH Verlag GmbH & Co. KGaA, Weinheim. (D) Varying the length of the C base leads to AgNCs varying in color[14]. Copyright 2011, American Chemical Society.(E) Varying the length of the C base leads to AgNCs varying in color[15]. Copyright 2014, American Chemical Society
常用的DNA-AgNCs表征方法如表1所示. 通过改变DNA序列、 长度及二级结构可对其荧光发射进行调控, 还可以通过突变、 杂交、 碱基错配和构象变化改变纳米簇微环境, 以及改变环境因子(如缓冲液、 pH值、 金属离子、 大分子聚合物和小分子等), 从而调节其光学性质, 使得DNA-AgNCs的荧光发射可以覆盖紫外光到近红外(NIR)区域.
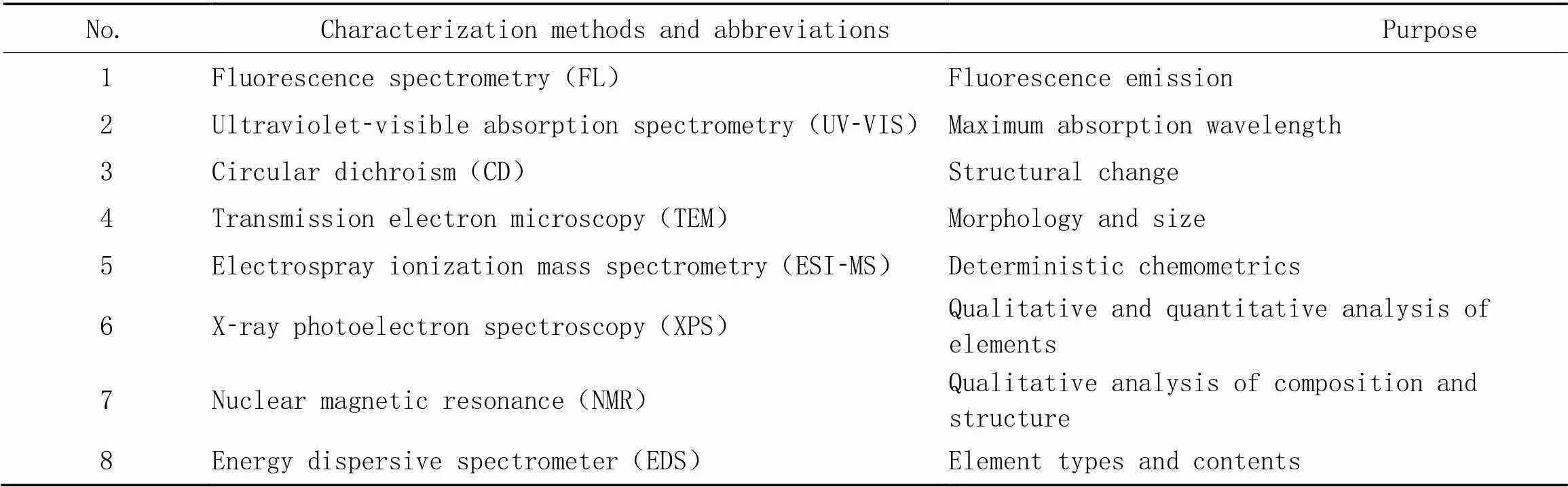
Table 1 Common characterization methods for DNA-AgNCs
2 影响DNA银纳米簇荧光的因素
DNA-AgNCs的荧光受DNA模板、 缓冲液、 pH值、 温度及孵育时间等多种因素影响, 其中DNA模板对DNA-AgNCs的荧光影响较大. 这是因为DNA-AgNCs的形成主要依靠Ag+与DNA中C碱基的较高亲合能力, 并且DNA序列具有丰富的碱基组成以及千变万化的二级结构, 从而使DNA-AgNCs能调控不同的发射波长. 下文将从碱基组成、 长度和二级结构3个方面介绍DNA模板对DNA-AgNCs荧光的影响.
2.1 碱基组成的影响
通过改变DNA模板可调控合成不同荧光发射性质的AgNCs, 且AgNCs的荧光强度和量子产率也随之改变. 2008年, Dickson等[16]证明单链寡核苷酸可稳定高荧光的AgNCs, 通过DNA序列可调节其发射颜色, 并具有高度光稳定性和出色的缓冲稳定性. 通过调整dC12中的碱基序列, 制备了5种不同的纳米团簇, 其DNA模板序列分别为 5'-CCCTTTAACCCC-3'(蓝色), 5'-CCCTCTTAACCC-3'(绿色), 5'-CCCTTAATCCCC-3'(黄色), 5'-CCTCCTTCCTCC-3'(红色)和5'-CCCTAACTCCCC-3'(近红外), 具有从蓝色到近红外的可调发射以及出色的光物理特性. 系统和单分子荧光研究表明, 与常用的花菁染料相比, 寡核苷酸包被的Ag纳米团簇显示出更高的光稳定性和发射率. 2008年, Petty等[17]以dT12为模板合成的AgNCs主要发射绿色荧光, 荧光强度受pH值影响, 随着pH从8变为11, 荧光强度增加了100倍以上, 并证明去质子化的氨基是绿色发射簇的结合位点, 以dT4C4T4为模板合成的AgNCs主要发射蓝色或绿色荧光, 随着pH值从8变为11, 荧光强度增加了200倍以上, 而以dC4T4C4为模板合成的AgNCs, 寡核苷酸浓度影响团簇的荧光光谱, 在15 μmol/L寡核苷酸的较高浓度下, 以红色荧光发射占主导, 在0.5 μmol/L寡核苷酸的较低浓度下, 则与前两种纳米簇同样发射蓝色或绿色荧光. 因此, 研究者认为以富T的寡核苷酸为模板时会形成发射蓝色或绿色荧光的AgNCs, 但以富C的寡核苷酸为模板时还可形成发射红色荧光的AgNCs. 此外, 碱基络合和固有的团簇稳定性都与由DNA形成的银簇类型有关.
2.2 长度的影响
合成AgNCs的DNA模板通常为12个碱基或者更多. 2010年, Koszinowski和Ballweg[18]报道只有 6个碱基的DNA模板不能合成具有荧光性能的AgNCs. 然而, 2013年, 汪尔康等[19]首次合成了由DNA单体(dC, dA, dT和dG)保护的银纳米团簇, 还预测了它们的光致发光特性. TEM和EDS表征结果表明, 除dA外, dT, dC和dG也可用作合成银纳米簇的模板. 基质辅助激光解吸电离串联飞行时间质谱(MALDI-TOF/TOF-MS)分析结果表明, dT和dA保护的银纳米簇具有相似的谱图, 都结合奇数个银原子, 均包含Ag9信号, 且Ag9信号最强, 而dC仅观察到Ag9信号, dG则只观察到Ag7信号. 但只有dC保护的银纳米簇显示出强荧光发射, 为使用富含胞嘧啶的DNA链合成荧光银纳米簇的优点提供了证据. 这说明DNA链是银纳米簇较好的合成模板, 但DNA单体与Ag原子间的键不牢固、 易断裂, 可能是DNA-AgNCs不够稳定的原因. 2021年, 本课题组[20]用C6G5C6与富T序列相连(P1-C6G5C6)作为银纳米簇合成模板, 荧光强度相对于C6G5C6增强7倍, 相对于P1-C12增强1.3倍, 说明除银纳米簇模板序列, 与模板所连接的DNA长度及碱基均会造成DNA-AgNCs荧光强度的不同.
2.3 二级结构的影响
2.3.1发夹结构2009年, O’Neill等[21]利用环上有3~12个C碱基的发夹状DNA合成荧光DNA-AgNCs, 根据波长与化学稳定性分为4种不同类型, 依靠环上C的数量进行调节. 2011年, Tzeng等[22]发现以5'-CGCGC12CGCG-3'茎环结构的DNA为模板合成的AgNCs比以寡胞嘧啶dC12直链DNA为模板形成的AgNCs荧光强度明显升高. 而对于具有茎臂碱基错配的DNA序列则无法在高浓度下产生AgNCs, 表明发夹结构有利于AgNCs的形成. 同时, 调整发夹结构会产生从黄色到红色不同荧光发射的DNA-AgNCs. 2016年, 唐点平等[23]利用环部为dC6的发夹序列合成了具有强荧光的DNA-AgNCs, 而当发夹结构被破坏时, 形成的不规则结构显著削弱了Ag与C残基之间的反应, 进一步扰乱了AgNCs周围的微环境, 从而减弱了荧光强度.
2.3.2双链结构相比单链DNA(ssDNA), 双链DNA(dsDNA)具有更加刚性的结构和更加明确的构象. 然而, 完全互补的dsDNA没有多余的位点用于合成AgNCs, 故dsDNA不能用于形成有效的荧光AgNCs. 因此形成dsDNA-AgNCs的前提条件是dsDNA缺陷(图2), 如含错配碱基、 脱碱基位点(AP)、 间隙碱基位点(Gap)或者凸起碱基位点(Bulge). 2011年, 任劲松等[24]利用碱基错配的dsDNA模板在特定位置合成荧光AgNCs, 荧光强度大小顺序为T-C>T-G>T-T. 分子级别的AgNCs位于dsDNA错配碱基位点, 而DNA模板依然保持完整结构. 基于碱基错配的dsDNA模板形成的AgNCs的荧光量子产率为8.1%(相对于乙醇中的罗丹明B), 高于ssDNA模板形成的AgNCs的量子产率(5.3%), 表明碱基错配的dsDNA比ssDNA形成的AgNCs效果更佳[图2(A)]. 因此, 以dsDNA-AgNCs作为功能性生物探针可鉴定单核苷酸多态性(Single nucleotide polymorphism, SNP). 2011年, 邵勇等[25]发现dsDNA中的AP 位点可以生成AgNCs, 并且对于对面是胞嘧啶且侧面是鸟嘌呤的AP位点(GXG-C)具有高度选择性 [图2(B)]. 基于AP位点微环境依赖的AgNCs, 建立了检测SNP的“Signal on”型荧光传感系统, 并成功应用于SNP检测. 2012年, 邵勇等[26]发现当DNA双链体中C碱基对面为缺口位点(Gap-C)时, 可作为快速合成AgNCs的模板, 且具有明亮的荧光发射和化学稳定性[图2(C)]. Gap-C会高度选择性地形成荧光AgNCs, 用于SNP的实际检测. 以GAP-C为模板形成的DNA-AgNCs, 经560 nm光激发可在643 nm处出现强荧光峰, 其荧光量子产率约为47.2%, 而完全匹配的dsDNA只存在非常弱的荧光.
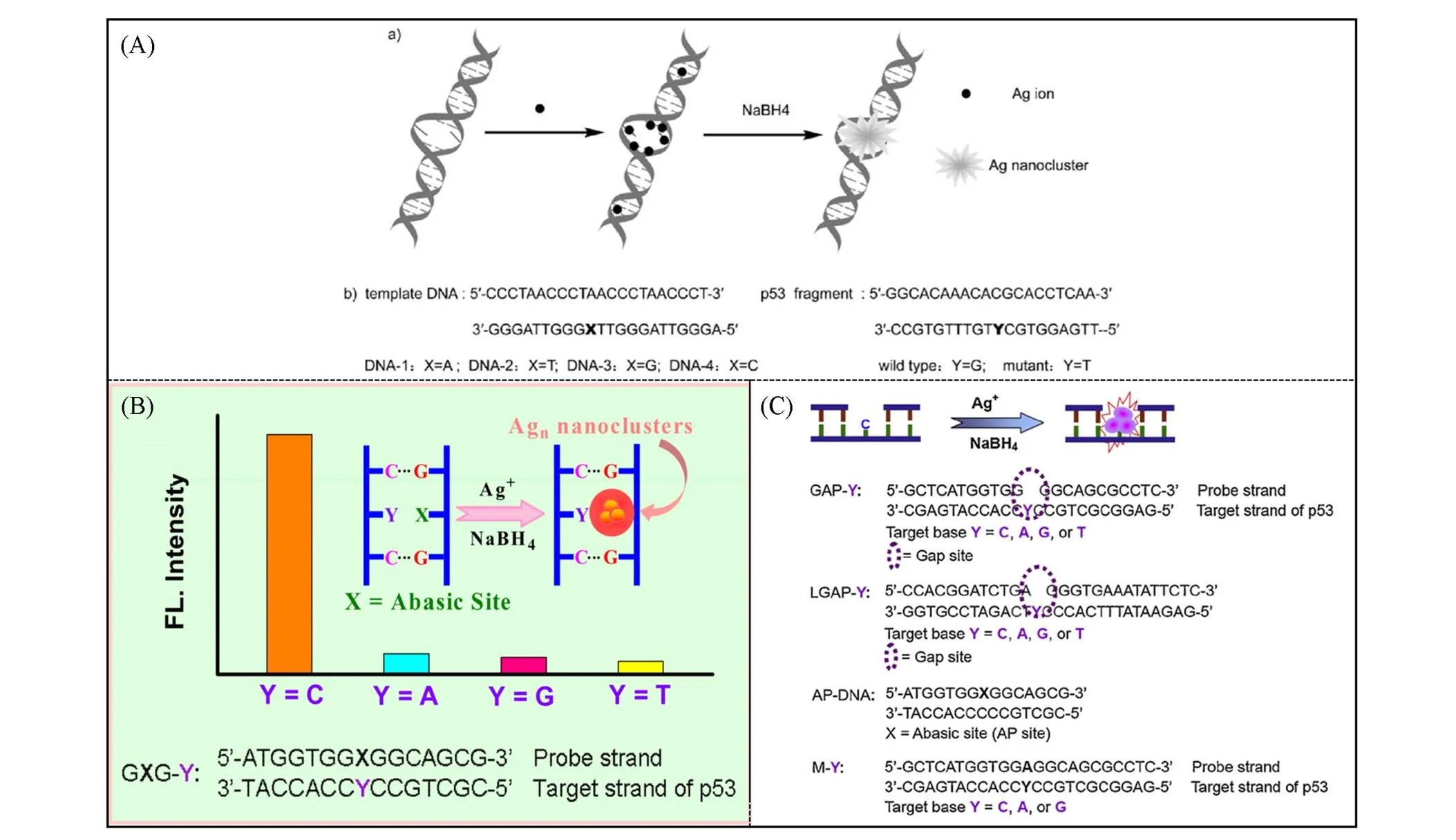
Fig.2 Schematic diagram of the formation of fluorescent silver nanoclusters on a double⁃stranded structure
(A) Mismatched pairs[24]. Copyright 2011, Wiley⁃VCH Verlag GmbH & Co. KGaA, Weinheim. (B) Debase site[25]. Copyright 2011, IOP Publishing Ltd. (C) Interstitial site[26]. Copyright 2012, Elseiver B.V.
2.3.3三螺旋结构由于Ag+可以特异性取代三链体DNA的CG.C+碱基中胞嘧啶的N3质子形成新的三链体(CG.CAg+), 即使是在中性pH值下, 也能稳定平行基序三链体[27]. Ag+与CG.C+三重态的特定相互作用确保了Ag+仅能作用于CG.C+三重态的Hoogsteen氢键. 2012年, 任劲松等[28]以三螺旋DNA为模板获得了均一的AgNCs[图3(A)]. 所制备的AgNCs被证明在CG.C+位点, 并且对Cl-具有异常的稳定性. 首次以未修饰的DNA作为模板制备可定位、 均一和超稳定的AgNCs. 此外, 通过这种三螺旋DNA实现了在DNA纳米模板上精确控制荧光AgNCs的排列.
2.3.4i-motif结构i-motif是由富含胞嘧啶的寡核苷酸片段在酸性环境下形成的四链体结构. 由于胞嘧啶在酸性环境下(特别是pH≤5.8时)可以被质子化, 质子化的胞嘧啶可与未质子化的胞嘧啶通过氢键形成Hoogsteen碱基配对. 两条富含胞嘧啶的寡核苷酸片段部分质子化后, 通过C⁃C配对形成稳定的平行双螺旋, 2个平行双螺旋上的碱基对以交替排列和互相嵌入的形式形成四螺旋结构, 它是目前已知的唯一具有有序插层作用的核酸结构. 2009年, Petty等[29]以2个形成i-motif的寡核苷酸d(TA2C4)4和d(C4A2)3C4为模板合成了AgNCs, 分别发射红色和绿色荧光[图3(B)], 且分别在弱酸性和碱性溶液中荧光性能较强. 最大的红色荧光发射强度在pH值为6时, 此时寡核苷酸的i-motif结构也最稳定, 在pH值为8~9时, 绿色荧光发射强度最大.

Fig.3 Schematic diagram of the formation of fluorescent silver nanoclusters on different structures
(A) Triple helix[28]. Copyright 2012, Oxford University Press. (B) i⁃Motif[29]. Copyright 2009, American Chemical Society. (C) G⁃quadruplex[31]. Copyright 2011, Elsevier B.V. (D) Benzene ring[32]. Copyright 2013, The Royal Society of Chemistry.
2.3.5G-四链体结构G-四链体(G-quadruplex)是由富含鸟嘌呤碱基G的寡核苷酸片段在单价阳离子存在下, 通过鸟嘌呤之间的Hoogsteen氢键形成鸟嘌呤-四聚平面, 然后通过-堆积聚集而成的稳定、 高度有序的四链DNA螺旋结构. 2012年, 汪尔康等[30]以G-四链体结构的AS1411序列(结合癌细胞中过表达的核仁素的G四链体)为模板, 合成了在420 nm(ex=325 nm)和680 nm(ex=510 nm)处具有双发射荧光信号的DNA-AgNCs, 结合荧光、 CD、 MALDI-TOF-MS和TEM等表征证明了AS1411形成AgNCs后, 仍保持其结构以及与癌细胞中核仁素结合的特性, 同时这一结合特性显著增强AgNCs的荧光强度, 并验证了结合不同G-四链体的荧光增强通用性. 由于许多功能性核酸(如人类端粒和某些核酸适配体)都具有富G序列, 在功能条件下可折叠成G-四链体, 该方法在未来的研究中具有广阔的应用空间. 此外, 细胞毒性测定结果表明, AgNCs对细胞的毒性作用很小, 进一步证明了该方法在肿瘤细胞成像中的适用性, 并已成功用于HeLa细胞的荧光成像. 2018年, 李娜等[31]首次利用圆二色光谱和荧光光谱等技术对G-四链体拓扑/序列与其模板化的AgNCs进行研究[图3(C)], 发现具有反平行拓扑结构的G-四链体模板产生的AgNCs荧光强于平行拓扑结构的AgNCs荧光. 临近环基比在环基中对AgNCs的荧光有更显著的影响, 并且腺嘌呤主要表现出荧光增强作用, 胸腺嘧啶则相反. 因此, 包含临近环基的腺嘌呤且具有反平行拓扑结构的G-四链体是制备强荧光银纳米簇的良好模板. 该研究有助于更深入地了解G-四链体模板与AgNCs之间的相关性, 并有助于理解和利用它们的独特属性.
2.3.6其它结构2013年, Zamora等[32]以一个疏水性苯环为核心, 在不同位点共价连接2个或3个 ssDNA, 二聚体的DNA链在邻位和间位, 三聚体则处于交替位置. 由于苯环对荧光强度的影响不大, 因此增强的荧光取决于链的分布[图3(D)]. 在二聚体的情况下, 邻位衍生物显示出比间位衍生物更高的荧光, 说明链之间的紧密相邻能更好地促进AgNCs的形成. 而以三聚体合成的AgNCs比单独一条单链DNA(PolyC12)合成的AgNCs荧光强度高约60倍, 且其荧光在开始的24 h内未像单链样品中那样显著衰减, 并在避光保存20 d后, 其荧光强度仍得以保持, 三聚体获得的高荧光是由于邻近链之间的合作效应, 能够更好地稳定AgNCs并防止其荧光猝灭.
3 DNA银纳米簇介导的功能核酸传感器
DNA-AgNCs作为一种新型的荧光纳米材料, 是荧光分析领域研究的重要对象, 已成为荧光纳米材料的研究热点. 近年来, 针对如何增强或减弱DNA-AgNCs荧光生物传感器的荧光, 已经进行了大量的研究. 本文将分别总结增强和减弱DNA-AgNCs荧光生物传感器荧光的方法, 以求为后续DNA-AgNCs的荧光分析方法的研究提供思路.
3.1 基于DNA银纳米簇的荧光增强
3.1.1G碱基Yeh等[33]设计了一种纳米簇信标(Nano cluster beacon, NCB)[图4(A)], NCB由2个 短的线性DNA探针组成, 一个是由5'-CCCTTAATCCCC-3'形成的AgNCs探针, 另一个是序列为 3'-G4(TG4)2TG3-5'的G-rich探针, 二者互相接近而发出强烈红色荧光, AgNCs的荧光增强约500倍. 利用实时PCR热循环仪进一步证实了红色荧光发射来自DNA双链体, 并证明了荧光增强机制的可逆性. 另外, 探索了其它碱基对荧光的增强作用, 发现对于富A链未观察到红色荧光增强, 富C链似乎诱导了不可逆的簇转移, 而富T链邻近DNA-AgNCs时发射绿色荧光. 基于该原理, Yeh等[34]在2012年以变色纳米簇信标作为荧光探针, 根据AgNCs与DNA增强子序列之间的排列, 调节cNCB的荧光发射颜色, 用于检测SNP, 并可在UV激发下用肉眼轻松识别.
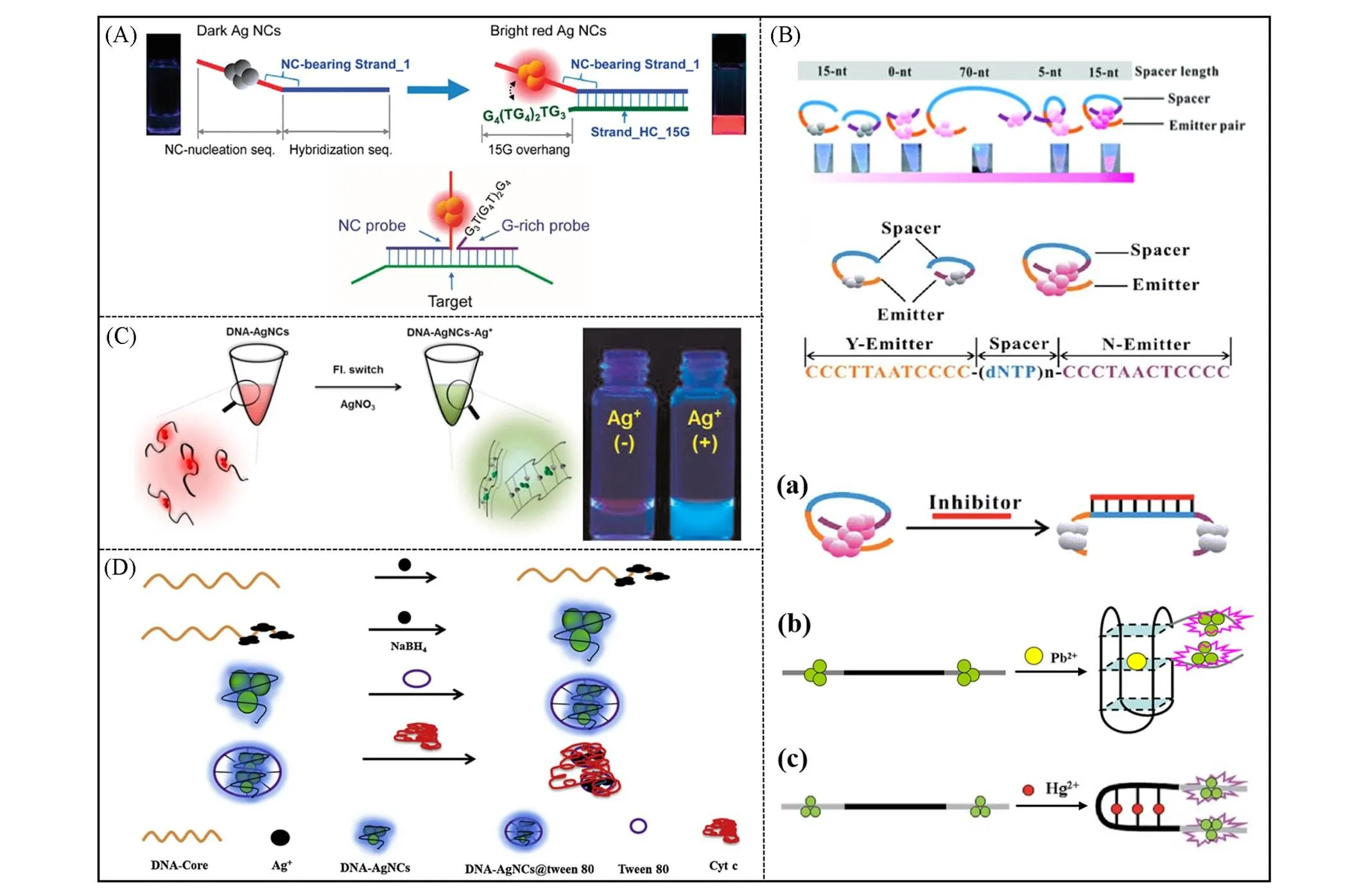
Fig.4 (A) Schematic showing red fluorescence enhancement of DNA⁃AgNCs through proximity with a G⁃rich overhang and NCB probe design[33]. Copyright 2010, American Chemical Society.(B) Schematic diagram of Ag emitter on symbiotic long DNA template model and application[37―39]. Copyright 2015, The Royal Society of Chemistry.(C) Schematic illustration of fluorescence switching for Cyt12⁃AgNCs by adding Ag+[40]. Copyright 2015, Elsevier B.V.(D) Schematic illustration of fabrication of DNA⁃AgNCs and DNA⁃AgNCs coated with Tween 80(DNA⁃AgNCs@tween 80) and their application for Cyt c assay[43]. Copyright 2018, Elsevier B.V.
2012年, Li等[35]基于目标物亲和诱导DNA杂交和富G序列增强AgNCs荧光, 提出了结合诱导荧光“Turn on”检测-凝血酶的方法. 作者设计了2条DNA序列: 一条由5'-CCCTTAATCCCC-3'的AgNCs成核序列、 12 nt的杂交序列、 T5的spacer与Apt15适配体组成; 另一条由Apt29适配体、 T5的spacer、 12 nt的杂交序列与富G序列组成. 当互补序列为30 nt时, 不加入目标物即有强烈的红色荧光信号, 最终优化结果为12 nt互补序列最佳, 能够保证当体系不含目标物时, 所设计的互补序列不形成稳定杂交链, 以此保证背景最低. 作者研究了不同G碱基个数的overhang对AgNCs的荧光增强效果, 以15个G碱基的序列荧光增强效果最佳, 与前2个研究使用富G序列相同, 均为3'-G4(TG4)2TG3-5'. 当靶蛋白存在时, 2种适配体探针均与靶蛋白结合, 引发与各适配体相连的互补序列相互杂交, 从而使富G的overhang与AgNCs紧密相邻, 导致荧光显著增强. 该方法无需洗涤分离, 且在均相体系中完成. 基于该原理的检测方法可以扩展到其它使用2种探针与同一靶分子结合的应用中.
另外, 将G碱基插入到富C的DNA序列中也可以增强DNA-AgNCs的荧光强度. 2019年, 钱和等[36]以C6G5C6序列合成量子产率为28%的DNA-AgNCs. 以此DNA-AgNCs为探针, 用于降压保健食品中卡托普利的灵敏检测, 具有良好的线性响应, 并适用于复杂基质的实际样品检测.
3.1.2AgNCs毗邻等离子体共振和配体-金属-金属间的电荷转移(Ligand-to-metal-metal charge transfer, LMMCT)能够导致银簇临近而增强荧光, 为发光银纳米材料的实验和理论研究提供了新的视角. 2015年, 尹斌成等[37]发现通过弱荧光AgNCs相互靠近能够增强荧光发射强度[图4(B)]. 通过调控间隔序列长度, 改变DNA模板的二级结构, 能够有效控制AgNCs的荧光强度. 与单独带有T15的单一成核序列形成的AgNCs相比, 以间隔T15的DNA模板形成的S-T15/AgNCs荧光增强850倍. 而S-A(约450倍), S-C(约250倍)和S-G(约300倍)均未观察到间隔子长度依赖性的荧光现象. S-T15/AgNCs的量子产率为16.3%, 并能在15分钟内快速合成. 基于该原理, 结合靶标特异性导致核酸适配体发生结构转换, 使得适配体两端较暗的DNA-AgNCs靠近, 进而增强了银纳米簇的荧光. 荧光增强的强度与靶标浓度呈正相关, 可用于“Turn on”荧光生物传感器的构建, 比如基于T-Hg2+-T诱导ssDNA构象转变为发夹的Hg2+传感器[38]和基于铅离子诱导ssDNA构象转变为G四链体的Pb2+传感器[39].
3.1.3金属离子2015年, Kim等[40]建立了以Ag+触发DNA-AgNCs的荧光开关检测Ag+的方法. Ag+通过在2个Cyt12-AgNCs之间形成桥来诱导形成Cyt12-AgNCs的二聚体结构, 使得荧光从弱红色变为强绿色[图4(C)]. 由Ag+触发荧光开关, 具有很高的选择性和灵敏度(10 nmol/L), 且响应时间短, 即使在其它金属离子存在的情况下仍可成功检测. 2016年, 张静等[41]发现Zn2+可增强AgNCs荧光, 基于此建立了同时检测赭曲毒素A(OTA)和黄曲霉毒素B1(AFB1)的荧光方法. 将OTA适体和AFB1适体共同固定在磁珠表面, 并分别与信号探针1(Sp1)和信号探针2(Sp2)杂交. 当2种霉菌毒素存在时, 适体与靶标结合释放Sp1和Sp2, 磁性分离后, 上清液中的Sp1和Sp2作为相应的模板, 合成具有不同荧光发射峰的AgNCs. 同时, 在合成AgNCs的过程中, 加入Zn2+后荧光强度显著增强, 2个荧光峰不重叠, 因此可以实现高灵敏同时检测.
3.1.4大分子拥挤环境2017年, Li等[42]在高密度葡聚糖诱导的拥挤环境中制备了AgNCs, 比水溶液中制备的AgNCs具有更小的粒径和更高的荧光量子产率. 2019年, 王伟等[43]合成了一种荧光增强的吐温80与DNA-AgNCs结合体(DNA-AgNCs@tween 80)[图4(D)], 可用于检测细胞色素c(Cytochrome c, Cyt c)和其它生物硫醇. DNA-AgNCs能在终浓度0.1% tween 80的“疏水口袋”中紧密堆积, 实现了由聚集诱导的DNA-AgNCs的发射荧光增强, 通过电子转移提高了Cyt c对AgNCs的猝灭效应, 从而提高检测灵敏度. 该方法的荧光强度与Cyt c浓度在0.8~20000 nmol/L范围内呈良好的线性关系, 检测限为0.8 nmol/L. 最后, 监测Dox, J5和S6处理后的HCT-116和BGC-823肿瘤细胞培养基中Cyt c的变化, 结果表明Cyt c的水平随着Dox, J5和S6的存在而降低. 这种具有高灵敏度、 简单性和良好生物相容性的突破性纳米探针为探索细胞凋亡调控的分子机制和筛选天然药物提供了广阔的前景. 2019年, Eun等[44]利用三聚氰胺(Mel)和DNA序列5'-CCCTTAATCCCC-3'中具有强大氢键的T碱基之间发生的特异性相互作用, 合成了Mel-DNA-AgNCs复合物, DNA模板环境的变化会导致其它Ag+的结合, 从而增强荧光效率和稳定性. 在(DNA)∶(Ag+)∶(NaBH4)=1∶6∶3, pH=7.0, 25 ℃条件下制得的Mel-DNA-AgNCs效果最佳, 荧光效率增强3倍, 稳定性长达70 d. 此外, Mel-DNA-AgNCs对革兰氏阳性和革兰氏阴性细菌表现出的抗菌活性要优于单独的DNA-AgNCs.
3.2 基于DNA银纳米簇的荧光减弱
3.2.1巯基在半胱氨酸(Cys)或其它生物硫醇的存在下, DNA-AgNCs中银原子空的轨道能接受硫原子的电子产生S—Ag键, 并发生DNA-AgNCs供体到硫醇基团受体的电子转移, 同时伴随DNA-AgNCs粒径变大, AgNCs聚集形成非荧光的纳米颗粒, 使得DNA-AgNCs的荧光被强烈猝灭. 2011年, 汪尔康等[45]发现DNA-AgNCs的荧光强度会随着生物硫醇浓度的增加而有效猝灭, 生物硫醇中的巯基(—SH)能够与AgNCs中的Ag+形成S—Ag键, 导致发射波长红移, 而与浓度高出10倍的其它氨基酸反应时, DNA-AgNCs的荧光没有发生改变. 利用该原理可对半胱氨酸(Cys)、 高半胱氨酸(Hcy)和谷胱甘肽(GSH) 3种生物硫醇进行检测, 并用于人血浆样品的检测. 由于硫普罗宁(Tiopronin)是一种含巯基的甘氨酸衍生物, 因此也能够与DNA-AgNCs中Ag+形成稳定的Ag—S键, 使得AgNCs的荧光被猝灭[46]. 此外, 在乙酰胆碱酯酶(AChE)存在下, 乙酰硫代胆碱(ATCh)氯化物经过催化水解生成硫代胆碱(TCh), 由于含有硫醇基团, 与生物硫醇相似, 因此也可以根据该原理检测AChE活性[图5(A)][47].
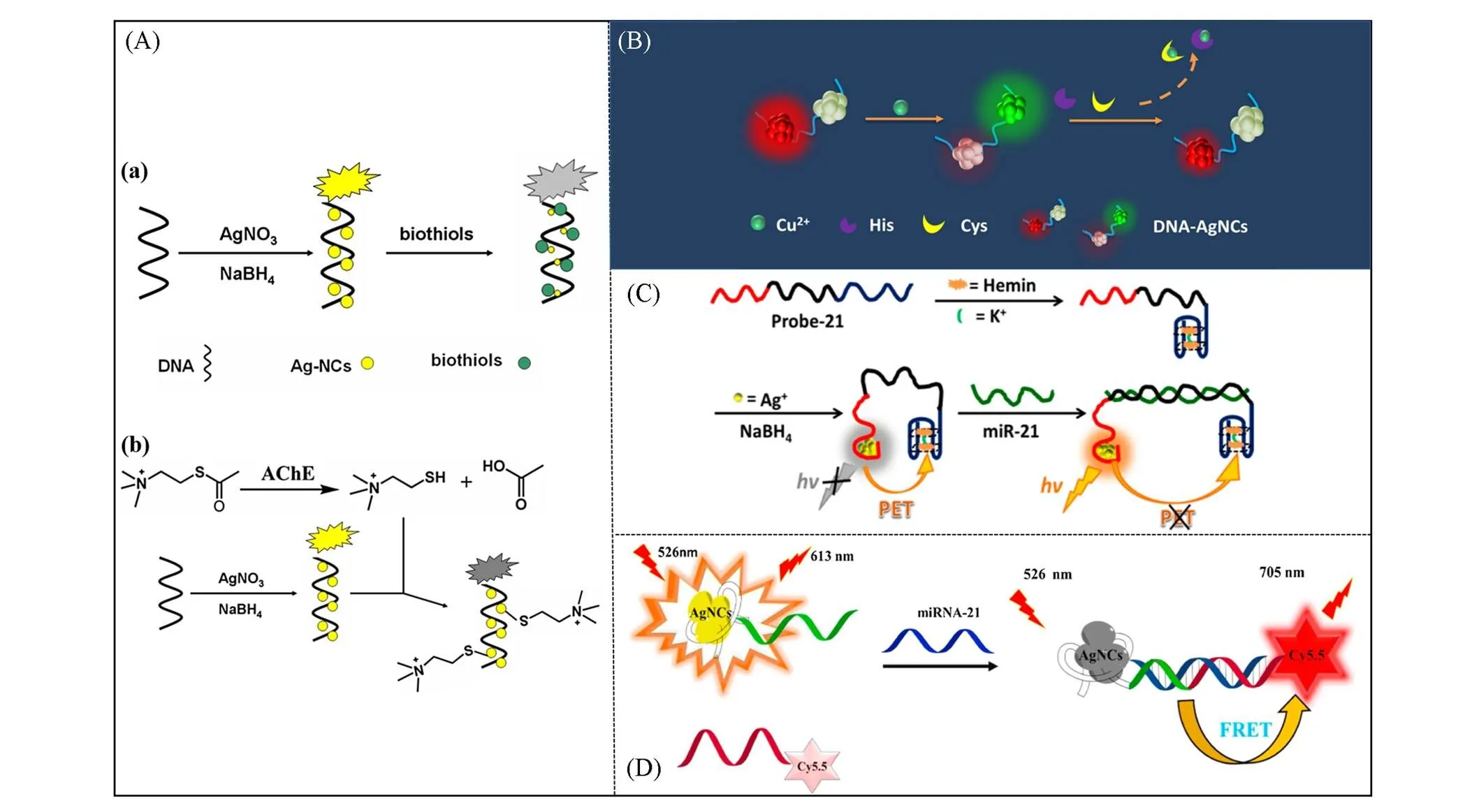
Fig.5 (A) Schematic illustration of the assay strategy for the detection of biothiols(a) and acetylcholinesterase activity(b) based on DNA⁃AgNCs[47]. Copyright 2016, Elsevier B.V.(B) Schematic diagram of principle for individual detection of His and Cys[56]. Copyright 2019, Springer⁃Verlag GmbH Austria, part of Springer Nature.(C) Schematic illustration of the analysis of miR⁃21 based on the distance⁃dependent PET between DNA⁃AgNCs and G⁃quadruplex/hemin[61]. Copyright 2017, American Chemical Society.(D) Schematic illustration of DNA⁃AgNCs nano⁃bioprobe based on FRET for the determination of miRNA⁃21[62]. Copyright 2020, Elsevier B.V.
值得注意的是, 2011年, 任劲松等[48]发现在硫醇化合物存在的情况下, 某些DNA-AgNCs(如 dC12-AgNCs)的荧光可以增强, 这可能是由于Ag—S形成了新的电荷转移通道或者巯基化合物引起微环境的改变所致. 通过使用不同的DNA模板, 可以观察到针对硫醇化合物的不同荧光响应模式, 说明AgNCs的性质具有模板依赖性. 所制备的dC12-AgNCs的发射带集中在615 nm处, 其量子产率为18.6%. dC12-AgNCs用于检测硫醇化合物的最佳温度为25 ℃, 在pH=4~9范围内效果良好, 在pH=7时获得最大荧光发射信号, 表明dC12-AgNCs可用于在生理pH值下检测硫醇化合物. Cys/Hcy/GSH均能够导致dC12-AgNCs的荧光显著增强, 增强规律遵循Hcy>GSH>Cys的顺序, 这似乎与硫醇化合物的电荷提供能力的顺序一致.
3.2.2金属离子某些金属离子能够诱导DNA-AgNCs的猝灭, 如Ag+, Au3+, Cu2+和Hg2+等, 其机理暂不明确, 目前研究者对此有以下推测: Xie等[49]认为10-10亲金属相互作用是金属离子与纳米簇结合的主要原因, 如Hg2+与Ag+或Au3+, 但Zn2+和Cd2+也具有10却不能诱导荧光猝灭, Morishita等[50]认为具有高氧化还原电位的金属离子(例如Ag+, Au3+, Cu2+和Hg2+)能够将低价金属氧化, 驱动金属离子与AgNCs相互作用, 从而猝灭荧光, NaBH4无法对这种金属诱导的猝灭恢复, 而低氧化还原电位离子则不能猝灭荧光, 也有研究者认为金属离子结合到金属纳米簇表面, 改变了电荷转移状态, 引起金属纳米簇荧光猝灭[51].
Cu2+是一种高效荧光猝灭剂, 因为它通过电子或能量转移具有顺磁性. 2011年, Zhang和Ye[52]根据Cu2+离子猝灭DNA-AgNCs的荧光, 设计了检测Cu2+的“Turn off”荧光传感器. 该方法具有出色的选择性和灵敏度, 检测限为10 nmol/L. 当Cu2+存在时, 可以在10 min内观察到DNA-AgNCs的荧光猝灭, 从而进行快速分析检测. 利用金属离子螯合剂乙二胺四乙酸盐(EDTA)与DNA-AgNCs竞争Cu2+, 证实了猝灭反应的主要原因是金属与金属的相互作用. 根据Cu2+猝灭DNA-AgNCs的荧光原理, 可以设计与Cu2+相互作用物质的“Turn on”型荧光检测体系, 如组氨酸(His)、 焦磷酸酯(PPi)和喹诺酮类药物等. 2014年, Zhou等[53]利用Cu2+与组氨酸(His)的咪唑残基相互作用, 使Cu2+从DNA-AgNCs/Cu2+组装体中解离释放, 导致DNA-AgNCs荧光恢复, 实现对His的检测. 2016年, Ma等[54]基于Cu2+对550 nm光激发的DNA-AgNCs的猝灭能力、 Cu2+和焦磷酸酯(PPi)的强结合能力以及碱性磷酸酶(ALP)将PPi转化为正磷酸盐(Pi)的能力, 建立了检测PPi或ALP的荧光检测体系. 2018年, 王仁君等[55]利用Cu2+与喹诺酮类药物相互作用, 设计了一种基于Cu2+调节DNA-AgNCs荧光的痕量喹诺酮检测体系. 用Cu2+离子猝灭DNA-AgNCs的荧光, 加入喹诺酮类药物导致荧光强度恢复. 该检测方法对4种代表性喹诺酮类药物均表现出良好的灵敏度. 2019年, Liu等[56]构建了由ssDNA模板5'-CCCTTAATCCCCTTTTTTTTTTTTTTT-CCCTAACTCCCC-3'合成的DNA-AgNCs作为双荧光发射的DNA-AgNCs团簇组成的比率型荧光纳米探针, 用于Cys和His的高灵敏度和高选择性检测[图5(B)]. 在470 nm光激发下DNA-AgNCs在560 nm处出现弱绿色荧光峰, 而在550 nm光激发时会在595 nm处发出强烈的红色荧光. 当Cu2+存在时, 能够增强绿色荧光, 猝灭红色荧光. 基于Cys/His, Cu2+和DNA-AgNCs的相互竞争作用设计了检测Cys/His的比率型荧光纳米探针. 通过添加Ni2+作为掩蔽剂可以将Cys区别于His, 添加-乙基马来酰亚胺(NEM)则可以将His区别于Cys.
Hg2+也能够猝灭DNA-AgNCs的荧光, 但是在低浓度的范围内依然能够实现“Turn on”型定量检测. 2011年, Lan等[57]以5′-CCC(TTCC)2TT(CCAA)2CCC-3′合成的DNA-AgNCs(量子产率为61%)为荧光探针, 基于Hg2+对银簇的猝灭效应检测Hg2+, 线性范围为2.5~50 nmol/L, 检出限为0.9 nmol/L. 2015年, Peng等[58]以5'-CCCACCCACCCGCCCA序列合成的AgNCs靠近G-rich序列(5'-AGGGAGGGAGGGA-GGG)时, 荧光信号增强200倍. 在两端设计杂交互补序列, 与杂交前单链DNA-AgNCs相比, 杂交双链DNA-AgNCs的荧光更强更稳定. 在汞或铜离子存在时, AgNCs荧光被猝灭, 以此检测汞或铜离子. 利用EDTA作掩蔽剂, 可选择性地检测含有Cu2+等金属离子溶液中的Hg2+. 利用Hg2+与其它物质相互作用恢复AgNCs的荧光原理设计检测方案. 2017年, Xie等[59]利用Hg2+猝灭DNA-AgNCs的荧光及Hg2+和三聚氰胺间的强配位能力, 当Hg2+和三聚氰胺在1000 r/min下反应15 min时, DNA-AgNCs的荧光得以恢复. 基于此方法检测三聚氰胺的线性范围为0.2~4 μmol/L, 检出限为0.1 μmol/L, 比美国食品药品监督管理局对三聚氰胺的安全限值低200倍, 可用于奶粉和原料奶中三聚氰胺的检测.
3.2.3G-四链体/血红素复合物G-四链体/血红素复合物不仅具有类似过氧化物酶的活性, 还能作为电子受体有效地猝灭某些荧光团的荧光. 荧光团与G-四链体/血红素复合物之间发生光诱导电子转移(Photoinduced electron transfer, PET), 此过程与荧光团和G-四链体/氯化血红素之间的距离直接相关, PET的猝灭效率随着二者距离的增加而成比例地下降. 2013年, 汪尔康等[60]首次在DNA-AgNCs和 G-四链体/血红素(hemin)复合物之间观察到PET, 同时伴随着DNA-AgNCs荧光的降低. 该方法中, 平行G-四链体序列和传感序列互补成发夹结构, 目标物与传感序列的特定组合触发G-四链体序列释放, 结合血红素, 形成稳定的G-四链体/hemin复合物. 该复合物对PET有利, 因为它使G-四联体与hemin紧密结合, 促进电子从DNA-AgNCs转移到hemin的Fe3+中心. 该系统可以通过选择不同的靶序列, 对DNA、 ATP等目标生物分子进行特异性、 多方位的检测, 具有较高的灵敏度. 2017年, 杨秀荣等[61]利用DNA-AgNCs和G-四链体/hemin络合物间PET的距离依赖特性, 设计了检测microRNA的荧光生物传感器[图5(C)]. 该荧光探针包含3个部分: DNA-AgNCs的合成模板(5'-CCCCACCCCACCCCA-3')、 miR-21的互补序列(Com)及形成G-四链体/hemin络合物的富G序列. 在目标miR-21存在的情况下, 探针中最初的柔性单链Com变成刚性的Com/RNA异源双链体, 电子供体(DNA-AgNCs)和受体(G-四链体/hemin复合物)之间的距离变长, PET被打断. 因此, 可以通过监测DNA-AgNCs的荧光恢复程度来实现对于miR-21的检测. 对于不同的microRNA分析, 只需调整Com的序列即可实现检测.
3.2.4荧光染料荧光染料是指吸收某一波长的光波后能发射出另一波长大于吸收光光波的物质. 它们大多是含有苯环或杂环并带有共轭双键的化合物. 以DNA-AgNCs与染料光谱重叠为前提, 可利用DNA-AgNCs作为荧光供体, 荧光染料作为受体, 基于二者间的荧光共振能量转移(Förster resonance energy transfer, FRET)设计检测体系. 2020年, Nasirian等[62]以发射红色荧光的DNA-AgNCs作为供体, 标记Cy5.5的近红外发射探针作为受体, 通过miRNA-21将三者连接为双螺旋结构, 使供受体拉近发生FRET[图5(D)]. 杂交使得Cy5.5荧光强度与miRNA-21浓度成线性比例增加, 具有较宽的动态范围(0.02~100.0 nmol/L)和较低的检出限(4.0×10-3nmol/L).
3.2.5纳米材料纳米材料由于其独特的光学性质以及与荧光探针的相互作用, 为荧光生物传感器的优异性能奠定了基础, 被广泛应用于荧光生物传感器的构建, 包括金纳米粒子(AuNPs)、 氧化石墨烯(GO)、 碳纳米管(CNTs)和二硫化钼(MoS2)等.
金纳米粒子能通过表面等离子增强能量转移效应(Surface plasmon-enhanced energy transfer, SPEET)猝灭银纳米簇的荧光[63], 属于偶极-表面相互作用. 尹斌成等[64]基于荧光DNA-AgNCs和AuNPs之间的SPEET过程, 以及ssDNA/dsDNA与AuNPs结合特性的差异, 构建了无标记检测序列特异性DNA的方法[图6(A)]. 由ssDNA模板制备的DNA-AgNCs可以自发吸附到AuNPs表面, AuNPs作为猝灭剂猝灭DNA-AgNCs的荧光. 在目标DNA存在的情况下, 传感探针与目标DNA杂交形成dsDNA, 导致盐诱导的AuNPs聚集, 随后减弱DNA-AgNCs与AuNP之间的SPEET, 使得荧光强度增加伴随AuNPs由红色变为蓝色, 该变化与靶DNA呈浓度依赖关系, 实现了无标记的双信号检测.
氧化石墨烯(Graphene oxide, GO)是从氧化石墨上剥离下来的单一的原子层, 可以在横向尺寸上扩展到数十微米, 具有很大的表面积且被含氧基团高度功能化. GO在核酸适配体传感领域的应用主要是基于其两大特性: 一是GO能够通过-堆积和氢键等相互作用吸附ssDNA, 二是GO作为一种常用的荧光猝灭剂, 具有对荧光的高效猝灭能力. 因此, GO与DNA-AgNCs结合, 能够吸附DNA模板, 并通过长程共振能量转移(Long-range resonance energy transfer, LrRET)有效猝灭AgNCs的荧光. 通过 ssDNA、 dsDNA与GO间的吸附、 解吸, 已开发多种基于GO与DNA-AgNCs的生物传感器. 任劲松等[65]利用特定的目标DNA与银簇探针的识别序列部分形成双螺旋, 将DNA-AgNCs从GO上解吸, 显示出强烈的荧光信号, 用于检测DNA. 该系统具有检测限为1 nmol/L的高灵敏度, 出色的单碱基错配序列的区分能力, 避免了探针DNA或目标DNA的复杂修饰, 具有操作简单和低成本的优势. 此外, 利用不同荧光发射的DNA-AgNCs探针, 实现对同一溶液中多个DNA靶标的同时检测[图6(B)]. 目前, 已经实现了对乙肝病毒基因(HBV)、 免疫缺陷病毒基因(HIV)和梅毒基因的分析检测[66]. 将靶标互补序列替换为ATP或凝血酶的适配体, 则可通过小分子或蛋白质与适配体的结合使DNA-AgNCs从GO上脱附, 实现对待测物的检测[图6(C)]. 利用DNA-AgNCs/GO纳米复合材料, 还能够实现对脱氧核糖核酸酶Ⅰ(DNase Ⅰ)活性的荧光检测[图6(D)][67]. DNA-AgNCs与GO结合时存在低荧光信号. 当DNase Ⅰ存在时, 对DNA/RNA双链中的DNA进行剪切, 释放出与合成银簇的DNA模板上的扩展DNA互补的RNA, 进一步将DNA-AgNCs从GO上解吸, 恢复猝灭的荧光, 呈现较高的荧光信号. 该方法的检出限为0.10 U/mL, 并已成功用于牛尿中DNase Ⅰ活性的检测.
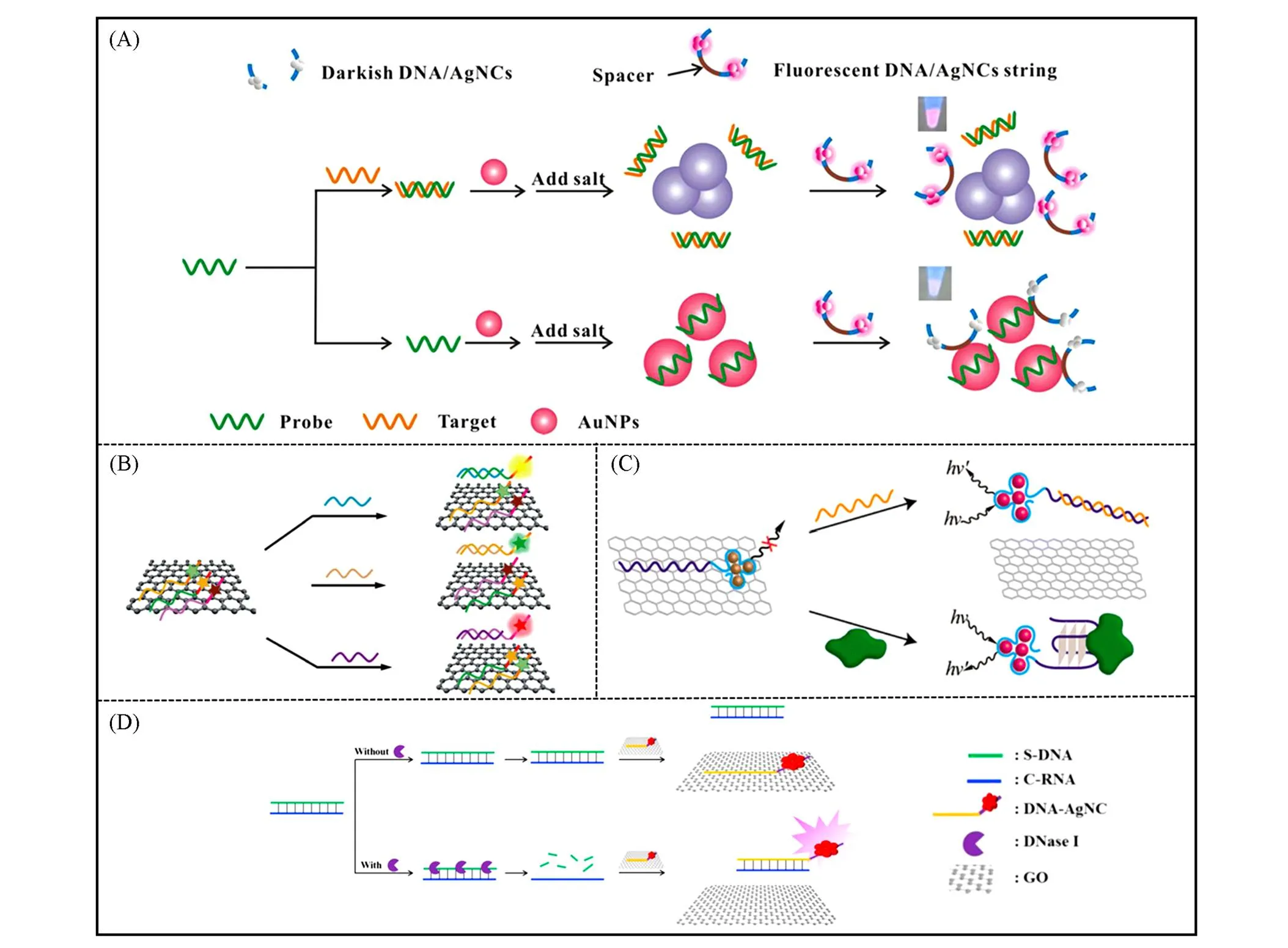
Fig.6 (A) Schematic illustration of the label⁃free method for specific DNA detection based on SPEET between DNA⁃AgNCs and AuNPs [64]. Copyright 2015, American Chemical Society.(B) Scheme for the GO⁃based multicolor DNA analysis [65]. Copyright 2012, The Royal Society of Chemistry.(C) Assay of the target DNAs or ATP/thrombin using DNA⁃AgNCs/GO system [66]. Copyright 2013, American Chemical Society.(D) Schematic illustration of the DNase I activity assay based on DNA⁃AgNCs/GO nanocomposite [67]. Copyright 2016, Elsevier B.V.
多壁碳纳米管(Multi-walled carbon nanotubes, MWCNTs)中每层石墨烯片中的碳原子主要以2杂化方式和相邻的3个碳原子完全键合, 形成六元环网络结构, 具有较大的比表面积和显著的吸附性. 黄承志等[68]以dC12和目标基因互补序列连接作为探针, 基于DNA-AgNCs与MWCNTs的FRET, 设计了检测呼吸道合胞体病毒(RSV)基因序列的方法. MWCNTs可将DNA-AgNCs的荧光猝灭85.8%, 当目标DNA存在时, 互补片段与靶标结合形成双螺旋结构, DNA-AgNCs荧光恢复.
薄层二硫化钼纳米片(MoS2)是一种出色的过渡金属二硫化物, 由于其优异的机械、 电、 光热和光催化性能而备受关注. MoS2和石墨烯的薄度近乎相同, 具有类似于GO的荧光猝灭机制, 能够通过范德华力将DNA吸附在MoS2表面, 是一种有前景的荧光猝灭材料. 更重要的是MoS2的制备非常简单、 省时、 经济. 2018年, 王周平等[69]以dC12、 为减少成核与适配体序列间的空间位阻的T5和T-2毒素的适配体相连组成的Apt-AgNCs作为荧光探针, 基于Apt-AgNCs和MoS2之间的FRET效应, 开发了用于检测 T-2毒素的适配体传感器, 并成功用于玉米和小麦中T-2毒素的检测.
聚吡咯纳米颗粒(PPyNPs)具有-rich结构, 可通过-堆积吸附ssDNA, 还可猝灭近表面材料的荧光, 因此, 可选择PPyNPs作为DNA-AgNCs的荧光猝灭剂. 2020年, 王周平等[70]以C6G5C6作为AgNCs模板, 结合金黄色葡萄球菌肠毒素A(SEA)适配体序列共同作为荧光探针, 其荧光被PPyNPs猝灭. 当存在SEA时, 适配体与SEA结合, 从PPyNPs的表面解吸, 从而导致荧光恢复, 用于检测SEA.
3.2.6其它方法除了上述常见的减弱DNA-AgNCs荧光的方法外, 研究发现还存在其它可使DNA-AgNCs荧光猝灭的机制, 如醌类(Quinones)、 过氧化氢(H2O2)、 一氧化氮(NO)以及超三明治结构等. 2013年, Willner等[71]发现Quinones或H2O2也能够猝灭DNA-AgNCs的荧光. 因此, AgNCs可以用来 检测水解底物后生成Quinones或H2O2的酶, 例如酪氨酸酶、 葡萄糖氧化酶和具有催化级联反应的 双酶(碱性磷酸酶/酪氨酸酶、 乙酰胆碱酯酶/胆碱氧化酶)等. 2014年, Lee和Park等[72]以凝血酶适配体(5'-GTCCGTGGTAGGGCAGGTTGGGGTGAC-3')作为AgNCs合成模板和K+结合探针. 利用K+诱导探针转化为G四链体结构, 使探针的荧光发射强度随着K+浓度的增大而降低, 从而检测K+. 以dC12为模板合成AgNCs, 通过NO诱导胞嘧啶脱氨, 破坏AgNCs结构的稳定性, 实现了对NO的检测. 2014年, 王广凤等[73]以与靶标杂交序列连接dC12为模板形成AgNCs, 结合特定的核酸靶标杂交形成超三明治结构, 导致DNA-AgNCs的荧光强度相对于靶标DNA浓度线性下降.
4 总结与展望
本文介绍了近年来基于以DNA-AgNCs无标记探针作为信号输出, 用于荧光检测靶标的方法与应用. DNA-AgNCs不需要昂贵且繁琐的修饰, 有助于实现简单且低成本的分析检测, 通用的信号输出模式也有利于设计各种检测策略. 此外, 与传统的无标记荧光染料不同, 由于DNA-AgNCs可通过不同的DNA模板合成具有不同颜色荧光的AgNCs, 在响应多个目标时可以实现选择性信号输出, 结合纳米材料降低背景信号实现灵敏的分析检测, 也可以通过G碱基、 银簇毗邻及金属离子等方式增强DNA-AgNCs荧光, 结合酶辅助或无酶扩增策略进一步提高检测方法灵敏度.
虽然DNA-AgNCs的发展已经取得了较好的进展, 但是目前对于DNA-AgNCs的研究仍处于探索阶段, 在深入研究AgNCs发光机制、 反应机制以及可控合成方面还面临着巨大的挑战: (1) 精确原子尺寸、 高荧光量子产率的AgNCs合成仍是一项艰巨的研究任务, 对于DNA-AgNCs而言, 更是无法确认其合成模板序列与功能之间非常明确的规律, 因此还无法按照所需功能设计对应的DNA-AgNCs模板;(2) 对于DNA-AgNCs的发光机制, 以及其结构与发射波长的关系, DNA-AgNCs的荧光增强以及减弱 机制等还不够清楚, 仍需对银纳米簇结构与性能的关系进行研究, 以更深入地了解AgNCs的性质; (3) 与金纳米簇相比, 银纳米簇的稳定性相对较差, 在实际应用过程中, pH值过高或过低、 高温、 高盐和存在强竞争配体等环境下的荧光不够稳定, 还存在光漂白、 易氧化和保质期短等问题. 因此, 仍需要对合成方法、 反应动力学和热力学的控制及配体选择等方面做更深入的研究和探索, 做到单分散、 高效率、 高产率、 高稳定性的纳米团簇的合成; (4) 虽然DNA-AgNCs在生物传感、 生物成像等方面的应用已有报道, 但它对人体的毒性、 环境的污染还不够明确, 仍需深入研究其毒性机制, 为DNA-AgNCs在未来环境监测、 疾病诊断、 生物成像等领域中的实际应用奠定基础.
对于DNA-AgNCs的未来改进和新应用可以进行如下尝试: (1) 有必要进一步研究银纳米簇的精确形成过程和发光机制等基础理论, 探索AgNCs结构与性质的关系, 为更好地构建DNA-AgNCs荧光生物传感器提供理论指导; (2) 通过引入空间DNA模板, 引入化学修饰以及加入抗氧化剂等方法, 提高DNA-AgNCs的稳定性; (3) 充分利用银纳米簇发射波长可调的优点, 设计出多色辐射的DNA-AgNCs用于靶标的多路检测是有发展潜力的; (4) 结合新型纳米材料、 复合纳米材料等物质, 赋予DNA-AgNCs更优良的性质, 开发富有创新性的传感策略; (5) 在已有研究成果的基础上, 建立通用有效的DNA-AgNCs功能核酸荧光生物传感器的设计策略. 总之, DNA-AgNCs作为一种具有优良性能的新型功能性材料, 在其研究道路上机遇与挑战并存. 相信随着研究者们对DNA-AgNCs更加深入的研究, 将会应用于生物分析、 细胞成像、 环境监测以及电子器件等诸多领域, 其未来发展前景非常值得期待.
[1] Yuan X., Luo Z. T., Yu Y., Yao Q. F., Xie J. P.,, 2013,(5), 858―871
[2] Fang J., Zhang B., Yao Q. F., Yang Y., Xie J. P., Yan N.,, 2016,, 1―29
[3] Evanoff D. D., Chumanov G.,, 2005,(7), 1221―1231
[4] Zheng J., Nicovich P. R., Dickson R. M.,, 2007,, 409―431
[5] Zhang L. B., Wang E. K.,, 2014,(1), 132―157
[6] Xu H. X., Suslick K. S.,, 2010,(10), 1078―1082
[7] Diez I., Ras R. H. A.,, 2011,(5), 1963―1970
[8] Xu M. D., Gao Z. Q., Wei Q. H., Chen G. N., Tang D. P.,, 2016,, 411―415
[9] Petty J. T., Zheng J., Hud N. V., Dickson R. M.,, 2004,(16), 5207―5212
[10] New S. Y., Lee S. T., Su X. D.,, 2016,(41), 17729―17746
[11] Ritchie C. M., Johnsen K. R., Kiser J. R., Antoku Y., Dickson R. M., Petty J. T.,, 2007,(1), 175―181
[12] Weadick D. S., Liu J. W.,, 2015,(2), 804―813
[13] Schultz D., Gardner K., Oemrawsingh S. S. R., Markesevic N., Olsson K., Debord M., Bouwmeester D., Gwinn E.,, 2013,(20), 2797―2803
[14] O'Neill P. R., Gwinn E. G., Fygenson D. K.,, 2011,(49), 24061―24066
[15] Obliosca J. M., Babin M. C., Liu C., Liu Y. H., Chen Y. A., Batson R. A., Ganguly M., Petty J. T., Yeh H. C.,, 2014,(10), 10150―10160
[16] Richards C. I., Choi S., Hsiang J. C., Antoku Y., Vosch T., Bongiorno A., Tzeng Y. L., Dickson R. M.,, 2008,(15), 5038―5039
[17] Sengupta B., Ritchie C. M., Buckman J. G., Johnsen K. R., Goodwin P. M., Petty J. T.,, 2008,(48), 18776―18782
[18] Koszinowski K., Ballweg K.,, 2010,(11), 3285―3290
[19] Yang X., Gan L. F., Han L., Wang E. K., Wang J.,, 2013,(7), 2022―2026
[20] Wang J. Y., Du C. Y., Yu P. T., Zhang Q., Li H. X., Sun C. Y.,⁃, 2021, 348, e130707
[21] O’Neill P. R., Velazquez L. R., Dunn D. G., Gwinn E. G., Fygenson D. K.,, 2009,(11), 4229―4233
[22] Choi S. M., Yu J. H., Patel S. A., Tzeng Y. L., Dickson R. M.,, 2011,(1) 109―115
[23] Zhou Q., Lin Y.X., Xu M. D., Gao Z. Q., Yang H. H., Tang D. P.,, 2016,(17), 8886―8892
[24] Huang Z. Z., Pu F., Hu D., Wang C. Y., Ren J. S., Qu X. G.,, 2011,(13), 3774―3780
[25] Ma K., Cui Q. H., Liu G. Y., Wu F., Xu S. J., Shan Y.,, 2011,(30), e305502
[26] Cui Q. H., Ma K., Shao Y., Xu S. J., Wu F., Liu G. Y., Teramae N., Bao H. F.,, 2012,, 86―91
[27] Ihara T., Ishii T., Araki N., Wilson A. W., Jyo A.,, 2009,(11), 3826―3827
[28] Feng L. Y., Huang Z. Z., Ren J. S., Qu X. G.,, 2012,(16), e122
[29] Sengupta B., Springer K., Buckman J. G., Story S. P., Abe O. H., Hasan Z. W., Prudowsky Z. D., Rudisill S. E., Degtyareva N. N., Petty J. T.,, 2009,(45), 19518―19524
[30] Ai J., Guo W. W., Li B. L., Li T., Li D., Wang E. K.,, 2012,, 450―455
[31] Tao G. Y., Chen Y., Lin R. Y., Zhou J., Pei X. J., Liu F., Li N.,, 2018,(4), 2237―2247
[32] Latorre A., Lorca R., Zamora F., Somoza A.,, 2013,(43), 4950―4952
[33] Yeh H. C., Sharma J., Han J. J., Martinez J. S., Werner J. H.,, 2010,(8), 3106―3110
[34] Yeh H. C., Sharma J., Shih I. M., Vu D. M., Martinez J. S., Werner J. H.,, 2012,(28), 11550―11558
[35] Li J. J., Zhong X. Q., Zhang H. Q., Le X. C., Zhu J. J.,, 2012,(12), 5170―5174
[36] Guo Y. H., Zhang Y., Pei R. J., Cheng Y. L., Xie Y. F., Yu H., Yao W. R., Li H. W., Qian H.,⁃, 2019,, 493―498
[37] Ma J. L., Yin B. C., Ye B. C.,, 2015,(119), 98467―98471
[38] Zhang B. Z., Wei C. Y.,, 2017,(89), 56289―56295
[39] Zhang B. Z., Wei C. Y.,, 2018,, 125―130
[40] Lee J., Park J., Lee H. H., Parkc H, Kimb H. I., Kim W. J.,, 2015,, 642―647
[41] Zhang J., Xia Y. K., Chen M., Wu D. Z., Cai S. X., Liu M. M., He W. H., Chen J. H.,⁃, 2016,, 79―85
[42] Li T. T., Xiao P. F., Khan A., Wang Z. L., He N. Y.,, 2017,(6), 892―896
[43] Qin Y., Daniyal M., Wang W. M., Jian Y. Q., Yang W., Qiu Y. X., Tong C. Y., Wang W., Liu B.,⁃, 2019,, 485―492
[44] Eun H., Kwon W. Y., Kalimuthu K, Kim Y., Lee M., Ahn J. O., Lee H., Lee S. H., Kim H. J., Park H. G., Park K. S.,, 2019,(15), 2512―2517
[45] Han B. Y., Wang E. K.,, 2011,(5), 2585―2589
[46] Zhang P., Jia C. Y., Zhao Y. N., Luo H. H., Tan X., Ma X. H., Wang Y.,, 2019,(9), e609
[47] Li C. Y., Wei C. Y.,⁃, 2017,, 451―458
[48] Huang Z. Z., Pu F., Lin Y. H., Ren J. S., Qu X. G.,, 2011,(12), 3487―3489
[49] Xie J. P., Zheng Y. G., Ying J. Y.,, 2010,(6), 961―963
[50] Morishita K., MacLean J. L., Liu B. W., Jiang H., Liu J. W.,, 2013,(7), 2840―2849
[51] Cao H. Y., Chen Z. H., Zheng H. Z., Huang Y. M.,, 2014,, 189―195
[52] Zhang M., Ye B. C.,, 2011,(24), 5139―5142
[53] Zhou Y., Zhou T. S., Zhang M., Shi G. Y.,, 2014,(12), 3122―3126
[54] Ma J. L., Yin B. C., Wu X., Ye B. C.,, 2016,(18), 9219―9225
[55] Wang R. J., Yan X. L., Sun J., Wang X., Zhao X. E., Liu W., Zhu S. Y.,⁃, 2018,(34), 4183―4188
[56] Lin X. D., Hao Z., Wu H. T., Zhao M. Y. Gao X., Wang S., Liu Y. Q.,, 2019,(9), e648
[57] Lan G. Y., Chen W. Y., Chang H. T.,, 2011,(5), 802―807
[58] Peng J., Ling J., Zhang X. Q., Bai H. P., Zheng L. Y., Cao Q. E., Ding Z. T.,, 2015,, 1250―1257
[59] Xie P. S., Zhan Y. J., Wu M., Guo L. H., Lin Z. Y., Qiu B., Chen G. N., Cai Z. W.,, 2017,, 103―108
[60] Zhang L. B., Zhu J. B., Guo S. J., Li T., Li J., Wang E. K.,, 2013,(7), 2403―2406
[61] Lu S. S., Wang S., Zhao J. H., Sun J., Yang X. R.,, 2017,(16), 8429―8436
[62] Nasirian V., Shamsipur M., Molaabasi F., Mansouri K., Sarparast M., Salim V., Barati A., Kashanian S.,⁃, 2020,, e127673
[63] Chen C. W., Wang C. H., Wei C. M., Hsieh C. Y., Chen Y. T., Chen Y. F., Lai C. W., Liu C. L., Hsieh C. C., Chou P. T.,, 2010,, 799―802
[64] Ma J. L., Yin B. C., Le H. N., Ye B. C.,, 2015,(23), 12856―12863
[65] Tao Y., Lin Y. H., Huang Z. Z., Ren J. S., Qu X. G.,, 2012,(11), 2588―2592
[66] Liu X. Q., Wang F., Aizen R., Yehezkeli O., Willner I.,, 2013,(32), 11832―11839
[67] Lee C. Y., Park K. S., Jung Y. K., Park H. G.,, 2017,, 293―297.
[68] Wang W., Zhan L., Du Y. Q., Leng F., Chang Y., Gao M. X., Huang C. Z.,⁃, 2013,(20), 5555―5559
[69] Khan I. M., Zhao S., Niazi S., Mohsin A., Shoaib M., Duan N., Wu S. J., Wang Z. P.,⁃, 2018,, 328―335
[70] Zhang X. Y., Khan I. M., Ji H., Wang Z. P., Tian H. L., Cao W. B., Mi W. Y.,, 2020,(1), e152
[71] Liu X. Q., Wang F., Niazov⁃Elkan A., Guo W. W., Willner I.,, 2013,(1), 309―314
[72] Lee J., Park J., Lee H. H., Kim H. I., Kim W. J.,, 2014,(17), 2616―2621
[73] Wang G. F., Zhu Y. H., Chen L., Wang L., Zhang X. J.,, 2014,(1), 165―169
Application of DNA Silver Nanoclusters in the Fluorescence Biosensors based on Functional Nucleic Acids
WANGJunyang, LIUZheng, ZHANGQian, SUNChunyan*, LIHongxia*
(,,130062,)
DNA silver nanoclusters(DNA-AgNCs) are a kind of fluorescent nanoprobes obtained by reducing Ag+with NaBH4using DNA as template, because the N atoms on the base heterocyclic are combined with Ag+. Due to the advantages of simple synthesis method, good biocompatibility and adjustable fluorescence emission wavelength, DNA-AgNCs have been widely used in the fields of analysis and detection. In this paper, the application of DNA-AgNCs as label-free fluorescent probes in functional nucleic acids biosensing detection is classified and summarized. In addition, conclusive views on the deficiencies and application potential are put forward, which provide references for future research and application.
DNA silver nanocluster; Functional nucleic acid; Fluorescence; Biosensor
O657.3
A
10.7503/cjcu20220010
2022-01-06
2022-02-08.
孙春燕, 女, 博士, 教授, 主要从事食品营养与安全检测技术方面的研究. E⁃mail: sunchuny@jlu.edu.cn
李红霞, 女, 博士, 副教授, 主要从事生物传感分析方法建立与食品安全检测方面的研究. E-mail: hxiali@jlu.edu.cn
吉林省科技发展计划项目(批准号: 20200201218JC)、 吉林省教育厅“十三五”科学技术研究规划项目(批准号: JJKH20201010KJ)和吉林大学杰出青年教师培育项目(批准号: 2132020KJC020).
Supported by the Science and Technology Development Program of Jilin Province, China(No.20200201218JC), the “Thirteenth Five-Year” Science and Technology Project of Education Department of Jilin Province, China(No.JJKH20201010KJ) and the Outstanding Young Teachers Training Program of Jilin University, China(No.2132020KJC020).
(Ed.: N, K)

