肿瘤患者头孢哌酮和美罗培南药物抗体阳性率及影响因素分析
邵树军,祁 欣,桂佳林,高 明,陈玉平,王兰菊
1郑州大学附属肿瘤医院(河南省肿瘤医院)输血科,河南 郑州 450008;2江苏力博医药生物技术股份有限公司,江苏 江阴 214400
近年来随着抗生素的广泛使用,治疗过程中患者容易产生药物抗体,从而诱发药物诱导的免疫溶血性贫血(drug-induced immune hemolytic anemia,DIIHA)。DIIHA 的发病率虽然较低,但其临床表现多样,不易与其他类型溶血性贫血鉴别,容易漏诊或误诊,延误治疗可能发生器官损伤,严重者可致生命危险[1]。头孢哌酮为第三代头孢菌素,是经典的β-内酰胺类抗生素,美罗培南为碳青霉烯类抗生素,是非典型的β-内酰胺类抗生素,具有耐酶性、广谱性、高效性和低毒性等优点[2]。虽然头孢哌酮和美罗培南作为抗菌药物在临床上使用广泛,然而其药物抗体的产生情况尚不清楚。为了解头孢哌酮和美罗培南在肿瘤患者中药物抗体的产生情况,本研究收集501例在郑州大学附属肿瘤医院住院期间使用头孢哌酮和美罗培南治疗的肿瘤患者血液样本,检测其药物抗体,探讨肿瘤患者使用这两种抗生素药物后产生药物抗体的阳性率及其与患者疾病、性别、年龄等因素的关系,以指导临床抗生素精准用药,降低患者发生DIIHA的风险。
1 对象和方法
1.1 对象
随机选取2020 年11—12 月在郑州大学附属肿瘤医院住院使用头孢哌酮和美罗培南治疗的肿瘤患者,剔除使用抗菌中药制剂和抗病毒药的病例后,共501 例纳入本研究,其中男305 例,女196 例;使用头孢哌酮的患者406 例,使用美罗培南的患者95 例,分别记录每个病例的性别、年龄、临床诊断等信息。给药方式采用静脉滴注和微量泵,通常3 g/次,每天1次,或1.5 g/次,每天2次。本研究经河南省肿瘤医院伦理委员会审批同意,所有受试者知情同意。
1.2 方法
头孢哌酮抗体检测试剂盒(微柱凝集法,批号:200909)、美罗培南抗体检测试剂盒(微柱凝集法,批号:200909)均购于江苏中济万泰生物医药有限公司;生理氯化钠溶液(批号:2004192003)由石家庄四药有限公司提供。LB-C02-1 免疫微柱孵育器为江苏力博医药生物技术有限公司产品;LB-3000医用离心机购于无锡源博生物科技有限公司。
分别留取患者用药前及用药后3~7 d的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝血样本5 mL,1 500g离心5 min,分离血浆,4 ℃保存待检。应用微柱凝胶法检测血浆药物抗体,将样本从4 ℃取出待检。取头孢哌酮/美罗培南药物抗体检测试剂卡,每份待检患者样本标记4孔(分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ)。将头孢哌酮待检血浆样本用生理盐水1∶2 稀释,美罗培南待检血浆样本不稀释。分别向第Ⅰ、Ⅱ、Ⅲ孔的每孔中加入头孢哌酮或美罗培南处理的红细胞悬液各25 μL,向第Ⅳ孔中加入非头孢哌酮或非美罗培南处理的红细胞悬液25 μL。向第Ⅰ和第Ⅳ孔中分别加入待测血浆样本50 μL,第Ⅱ孔中加入阳性对照液50 μL,第Ⅲ孔中加入阴性对照液50 μL。混匀,置试剂卡孵育器(37±1)℃孵育1 h。将以上样品分别置凝胶卡离心机离心5 min(900 r/min×2 min,1 500 r/min×3 min),30 min 内观察结果并记录。判定原则:①Ⅰ、Ⅱ孔均阳性,Ⅲ、Ⅳ孔均阴性,判断为药物性抗体阳性;②Ⅱ、Ⅳ孔均阳性,Ⅲ孔阴性,判断为红细胞特异性抗原对应抗体阳性;③Ⅰ、Ⅲ、Ⅳ孔均阴性,Ⅱ孔阳性,判断为药物性抗体阴性;④Ⅰ、Ⅱ、Ⅲ、Ⅳ孔均阴性,则实验失败,再重新实验。所有阳性样本经二次复测确认。
1.3 统计学方法
使用SPSS 22.0 进行统计学分析,计数资料用例数(百分率)表示,根据年龄、疾病、性别分组,组间药物阳性率的比较均采用卡方检验,两两比较采用Bonferroni 法校正P值,P<0.05 为差异有统计学意义。
2 结果
2.1 头孢哌酮和美罗培南药物抗体检测结果
使用头孢哌酮的406例患者头孢哌酮药物抗体检测结果,头孢(+)/非头孢(+)双阳性为46例,头孢(+)/非头孢(-)78 例,头孢(-)/非头孢(-)双阴性257例,头孢(-)/非头孢(+)25例。头孢哌酮药物抗体阳性率为30.54%(124/406)(图1)。

图1 头孢哌酮药物抗体检测结果Figure 1 The detection results of cefoperazone antibodies
使用美罗培南的95 例患者美罗培南药物抗体检测结果,美罗(+)/非美罗(+)26 例,美罗(+)/非美罗(-)12 例,美罗(-)/非美罗(-)56 例,美罗(-)/非美罗(+)1 例,美罗培南药物抗体阳性率为40.00%(38/95)(图2),美罗培南和头孢哌酮药物抗体阳性率差异无统计学意义(P>0.05)。

图2 美罗培南药物抗体检测结果Figure 2 The detection results of meropenem antibodies
2.2 不同肿瘤患者抗生素抗体分析
不同肿瘤患者头孢哌酮和美罗培南药物抗体的检出情况见表1。头孢哌酮药物抗体阳性患者以血液系统和消化系统肿瘤为主,其中血液系统肿瘤患者的头孢哌酮药物抗体阳性率最高,为36.43%(51/140),美罗培南药物抗体阳性患者同样以血液系统肿瘤为主,此类患者的美罗培南药物抗体阳性率为40.96%(34/83)。

表1 不同肿瘤患者头孢哌酮和美罗培南药物抗体阳性率比较Table 1 The positive rates of cefoperazone and meropenem drug antibodies in different tumor patients
2.3 头孢哌酮和美罗培南药物抗体阳性患者的性别分布
头孢哌酮药物抗体检测,男305例,女101例,共406例。检出头孢哌酮药物抗体阳性患者124例,其中男83例,抗体阳性率为27.21%(83/305),女41例,抗体阳性率为40.59%(41/101)。女性头孢哌酮药物抗体阳性率显著高于男性(P<0.01)。
美罗培南药物抗体检测,男53 例,女性42 例,共95 例。检出美罗培南药物抗体阳性患者38 例,其中男27 例,抗体阳性率为50.94%(27/53),女11 例,抗体阳性率为26.19%(11/42)。男性美罗培南药物抗体阳性率显著高于女性(P<0.01)。
2.4 头孢哌酮和美罗培南抗体阳性患者的年龄分布
按照年龄将患者分为8 组,分别是<18 岁组、18~30 岁组、31~40 岁组、41~50 岁组、51~60 岁组、61~70 岁组、71~80 岁组、>80 岁组,不同年龄分组的检测结果表明,各年龄组头孢哌酮药物抗体阳性率有差异(P<0.01,表2),31~40 岁组的药物抗体阳性率最高,为70.37%。各年龄组美罗培南药物抗体阳性率有差异(P<0.01,表2),41~50岁组药物抗体阳性率最高,达到86.67%。
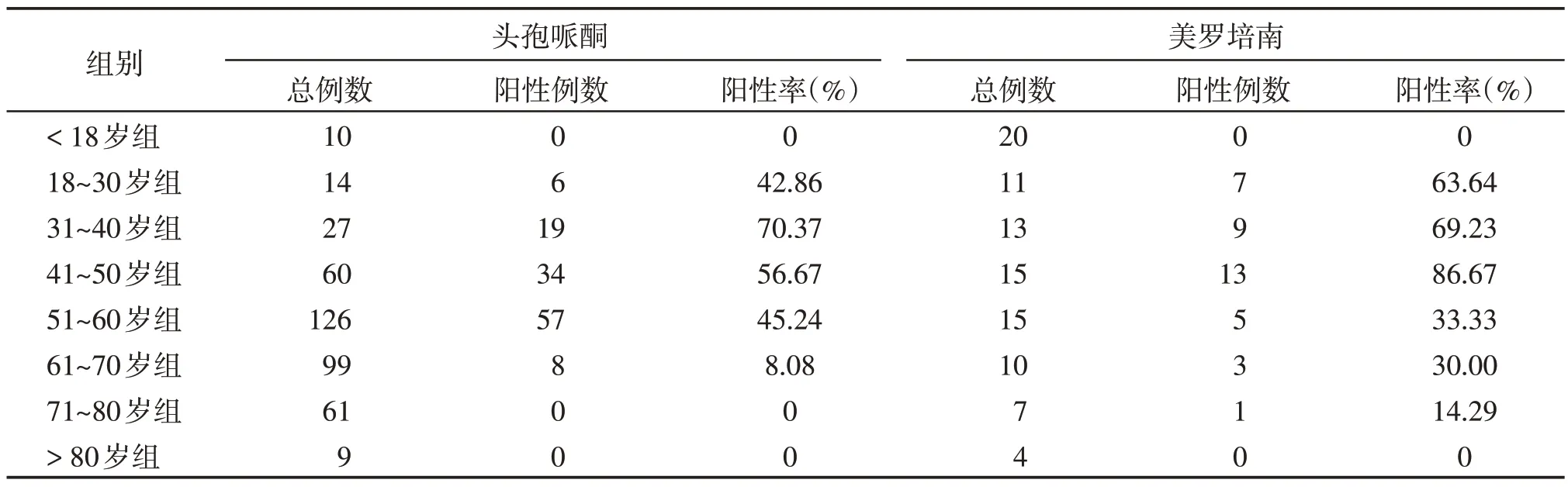
表2 不同年龄段患者头孢哌酮和美罗培南药物抗体阳性率Table 2 The positive rates of cefoperazone and meropenem drug antibodies in patients of different ages
3 讨论
随着现代医学的不断发展,抗菌药物应用越来越广泛,尤其对于复杂难治性疾病的治疗,如肿瘤患者在治疗过程中出现急性粒细胞缺乏引起的发热症状、接受放化疗治疗后由于免疫力低下而造成的感染,都需要使用抗生素进行治疗。因此对肿瘤患者使用抗生素后产生的药物抗体,及其引起的溶血等不良反应需得到足够重视。
药物引起的溶血主要原因有红细胞酶缺乏、血红蛋白不稳定、药物的毒性作用及DIIHA[3-4]。DIIHA 是一种由IgG 或IgM 介导的细胞毒性抗体Ⅱ类变态反应,主要发病机制是由于机体产生相应的抗药物抗体,再次使用该药物时可能导致溶血反应的发生。DIIHA 与药物活性无关,主要是长时间或接触大量药物导致的[5]。抗菌药物导致的DIIHA 溶血不良反应最为常见[6-7],其中又以二代或三代头孢菌素类药物所占比例最大[8]。前期研究表明,头孢哌酮为第三代头孢菌素,是经典的β-内酰胺类抗生素,对β-内酰胺酶稳定性较差,抗菌性能与头孢噻肟相似,对绿脓杆菌的作用较强[9]。美罗培南为碳青霉烯类抗生素,是非典型的β-内酰胺类抗生素,具有耐酶性、广谱性、高效性和低毒性等优点[10]。
目前对抗生素药物抗体引起溶血的研究相对较少。据国内相关文献报道,针对327 例使用过抗生素药物的样本检测数据显示,有13例检出药物抗体,占4.0%,4例出现明显溶血反应[11]。在181例样本中检测到抗青霉素类抗体8 例,其中4 例有明显溶血反应[12]。此外,在入院后接受哌拉西林治疗的病例组患者新增药物抗体阳性率也远远高于对照组,且用药后出现血色素明显下降,说明使用哌拉西林易产生药物抗体[13],并且早在1994 年就有第1 例哌拉西林致敏溶血性贫血的报道,说明哌拉西林具有触发DIIHA的风险[14]。
本文研究结果表明,肿瘤患者中头孢哌酮药物抗体阳性率为30.54%,美罗培南药物抗体阳性率为40.00%。本文结果提示肿瘤患者使用头孢哌酮和美罗培南可诱导机体产生药物抗体,临床上应做好这两种抗生素药物抗体的检测,预警可能发生的DIIHA等不良反应。虽然DIIHA在临床工作中并不常见,但一旦发生若不能及时诊断和治疗,则可能对患者的生命产生威胁。虽然本研究中未发现由头孢哌酮和美罗培南药物抗体引起的DIIHA,但国内外已有报道因抗生素类药物性抗体引起的DIIHA造成脏器衰竭甚至死亡[15]。
本研究还发现,血液系统肿瘤患者的头孢哌酮药物抗体阳性率最高,为36.43%,美罗培南药物抗体阳性患者同样以血液系统肿瘤为主,占40.96%。此前有文献报道,肿瘤患者在接受化疗过程中易出现中性粒细胞缺乏,其发生率为2%~28%,是肿瘤患者最常见、最严重的并发症[16-17]。粒缺性发热是癌症化疗患者常见且严重的并发症。目前关于肿瘤患者粒缺性发热的治疗,主要为在出现发热时立即开始经验性抗菌治疗[18]。美罗培南是目前临床上常用于肿瘤患者粒缺性发热的抗生素之一[19]。本研究中血液系统肿瘤患者检出美罗培南药物抗体阳性率较高,可能与常用其治疗粒缺性发热有关。因此,血液系统肿瘤患者在应用抗生素时需要检测抗生素药物抗体,根据检测情况注意调整抗生素,避免DIIHA等不良反应的发生。
此外,本研究还发现31~40岁组的头孢哌酮药物抗体阳性率最高,为70.37%,男性头孢哌酮药物抗体阳性率(27.21%)显著低于女性(40.59%)(P<0.01)。41~50 岁组美罗培南药物抗体阳性率最高,达到86.67%,其中男性药物抗体阳性率为50.94%,女性药物抗体阳性率为26.19%,男性美罗培南药物抗体阳性率显著高于女性(P<0.01)。因此,有必要重视高危年龄段肿瘤患者的抗生素使用情况,考虑到不同性别患者在使用抗生素时产生不良反应的概率,明确用药指征,做到有据可依,提供用药预警,实现精准用药。

