PLOD2对卵巢癌奥沙利铂化疗耐药的影响及机制研究
边苏苏,陈玉凤,张雯晴,蒯兴旺,常新霞,唐 奇,冯振卿*
1南京医科大学病理学系,2国家卫生健康委员会抗体技术重点实验室,江苏 南京 211166
卵巢癌在全球女性恶性肿瘤中,发病率和病死率分居第7位和第8位,5年生存率低于45%。在中国女性生殖系统恶性肿瘤中卵巢癌的发病率和病死率分别居第3 位和第1 位,每年的新发病例为52 100 例,死亡达22 500 例。手术联合铂类化疗作为一线治疗方案,很大程度上缓解了患者病情,但仍有高达70%的病例会复发[1-2]。卵巢癌复发与耐药性的产生密切相关,深入探讨卵巢癌耐药的发生机制,提高化疗的敏感性,对于改善卵巢癌患者的预后具有重要意义。
赖氨酸羟基化酶2(procollagenlysine 2-xoglutarate 5-dioxygenase 2,PLOD2)是PLOD 家族的一员,由PLOD2基因编码,是胶原交联形成过程中的关键酶[3]。PLOD2 可促进多种肿瘤的侵袭进展,包括乳腺癌、肝癌、非小细胞肺癌等[4-6]。铂类药物常作为卵巢癌一线化疗的首选药物,其中奥沙利铂作为第三代铂类化疗药,被广泛应用于卵巢癌治疗,但容易产生获得性耐药。PLOD2 表达与多种肿瘤的预后不良有关,但PLOD2对卵巢癌化疗耐药的影响及分子机制尚不清楚。本研究拟采用干扰或过表达PLOD2的方法,观察PLOD2对卵巢癌奥沙利铂化疗耐药的影响,初步探讨其分子机制,为卵巢癌临床化疗耐药的研究及逆转提供理论基础。
1 材料和方法
1.1 材料
人卵巢 癌细胞 株A2780、OV1063、PEO4、HO8910、SKOV3,工具细胞293T 由本实验室保存。RPMI 1640 培养基、DMEM 培养基、100×青霉素/链霉素双抗、胎牛血清(Gibco公司,美国);pPLK/GFP+Puro-PLOD2 shRNA和pLenti-CMV-PLOD2-Flag-GFPPuro 质粒(南京晶百生物公司);Lenti-Pac 慢病毒包装试剂盒(GeneCopoeia 公司,美国);嘌呤霉素(Sigma 公司,美国);RIPA 裂解液、BCA 蛋白定量检测试剂盒、蛋白上样缓冲液(南京碧云天生物公司);鼠抗人PLOD2 单克隆抗体(Proteintech 生物公司,美国);鼠抗人PLOD2 单克隆抗体(R&D 生物公司,美国);兔抗人MRP1 多克隆抗体、兔抗人BCRP多克隆抗体(沈阳万类生物公司);HRP 标记的兔抗小鼠IgG 抗体、HRP 标记的山羊抗兔IgG 抗体(Abcam 公司,美国);CCK-8 试剂盒(同仁公司,日本);细胞/组织总RNA 提取试剂盒、High-Capacity cDNA 逆转录试剂盒、SYBR 荧光定量PCR 试剂盒(南京诺唯赞生物公司);Annexin V-kFluor647/PI 双染细胞凋亡检测试剂盒(南京凯基生物公司)。
1.2 方法
1.2.1 细胞培养
按照10%胎牛血清和1%双抗的比例配制RPMI 1640、DMEM 完全培养基,卵巢癌细胞株A2780、OV1063、PEO4、HO8910 和SKOV3 培养于RPMI 1640 完全培养基,293T 细胞培养于DMEM 完全培养基,置于37 ℃和5% CO2的恒温生物培养箱中。每2 d换液,待细胞融合度达90%,进行胰酶消化及传代培养。
1.2.2 PLOD2低表达细胞株和高表达细胞株的鉴定
培养卵巢癌细胞OV1063、HO8910、SKOV3、PEO4、A2780,待其处于对数生长期,根据细胞量用RIPA裂解液提取细胞总蛋白,BCA试剂盒测定蛋白浓度,按照1∶4 的比例加入5×上样缓冲液,95 ℃煮沸10 min,分装后存放于-20 ℃。取等量蛋白质,用SDS-PAGE 法分离后转至PVDF 膜,5%的脱脂奶粉溶液封闭后孵育鼠抗人PLOD2 单克隆抗体(1∶1 000)、鼠抗人GAPDH 单克隆抗体(1∶1 000),4 ℃过夜;次日孵育HRP 标记的兔抗小鼠IgG 抗体(1∶10 000),滴加ECL 发光液后曝光。ImageJ 进行蛋白定量分析。实验重复3次。
1.2.3 PLOD2干扰和过表达质粒的构建及鉴定
PLOD2干扰和过表达质粒及空载体质粒均由晶百生物公司合成,其中干扰质粒目标基因长度为61 bp(Gene ID:852;Accessions:NM_000435),PLOD2 shRNA序列为5′-CCAGTTACACTGAAGGTCTTT-3′;过表达质粒目标基因长度为2 238 bp(Gene ID:5352;Accessions:NM_000935)。DH5α感受态细胞进行质粒转化,均匀涂抹菌液于含氨苄青霉素(ampicillin,AMP)的LB 平板,倒置平放12~16 h,进行单克隆挑选,并放置于LB 液体培养基,37 ℃摇床200 r/min,12~16 h,可见菌液浑浊,保存菌液于-80 ℃。取少量送南京金斯瑞公司进行测序,以验证PLOD2 干扰序列克隆入pPLK/GFP+Puro 载体和PLOD2 过表达序列克隆入pLenti-CMV-GFP-Puro载体。
1.2.4 慢病毒包装及滴度测定
10 cm 培养皿培养293T 细胞,待融合度达80%左右,用三质粒包装系统按照Lenti-Pac 慢病毒包装试剂说明书进行慢病毒包装。6~8 h 换液,48 h 和72 h 各收1 次病毒,混合后2 000 r/min,离心10 min去除细胞碎片,并用0.45 μm 滤器过滤。慢病毒浓缩液浓缩4 ℃过夜。次日,5 000 r/min 离心40 min,离心机提前4 ℃预冷。小心吸弃上清,用RPMI 1640 进行重悬得慢病毒。1×104个/孔293T 细胞铺于96 孔板,设定10 个孔,第1 个是空白对照,从第2 个孔开始,慢病毒1∶10 倍比稀释,培养48 h 根据293T细胞的荧光率计算慢病毒滴度。
1.2.5 病毒感染及稳定株筛选
将A2780 细胞株和OV1063 细胞株分别接种于6 孔板,次日按照病毒感染复数MOI40 和MOI30 进行慢病毒感染,感染含干扰质粒和过表达质粒的慢病毒的细胞分别标记为shPLOD2和OEPLOD2,感染空载体慢病毒的细胞分别标记为shControl 和OEControl,并添加polybrene增强感染效率。48 h观察荧光并进行嘌呤霉素筛选。同时设立空白对照组,待空白对照组细胞全部死亡,并且转染病毒组细胞呈现簇状生长,进行半量维持筛选2周。
1.2.6 检测PLOD2表达变化
1.2.6.1 实时荧光定量PCR(qRT-PCR)
待细胞进入对数生长期,根据细胞/组织总RNA 提取试剂盒提取细胞总RNA,再根据High-Capacity cDNA 逆转录试剂盒说明书逆转录总RNA为cDNA。最后根据SYBR荧光定量PCR试剂盒说明书进行荧光定量扩增。反应体系为:Premix 10 μL,PLOD2 或18S 上下游引物(10 μmol/L)各0.4 μL,cDNA模板2 μL,去离子水7.2 μL。每个样品3个复孔,该实验重复3次。相关引物序列:PLOD2上游引物5′-CTCGAGCATCCCCACAGATAA-3′,下游引物5′-TTGACCAAGGACCTTCACAGT-3′;18S 上游引物5′-AACCCGTTGAACCCCATT-3′,下游引 物5′-CCATCCAATCGGTAGTAGCG-3′。PCR 扩增条件:95 ℃30 s 预变性;95 ℃10 s,60 ℃30 s,40 个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s。反应结束后检测目的基因和相应内参18S 的CT值,基因表达的相对定量值以2-ΔΔCT计算。
1.2.6.2 免疫印迹试验(Western blot)
取shPLOD2 组、shControl 组、OEPLOD2 组、OEControl 组对数生长期细胞,提取蛋白、测定蛋白浓度、进行Western blot 并计算灰度值与1.2.2 方法相同。
1.2.7 CCK-8实验
胰酶消化各组对数生长期细胞后,以5 000 个/孔细胞铺于96孔板,每孔含100 μL RPMI 1640完全培养基,每组3个复孔。过夜后,设定奥沙利铂浓度依次为0、0.25、0.50、1.00、2.00、4.00 μmol/L,继续培养48 h后,吸弃旧培养基,后加入每孔10 μL CCK-8和90 μL 培养基,同时设定不含细胞只含CCK-8 的空白对照孔,37 ℃和5% CO2的恒温生物培养箱培养2 h,用Multiskan Spectrum 酶标仪测定450 nm 波长处的吸光度。该实验重复3次。细胞抑制率=[1-(加药组-空白组)/(未加药组-空白组)]×100%。
1.2.8 克隆形成实验
取对数生长期的各组细胞,按照500 个/孔的浓度种植于6孔板,贴壁后用奥沙利铂1.25 μmol/L 药物处理,继续培养14 d。用4%多聚甲醛固定30 min后,用结晶紫染色20 min。进行拍照并统计,该实验重复3次。
1.2.9 流式细胞术检测细胞凋亡
取对数生长期的各组细胞,以4×105个/孔接种于6 孔板,待过夜贴壁后加入1.25 μmol/L 奥沙利铂,对照组加入等量PBS作为对照。48 h后,收集旧培养基,用不含EDTA的胰酶消化细胞,终止消化,1 000 r/min离心5 min后,用PBS重悬细胞并2 000 r/min离心5 min,重复1次。加入Annexin V-kFluor647/PI双染细胞凋亡检测试剂,4 ℃避光15 min,用BD FACS Aria ⅡSORP 分选型流式细胞仪和Beckman Coulter CytoFLEX 流式细胞仪进行细胞凋亡率测定。该实验重复3次。
1.2.10 裸鼠皮下成瘤实验
取4~6 周龄雌性BALB/c-NULL 裸鼠30 只,购自南京医科大学实验动物中心,饲养于SPF 级动物房屏障系统的洁净层流架内,保持相对湿度40%~60%,温度(25±1)℃,生长所需的垫料、饲料和饮水均经灭菌处理,自由进食和饮水,每日保持10 h的光照,14 h 无光的明暗周期,实验前适应性饲养1周。所开展的动物实验均通过南京医科大学实验动物福利伦理委员会批准(批准编号为IACUC-2106029)。收集shPLOD2 和shControl 的对数生长期细胞,80%左右密度用胰酶进行消化,RPMI 1640培养基调整细胞密度为1×108个/mL 的细胞悬液。细胞悬液100 μL/只注射到裸鼠皮下,7 d 成瘤,舍弃未成瘤和瘤体直径超过1 cm 的裸鼠。shPLOD2组和shControl 组再分为奥沙利铂处理组和PBS 对照组,每组6 只。奥沙利铂处理组每周1 次腹膜内注射奥沙利铂(10 mg/kg),对照组则注射等量PBS溶液。每3 d 用游标尺测量肿瘤大小并记录,肿瘤体积=长径×短径2/2[7]。1个月后,处死裸鼠,分离裸鼠皮下的瘤体,并进行称重。
1.2.11 检测BCRP和MRP1的表达变化
1.2.11.1 qRT-PCR检测BCRP和MRP1 mRNA变化
待细胞进入对数生长期,根据细胞/组织总RNA 提取试剂盒提取细胞总RNA,再根据High-Capacity cDNA 逆转录试剂盒说明书逆转录总RNA 为cDNA。最后根据SYBR 荧光定量PCR 试剂盒说明书进行荧光定量扩增。反应体系为:Premix 10 μL,上下游引物(10 μmol/L)各0.4 μL,cDNA模板2 μL,去离子水7.2 μL。每个样品3个复孔,该实验重复3 次。相关引物序列:BCRP 上游引物5′-CAGGTGGAGGCAAATCTTCGT-3′,下游引物5′-ACCCTGTTAATCCGTTCGTTTT-3′;MRP1 上游引物5′-CTCTATCTCTCCCGACATGACC-3′,下游引物5′-AGCAGACGATCCACAGCAAAA-3′;18S 上游引物5′-AACCCGTTGAACCCCATT-3′,下游引物5′-CCATCCAATCGGTAGTAGCG-3′。扩增条件和计算方法与前文相同。
1.2.11.2 Western blot检测BCRP和MRP1的蛋白表达
取对数生长期细胞,根据细胞量用RIPA 裂解液提取细胞总蛋白,BCA 试剂盒测定蛋白浓度,按照1∶4的比例加入5×上样缓冲液,95 ℃煮沸10 min,分装后存放于-20 ℃。取等量蛋白质,用SDS-PAGE法分离后转至PVDF 膜,5%的脱脂奶粉溶液封闭后孵育兔抗人MRP1 多克隆抗体(1∶1 000)、兔抗人BCRP 多克隆抗体(1∶1 000)、鼠抗人GAPDH单克隆抗体(1∶1 000),4 ℃过夜;次日孵育对应的HRP 标记的山羊抗兔IgG 抗体(1∶10 000)和兔抗小鼠IgG 抗体(1∶10 000),滴加ECL 发光液后曝光。ImageJ 进行蛋白定量分析。实验重复3 次。
1.3 统计学方法
用Graphpad Prism 7.0进行统计学分析,计量资料以均值±标准差()表示,两组比较采用t检验,多组间比较采用单因素方差分析,用Tukey 法进行两两比较检验,P<0.05为差异有统计学意义。
2 结果
2.1 PLOD2在不同卵巢癌细胞中的表达
提取不同卵巢癌细胞OV1063、HO8910、SKOV3、PEO4、A2780 中的总蛋白,进行Westerrn blot实验。结果表明,PLOD2在OV1063细胞中相对低表达,在A2780 细胞中相对高表达(图1)。选择OV1063 为PLOD2 低表达细胞株,A2780 为PLOD2高表达细胞株进行后续实验。
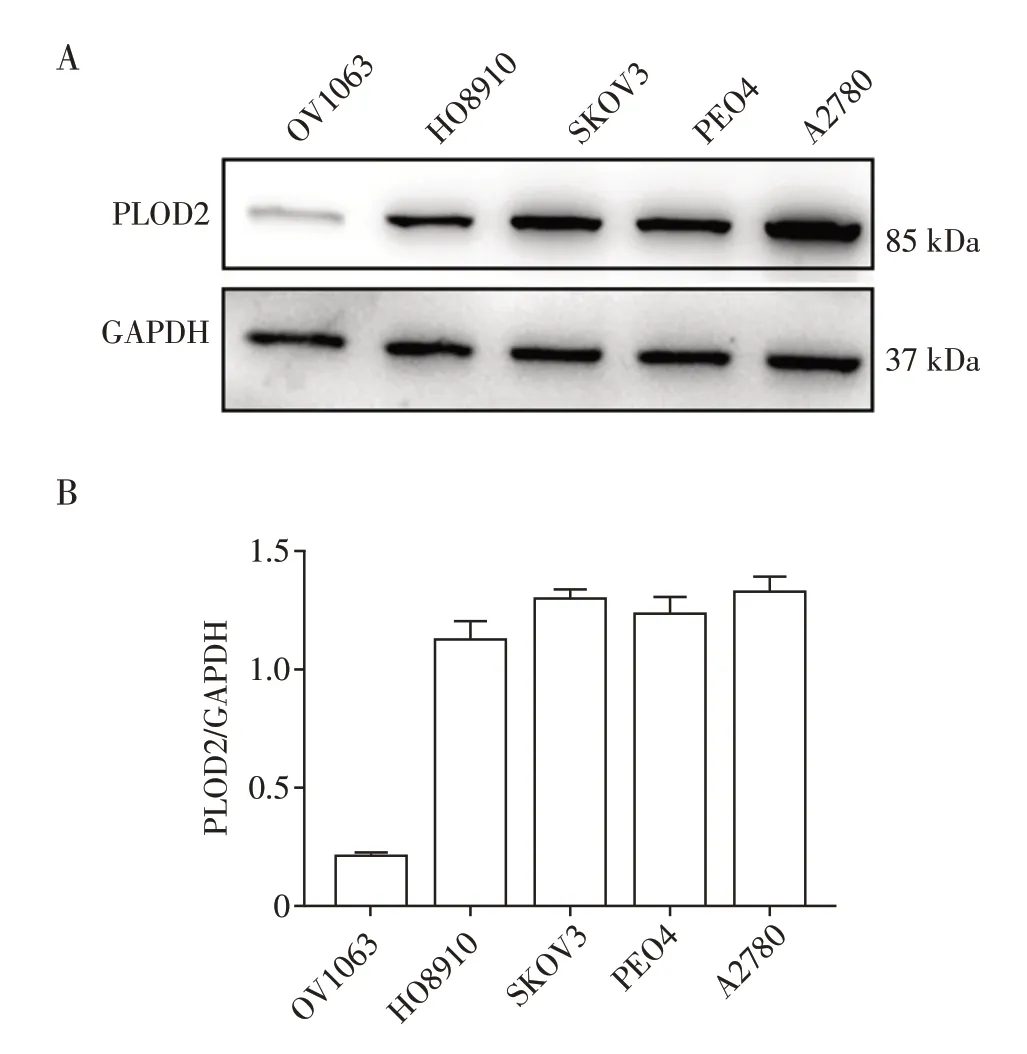
图1 PLOD2在卵巢癌细胞株中的蛋白表达情况Figure 1 Protein expression of PLOD2 in ovarian cancer cell lines
2.2 慢病毒干扰和过表达质粒的构建及鉴定
将针对PLOD2 基因的干扰和过表达质粒进行DNA 测序,测序结果通过Blast 序列比对,证实shPLOD2 已正确克隆入pPLK/GFP+Puro 载体,表明重组shPLOD2质粒构建成功;OEPLOD2已正确克隆入pLenti-CMV-GFP-Puro 载体,表明OEPLOD2 质粒构建成功。
2.3 shPLOD2 质粒和OEPLOD2质粒的转染效率
慢病毒表达载体pPLK/GFP+Puro和pLenti-CMVGFP-Puro 带有绿色荧光蛋白(GFP)基因,可以通过观察绿色荧光来评估转染效率。shPLOD2 组和shControl 组的荧光较空白对照组有显著升高,转染效率>90%(图2A)。OEPLOD2 组和OEControl 组的荧光较空白对照组有显著升高,转染效率>90%(图2B)。

图2 PLOD2干扰和过表达质粒的转染效率Figure 2 Transfection efficiency of PLOD2 interference and overexpressed plasmids
2.4 shPLOD2质粒的干扰效果和OEPLOD2质粒的过表达效果
qRT-PCR 结果表明,在shPLOD2 细胞株中PLOD2 mRNA 表达水平较shControl 组明显下降(P<0.01,图3A),OEPLOD2 细胞株 中PLOD2 mRNA表达水平较OEControl 组明显升高(P<0.01,图3B)。Western blot 检测各组细胞中PLOD2 蛋白表达,结果显示,shPLOD2 组细胞的PLOD2 蛋白表达水平较shControl 组明显下调(P<0.01,图3C、E),OEPLOD2 组细胞的PLOD2 蛋白表达水平较OEControl组明显上调(P<0.01,图3D、F)。
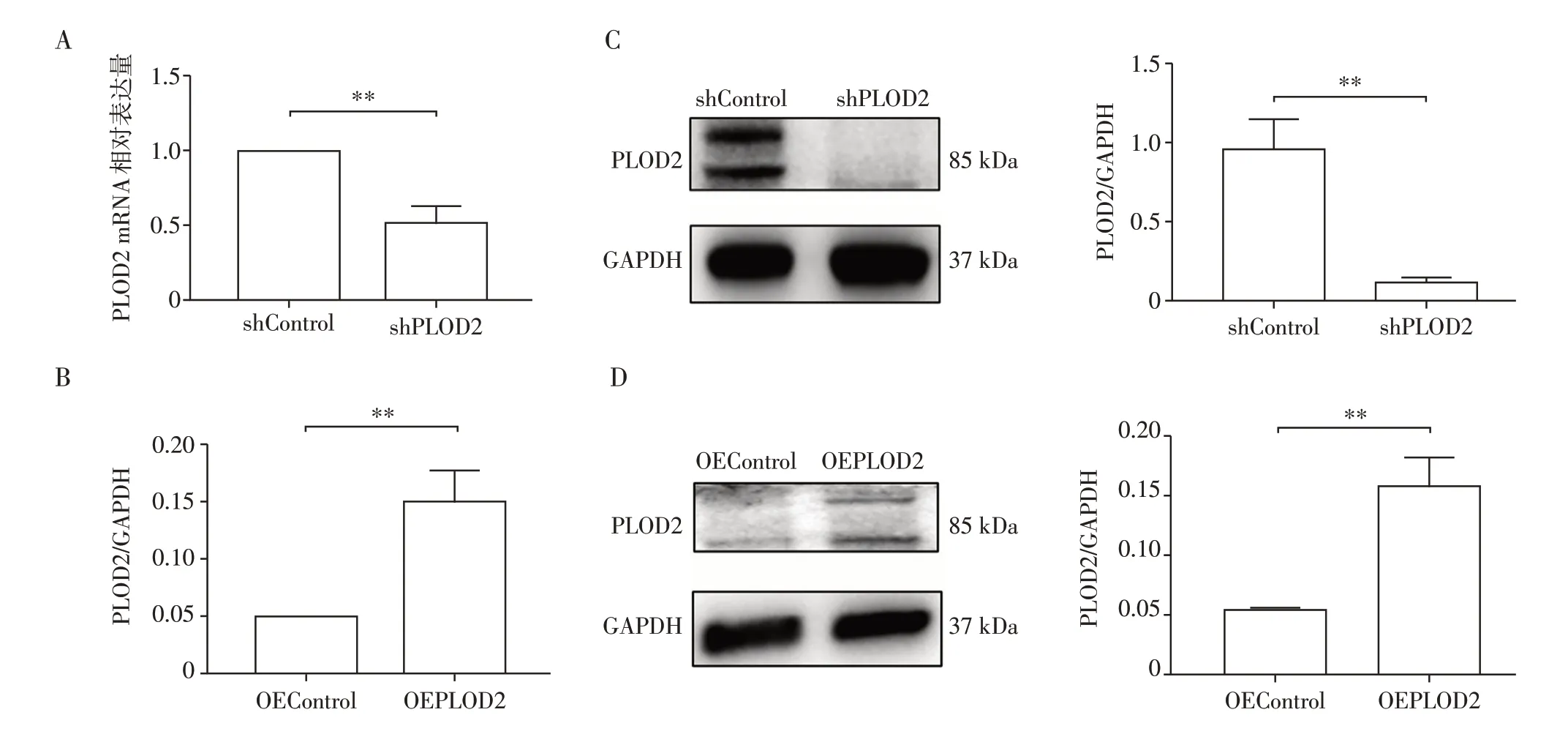
图3 PLOD2质粒的干扰和过表达效率Figure 3 Efficiencies of interference of shPLOD2 and overexpression of OEPLOD2
2.5 CCK-8 法检测PLOD2 干扰或过表达对奥沙利铂作用下卵巢癌细胞增殖抑制的影响
结果显示,在奥沙利铂相同药物浓度作用条件下,shPLOD2 组细胞较shControl 组增殖抑制能力增强(图4A),半数抑制浓度IC50由(1.444 ± 0.149)μmol/L 下降至(0.536±0.026)μmol/L(P<0.001)。同时,OEPLOD2 组细胞较OEControl 组增殖抑制能力减弱(图4B),IC50由(0.890 ± 0.048)μmol/L 升高至(4.341±0.289)μmol/L(P<0.001)。
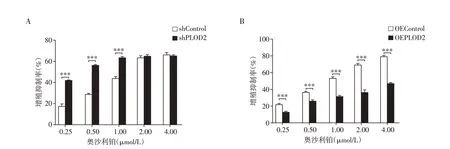
图4 CCK-8实验检测奥沙利铂作用下的卵巢癌细胞增殖抑制Figure 4 Proliferation inhibitions under Oxaliplatin treatment of ovarian cancer cells were detected by CCK-8 assay
2.6 克隆形成试验检测PLOD2 干扰或过表达对奥沙利铂作用下卵巢癌细胞增殖的影响
结果显示,在奥沙利铂处理条件下,shPLOD2细胞较shControl 细胞集落形成明显减少,分别为(19±3)个和(41±4)个(P<0.01,图5A),OEPLOD2细胞较OEControl 细胞集落形成明显增加,分别为(31±4)个和(12±3)个(P<0.01,图5B)。而在无奥沙利铂处理条件下,PLOD2干扰或过表达对卵巢癌细胞克隆形成能力的影响无统计学差异(P>0.05,图5)。
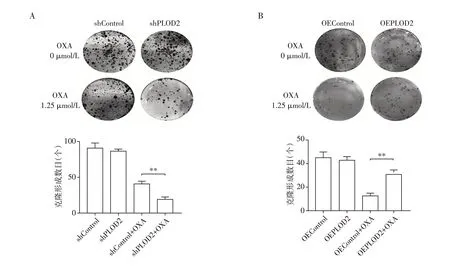
图5 克隆形成实验检测PLOD2对奥沙利铂作用下卵巢癌细胞增殖的影响Figure 5 Effects of PLOD2 on proliferation under oxaliplatin treatment in ovarian cancer cells were detected by clone formation assay
2.7 流式细胞术检测PLOD2 干扰或过表达对奥沙利铂作用下卵巢癌细胞凋亡的影响
采用流式细胞术检测shPLOD2 组、shControl组、OEPLOD2组、OEControl组在PLOD2干扰或过表达条件下的细胞凋亡率。结果显示,在无奥沙利铂作用条件下,shPLOD2 组和shControl 组、OEPLOD2组和OEControl 组细胞凋亡率无统计学差异(P>0.05,图6A、B)。在奥沙利铂作用条件下,shPLOD2组比shControl 组细胞凋亡率有显著上升,分别为(28.14±3.73)%和(16.25±2.98)%(P<0.01,图6A、C),OEPLOD2 组比OEControl 组细胞凋亡率有显著下降,分别为(23.85±0.94)%和(40.55±1.52)%(P<0.001,图6B、D)。
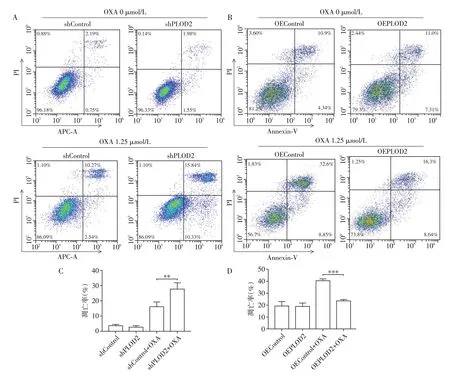
图6 流式细胞术检测PLOD2对奥沙利铂作用下的卵巢癌细胞凋亡的影响Figure 6 Effects of PLOD2 on cell apoptosis under oxaliplatin treatment in ovarian cancer cells were detected by flow cytometry
2.8 PLOD2干扰对A2780细胞裸鼠成瘤的影响
检测各组裸鼠肿瘤大小和瘤重并记录生长曲线,在未用奥沙利铂的条件下,shPLOD2 组肿瘤相较于shControl 组,肿瘤平均体积和瘤重无统计学差异(P>0.05,图7A、B、C)。在奥沙利铂处理条件下,shPLOD2 组的平均体积小于shControl 组(P<0.05,图7A、C),瘤重低于shControl组(P<0.05,图7B)。
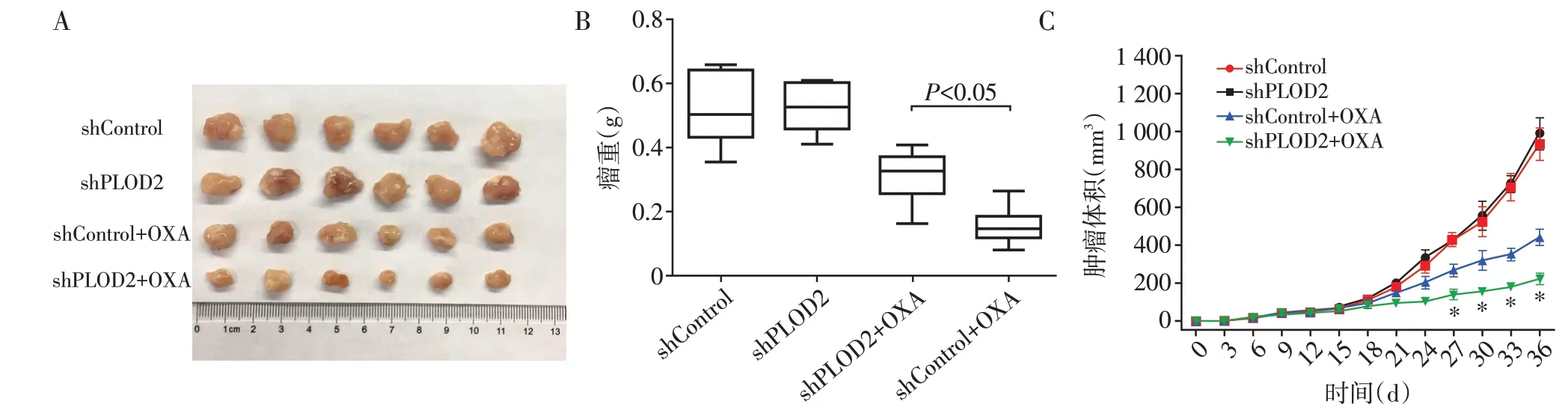
图7 PLOD2干扰对奥沙利铂作用下的卵巢癌细胞裸鼠成瘤能力的影响Figure 7 Effects of knockdown of PLOD2 on the tumorigenic ability of nude mice under oxaliplatin treatment of ovarian cancer cells
2.9 PLOD2 干扰或过表达对卵巢癌细胞BCRP、MRP1表达的影响
采 用qRT-PCR 和Western blot 检 测BCRP、MRP1在各组细胞中的表达,结果显示,shPLOD2组BCRP 和MRP1 mRNA 表达较shControl 组明显下调(P<0.05,P<0.001,图8A);BCRP、MRP1蛋白表达均明显下调(P=0.001,P<0.05,图8E)。OEPLOD2组BCRP 和MRP1 mRNA 表达较OECcontrol 组明显上调(P均<0.01,图8B);BCRP 和MRP1 蛋白表达明显升高(P<0.01,P<0.001,图8F)。

图8 PLOD2对奥沙利铂作用下的卵巢癌细胞BCRP、MRP1表达水平的影响Figure 8 Effects of PLOD2 on BCRP,MRP1 expresssions of ovarian cancer cells under oxaliplatin treatment
3 讨论
奥沙利铂等铂类药物已被广泛应用于治疗卵巢癌等实体肿瘤。然而,其疗效往往因癌细胞耐药性的发展而受到影响。耐药性机制主要包括:DNA损伤修复能力增强、药物蓄积减少、解毒功能增强、细胞凋亡抑制增强、基因突变、肿瘤微环境等[8-9]。对化疗耐药机制的研究,有助于为抗癌新药研发和化疗方案的优化提供新的见解。
PLOD2 是一种在人体组织中广泛表达的内质网膜结合蛋白,能使得前胶原分子螺旋区和端肽区的赖氨酸残基羟基化进而促进胶原交联的形成[10]。PLOD2 表达可通过TGFβ1/Smad3 信号通路促进肺纤维化,而米诺地尔作为PLOD2抑制剂可抑制这一过程的进展[11]。此外,PLOD2被证实与多种肿瘤的发展有密切关系,包括乳腺癌、肝癌、非小细胞肺癌等[4-6]。PLOD2 与乳腺癌、肝细胞癌、非小细胞肺癌的不良预后呈正相关。PLOD2 可通过直接和间接方式促进非小细胞肺癌转移[6]。PLOD2通过作用于胶原纤维的形态改变,有助于形成肿瘤转移的“高速公路”[12]。另外有报道称,PLOD2与化疗耐药有关[13-15]。
研究证实PLOD2 可增强胆管癌对吉西他滨的耐药性,通过上调PLOD2 的表达,耐药细胞株的上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白N-cadherin、Snail、Vimentin 表达上调[13]。同时,有研究结果也表明,PLOD2 的表达与胃癌细胞氟尿嘧啶(fluorouracil,5-FU)的化疗耐药性密切相关,其作用机制可能与通过上调BCRP 药转蛋白和下调凋亡相关蛋白Bax、上调Bcl-2 的表达相关[14]。除此之外,PLOD2可能通过促进EMT相关蛋白的表达,激活FAK-PI3K/AKT 以及MAPK 信号通路诱导奥希替尼耐药[15]。但是关于PLOD2 在卵巢癌奥沙利铂耐药中的作用,目前知之甚少。
本文选择卵巢癌PLOD2 高表达细胞株A2780和低表达细胞株OV1063,通过慢病毒转染shPLOD2和OEPLOD2 质粒,探讨PLOD2 对卵巢癌奥沙利铂化疗耐药的影响及机制。结果显示,干扰组细胞中PLOD2的mRNA 和蛋白表达显著下降,而过表达组PLOD2的mRNA 和蛋白表达显著升高,表明已成功构建了卵巢癌干扰和过表达的稳转株shPLOD2-A2780和OEPLOD2-OV1063。
CCK-8 实验证实,在奥沙利铂相同浓度作用条件下,shPLOD2 组细胞增殖抑制率高于shControl组,IC50较shControl 组下降;OEPLOD2 组细胞增殖抑制率低于OEControl组,IC50较OEControl升高。后续实验根据两种细胞株的IC50,选取1.25 μmol/L 为奥沙利铂实验浓度。克隆形成和细胞凋亡实验证实,在奥沙利铂处理条件下,shPLOD2细胞比shControl细胞集落形成减少,细胞凋亡率增高;OEPLOD2细胞比OEControl细胞集落形成能力增强,细胞凋亡率降低。这些结果表明,PLOD2对在奥沙利铂作用下的卵巢癌细胞有促进增殖和抑制凋亡的作用。值得注意的是,在无奥沙利铂作用条件下,shPLOD2组与shControl 组克隆形成能力、凋亡率无统计学差异,这一点在OEPLOD2 和OEControl 细胞株上也得到了验证。通过将shPLOD2 细胞和shControl 细胞接种到裸鼠皮下,发现在奥沙利铂处理条件下,shPLOD2 组的肿瘤体积和瘤重均小于shControl组。上述研究结果提示,PLOD2可增强奥沙利铂诱导的卵巢癌细胞的耐药性。据已有报道,PLOD2可促进结肠癌的增殖[16],但对非小细胞肺癌和胶质瘤、肉瘤的增殖没有影响[6,17-18],同时对胃癌的凋亡也没有影响[14],这说明PLOD2在不同的肿瘤中所发挥的作用是有差异的。
ATP 结合盒转运蛋白,主要成员为ABCB1P 糖蛋白(P-glycoprotein,P-gp)、ABCC1(MRP1)、ABCG2(BCRP)[19]。三者被认为是肿瘤化疗耐药性的重要调控因子,其导致耐药性的增强主要是通过药物泵出细胞膜,使得细胞内化疗药物浓度降低而实现的。据报道,MRP1 参与了奥沙利铂对结直肠癌的耐药[20]。MRP1 和BCRP 在上皮性卵巢癌组织中的表达量显著增加,MRP1 和BCRP 表达量的增加可能与化疗耐药有关,影响患者疗效和预后[21]。更为直接的证据是,在一项研究中发现MRP1 介导了卵巢癌奥沙利铂耐药细胞株的多药耐药[22]。同时也有报道称,BCRP 和MRP1 参与了卵巢癌对顺铂的耐药[23]。
奥沙利铂作为第三代铂类化疗药,同时也是卵巢癌化疗的一线用药,其治疗效果受药转蛋白的影响。本文已证实PLOD2 可增强卵巢癌细胞对奥沙利铂的耐药性,进而推测PLOD2可能与药转蛋白的表达有密切关系。qRT-PCR 和Western blot 实验结果发现干扰PLOD2 表达,其BCRP、MRP1 mRNA 和蛋白表达水平下调,同时在过表达OEPLOD2 细胞株,BCRP、MRP1 mRNA 和蛋白表达上调。本研究结果提示PLOD2 可能通过上调药转蛋白BCRP、MRP1 的表达,而促使卵巢癌对奥沙利铂的耐药性增强。
综上所述,本研究通过构建PLOD2干扰和过表达质粒转染卵巢癌高表达和低表达细胞株,研究PLOD2 对卵巢癌奥沙利铂化疗耐药的影响及机制。研究结果提示PLOD2 可增强卵巢癌对奥沙利铂的化疗耐药性,这一作用可能与药转蛋白BCRP和MRP1 表达上调有关。本研究为探索PLOD2 在奥沙利铂诱导的卵巢癌耐药中的作用提供了新视角,进一步为逆转卵巢癌化疗耐药提供了新的理论基础。

