负载抗菌多肽温敏水凝胶的制备及性能研究
吴 迪,王 萍,雷 晨,吴 维,马珊珊,汤春波
南京医科大学附属口腔医院口腔种植科,江苏省口腔疾病研究重点实验室,江苏省口腔转化医学工程研究中心,江苏 南京
210029
水凝胶是一种基于亲水性聚合物的交联网络,可通过亲水性高分子化学交联或物理交联相互作用形成。因具有独特的水溶胀行为(在水中溶胀而不溶解)以及良好的生物相容性[1],水凝胶逐渐成为一种新兴的医用创面敷料。同传统敷料相比,水凝胶能够吸收组织渗出物,保持创面湿润,可避免在更换敷料时发生黏连[2]。此外,通过功能整合或结构设计,水凝胶可被赋予各种优异的性能,如通过负载抗菌多肽(antimicrobial peptide,AMP)等抗菌材料来实现高效抗菌,搭载生长因子或抗炎药物来缓解炎症等,进而在创面愈合过程中发挥关键作用[3]。透明质酸(hyaluronic acid,HA)作为一种聚阴离子线性黏多糖,因其具有独特的生物相容性、保水性和流变特性而被用于制造水凝胶[4-5],然而,由于HA良好的亲水性,如果单独作为药物载体,则易快速降解和扩散,因此,通常对HA进行交联以获得稳定性更好的水凝胶[6-7]。
羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)是一种纤维素衍生的温敏性亲水聚合物,由于其具有无毒、低成本、高溶胀性和表面活性等优越性能,已被作为辅料广泛应用于膜剂、片剂、软膏等药品中[8]。更重要的是,HPMC 具备温敏特性,基于HPMC 的水凝胶能够根据环境温度的变化发生溶胶-凝胶相转变[9],因此有利于临床上微创给药和填充不规则的皮肤缺损。尽管HPMC自身的相转变温度远高于体温(60 ℃以上),但可通过添加一些盐类或小分子醇调节其相转变温度[10]。甘油作为一种多元醇,可以通过从聚合物链的水合鞘中去除水分来降低HPMC体系的相转变温度[11]。
本文以HA、HPMC和甘油为水凝胶基材制备温敏水凝胶,将抗菌多肽-芬母多肽(Funme peptide,FP)作为核心抗菌成分进行包载,通过研究其理化性能、生物相容性和抗菌性能,以及对小鼠皮肤创面愈合的作用,为后期将该温敏水凝胶用于医用创伤敷料奠定研究基础。
1 材料和方法
1.1 材料
HPMC(甲氧基:28%~30%,羟基:7%~12%,6 mPa·s)上海凛恩科技发展有限公司;HA(分子量100 000~200 000),上海麦克林生化科技有限公司;FP(纯度>95%),江苏吉锐生物技术有限公司;其他试剂均为分析纯。
实验中使用的小鼠上皮样成纤维细胞(L929)和大肠杆菌(ATCC25922)来自江苏省口腔疾病研究重点实验室样本库。SPF 级6 周龄Balb/c 小鼠,雄性,18~20 g,购自南京医科大学繁育中心,生产许可证:SCXK(苏)2021-0001。本实验符合3R原则并通过了南京医科大学实验动物福利伦理委员会审查,项目伦理审查批准号:IACUC-2011056。
1.2 方法
1.2.1 温敏水凝胶的制备
取所需体积的去离子水加热至80 ℃,加入HPMC 粉末,混匀后持续搅拌30 min,在4 ℃下静置过夜,得到7%(W/V)的HPMC 溶液。在室温下通过去离子水溶解HA 来制备HA 溶液,并用0.22 μm 的滤菌器过滤灭菌。将HA与HPMC 溶液以不同比例混合并搅拌均匀,在4 ℃下平衡24 h,得到HA/HPMC水凝胶前体溶液。再向溶液中逐滴滴加一定量的甘油,缓慢搅拌至均匀,得到一系列不同配比的HA/HPMC/甘油温敏水凝胶。
1.2.2 水凝胶的凝胶化温度(gelation temperature,Tgel)及凝胶时间的测定
使用“试管倒置法”[12]研究样品的Tgel及凝胶时间。取配制好的样品于玻璃试管中,置于恒温水浴锅中,每隔10 min 取出试管,将其倒置以观察水凝胶是否流动,如果流动则以1 ℃的速率继续升温,若不流动则将此温度定义为水凝胶的Tgel[13]。确定Tgel后,在37 ℃下测量各组水凝胶的凝胶时间,凝胶时间记为各组样品不流动的时间点。以人体生理温度为评价指标,筛选出水凝胶的最佳配比。
1.2.3 流变性能测试
采用HAAKE MARS4 流变仪对最佳配比下的HA/HPMC/甘油体系进行流变性能的检测。取适量溶液放置在直径为40 mm、间隙为0.5 mm 的平行板上,温度范围设定为20~80 ℃。在逐步加热过程中测定水凝胶的储能模量(storage modulus,G′)和损耗模量(loss modulus,G″)与温度之间的关系。
1.2.4 红外光谱表征
傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)通过表征化合物之间可能的键类型来评估水凝胶的成分。将最佳配比下的HA/HPMC/甘油水凝胶干燥后研磨成细粉,再与溴化钾(KBr)混合制成研磨压片,利用红外光谱仪测试并记录样品的红外光谱,测试波数范围为500~4 000 cm-1,分辨率为4 cm-1。
1.2.5 水凝胶的微观结构表征
通过扫描电子显微镜(scanning electron microscope,SEM)观察水凝胶的内部结构和形貌特征。将最佳配比下的HA/HPMC/甘油水凝胶放在37 ℃的水浴锅中使其凝胶化,随后进行冷冻、干燥、喷金处理,并在加速电压为5 kV的条件下观察水凝胶横截面的形态结构。
1.2.6 细胞毒性检测
将0.05%(W/V)FP 包载到最佳配比下的HA/HPMC/甘油体系中,得到HA/HPMC/甘油-FP温敏水凝胶,取1 mL 最佳配比下的HA/HPMC/甘油水凝胶和HA/HPMC/甘油-FP 水凝胶分别加到10 mL 含有10%胎牛血清和1%青霉素/链霉素的DMEM培养基中,37 ℃孵育24 h 得到水凝胶浸提液。将L929 以1×104个/mL的密度接种到96孔板中,在含有体积分数5%CO2的37 ℃培养箱中培养12 h至细胞完全贴壁。吸弃各组培养基,实验组分别加入HA/HPMC/甘油水凝胶浸提液和HA/HPMC/甘油-FP 水凝胶浸提液,对照组加入DMEM完全培养基,每组设置6个平行孔。在第1、3、5 天时取出培养板,每孔加入10 μL CCK-8 溶液(CCK-8 试剂盒,Dojindo 公司,日本),37 ℃避光孵育2 h。用酶标仪在450 nm波长下测量吸光度。
1.2.7 体外抗菌性能测试
细菌生长曲线:取1×106CFU/mL 的大肠杆菌(Escherichia coli,E.coli)悬液150 μL加至试管中,同时分别加入150 μL Luria-Bertani(LB)液体培养基(对照组)以及最佳配比下的HA/HPMC/甘油水凝胶和HA/HPMC/甘油-FP 水凝胶,充分混匀后在37 ℃下以100 r/min的转速下共培养48 h,并分别于0、2、4、8、12、24、48 h 时用酶标仪测定各组在600 nm 波长处的吸光度值。以吸光度值为纵坐标,培养时间为横坐标,绘制各组E.coli的生长曲线。
活/死细菌染色:各取200 μL最佳配比下的HA/HPMC/甘油水凝胶和HA/HPMC/甘油-FP 水凝胶加入24孔板中,在37 ℃无菌培养箱中使其凝胶化,各组水凝胶分别加入200 μL 浓度为1.0×106CFU/mL的E.coli悬液,在37 ℃下共培养24 h,对照组为含有LB 液体培养基的E.coli悬液。24 h 后,实验组和对照组分别加入LIVE/DEAD BacLight染色液(Invitrogen公司,美国),避光孵育15 min 后,通过激光共聚焦显微镜观察荧光图像,并计算各处理组死细菌和活细菌的荧光强度。
1.2.8 小鼠皮肤创面愈合率的检测
将Balb/c 小鼠随机分为3 组,每组5 只,分别为对照组(PBS 溶液)、最佳配比下的HA/HPMC/甘油组和HA/HPMC/甘油-FP 组。将小鼠用1%戊巴比妥钠腹腔麻醉后,背部脱毛、温生理盐水冲洗、拭干,碘酊消毒,在小鼠背部剪去直径约1 cm 的全层皮肤,制备创伤模型。将100 μL 溶于生理盐水中的E.coli(1×106CFU/mL)接种于皮肤创口上。感染1 d 后,取对照组及各实验组溶液200 μL置于背部创面,分别于创伤后的第0、5、10、15 天观察并记录创面愈合面积及愈合时间,根据以下公式计算创伤愈合率,并评估创面愈合速度。创面愈合率=(初始创面面积-创面愈合后面积)/初始创面面积×100%。
1.3 统计学方法
使用SPSS 21.0统计软件对数据进行统计分析,计量数据以均数±标准差()表示,采用单因素方差分析对多组间样本均数进行比较,P<0.05 为差异有统计学意义。
2 结果
2.1 水凝胶的Tgel及凝胶时间检测
制备含有不同含量HA 和甘油的水凝胶体系,采用试管倒置法研究HA/HPMC/甘油体系的相转变行为,评估并选择溶胶-凝胶转变温度为37 ℃左右(人体生理温度)的最佳配比水凝胶。如表1 所示,随着甘油含量的增加,溶液的Tgel显著下降,并且含有2% HA 的水凝胶组Tgel低于含有1% HA 的水凝胶组。甘油含量低于20%的样品,其Tgel均在40 ℃以上,远高于体温,HA2/HPMC7/甘油25组为29 ℃,在室温下即可发生凝胶化,不利于注射给药。尽管HA1/HPMC7/甘油20组的Tgel为39 ℃,接近体温,但HA1/HPMC7/甘油25和HA2/HPMC7/甘油20组则更理想为35 ℃。考虑到HA2/HPMC7/甘油20的凝胶时间要短于HA1/HPMC7/甘油25,最终选择了HA2/HPMC7/甘油20组为最佳配比。如图1所示,HA2/HPMC7/甘油20水凝胶在常温下为可流动的溶液状,而在加热到37 ℃后则转变为不可流动的凝胶。

图1 HA2/HPMC7/甘油20水凝胶在凝胶化前后的状态Figure 1 Form of HA2/HPMC7/Glycerol20 before and after gelation
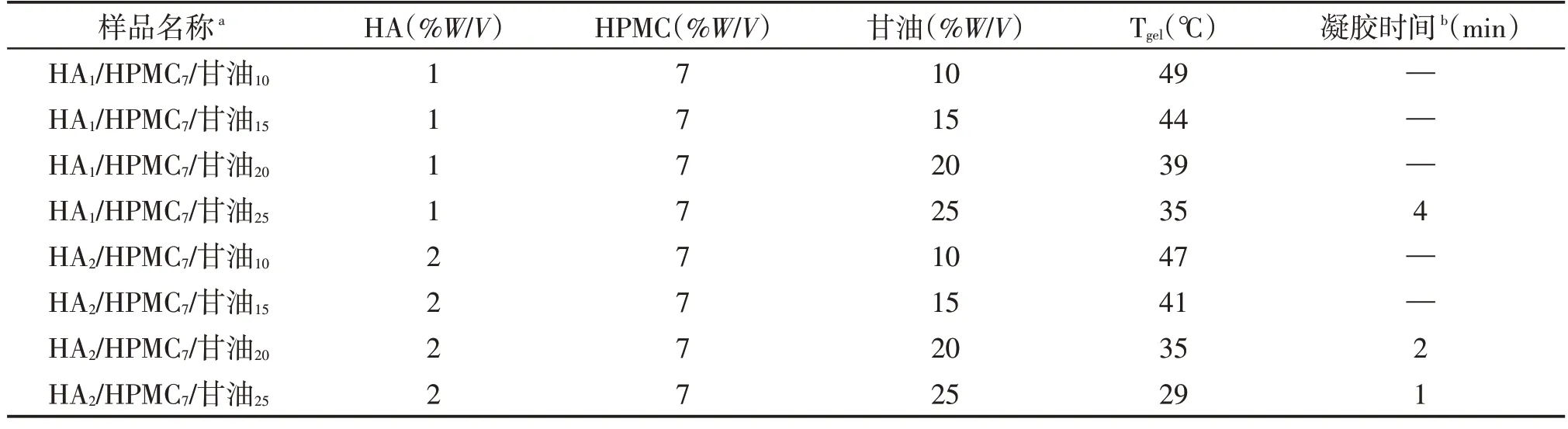
表1 样品的Tgel和凝胶时间Table 1 Tgel and gelation time of formulations
2.2 流变性能检测
为了验证水凝胶内部的溶胶-凝胶相转变行为,通过流变仪检测了HA2/HPMC7/甘油20水凝胶黏弹性参数随温度的变化。从图2 中可以看出,在温度升高的初始阶段,该体系的G′和G″都较低,且G′曲线低于G″,随着温度升高,G′的增长明显快于G″,并在33 ℃左右超过G″。G′和G″的交点对应的温度即为溶胶-凝胶相转变温度,表明此时水凝胶从溶胶状态转变为凝胶状态。
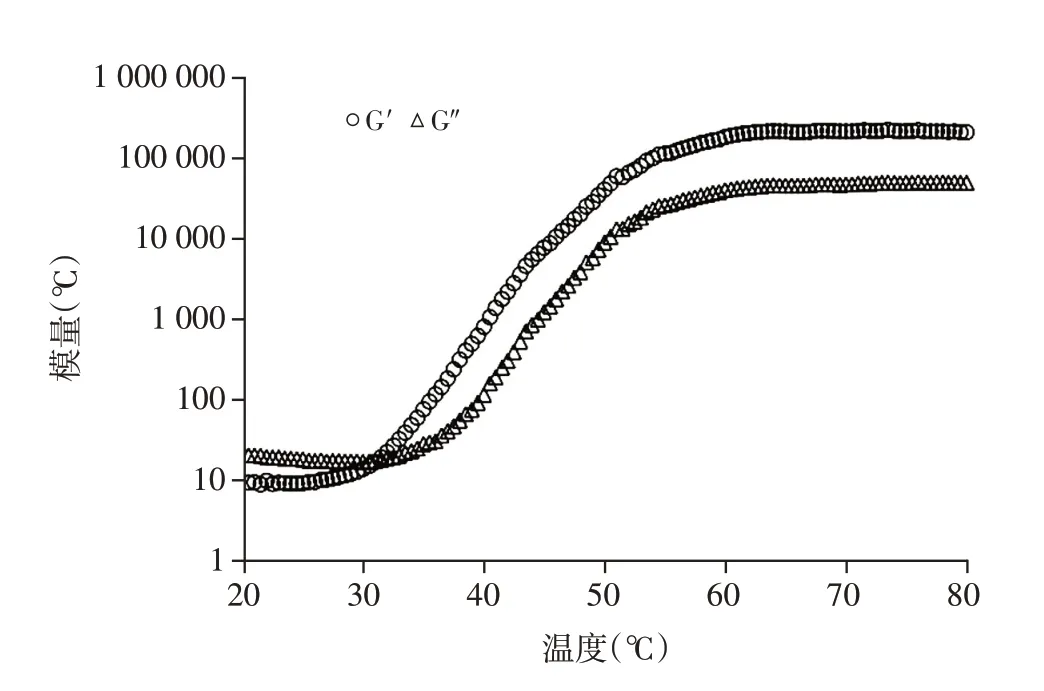
图2 HA2/HPMC7/甘油20的G′和G″随温度的变化Figure 2 G′and G″of the HA2/HPMC7/Glycerol20 as function of temperature
2.3 红外光谱分析
图3 为HA、HPMC、甘油、HA2/HPMC7/甘油0和HA2/HPMC7/甘油20的红外光谱。其中,除甘油外的4 个样品都观察到3 000~3 600 cm-1之间的吸收带,主要对应O—H的伸缩振动。纯HA样品在2 921和2 855 cm-1的吸收带是C—H 的伸缩振动峰,在1 620 cm-1处的吸收带是C=O伸缩振动吸收峰,在1 455和1 373 cm-1处为C—H弯曲振动峰,在1 252 cm-1处为C—OH伸缩振动峰,在1 157和1 044 cm-1处为C—O—C伸缩振动峰。由于C—H伸缩振动、C=O伸缩振动和C—H 弯曲震动,纯HPMC 样品的特征峰分别出现在2 920、1 638 和1 459 cm-1。此外,HPMC 在1 115 和1 068 cm-1处显示出吸收峰,主要对应C—O—C 的伸缩振动。甘油在3 200~3 500 cm-1处为—OH 的伸缩振动;2 700~3 000 cm-1附近主要为—CH2—伸缩振动和—CH3的伸缩振动;1 300~1 500 cm-1附近主要为—CH3对称变角及反对称变角振动;994~1 115.8 cm-1处为C—O 伸缩振动吸收峰;1 200 cm-1以下主要为C—O 键的伸缩振动区域。当HA 与HPMC 混合后,HA 和HPMC 的特征峰在HA2/HPMC7甘油0聚合物的光谱图上都保留了下来,仅伴随少量偏移,而在甘油加入后,HA2/HPMC7/甘油20的光谱在3 200~3 500 cm-1处出现多个—OH 的伸缩振动峰,其余波段处与HA2/HPMC7/甘油0基本一致。
2.4 水凝胶的形貌结构
HA2/HPMC7/甘油20的内部形貌结构如图4 所示,水凝胶显示出均匀的三维网络支架结构,孔壁光滑,孔径分布均匀,主要分布在5~10 μm之间。

图4 HA2/HPMC7/甘油20的微观形貌结构(×6 000)Figure 4 The micromorphology of HA2/HPMC7/Glycerol20(×6 000)
2.5 细胞毒性分析
CCK-8 定量分析结果显示,随着培养时间的延长,各组细胞的增殖均呈上升趋势。在第3 天和第5 天时,相较于使用DEME完全培养基的对照组,经过HA2/HPMC7/甘油20和HA2/HPMC7/甘油20-FP 处理的细胞增殖率稍增高,但与使用正常培养基的对照组比较,差异无统计学意义(P>0.05,n=6)。

图5 第1、3、5天CCK-8实验结果Figure 5 The results of CCK-8 at day 1,3,5
2.6 抗菌性能分析
采用E.coli对水凝胶抗菌性能进行研究。通过检测细菌生长曲线初步评价HA2/HPMC7/甘油20-FP的抗菌效果,如图6 所示,不含FP 的水凝胶组和空白对照组的E.coli在0~8 h 内生长曲线平坦,8 h 后进入对数生长期,24 h 后进入稳定生长期,这说明HA2/HPMC7/甘油20水凝胶本身基本不具备抑菌作用。而含有FP的水凝胶组曲线始终较平坦,表明细菌在48 h 内几乎没有生长,这也说明由于FP 的加入,HA2/HPMC7/甘油20-FP水凝胶产生了良好的抗菌效果。
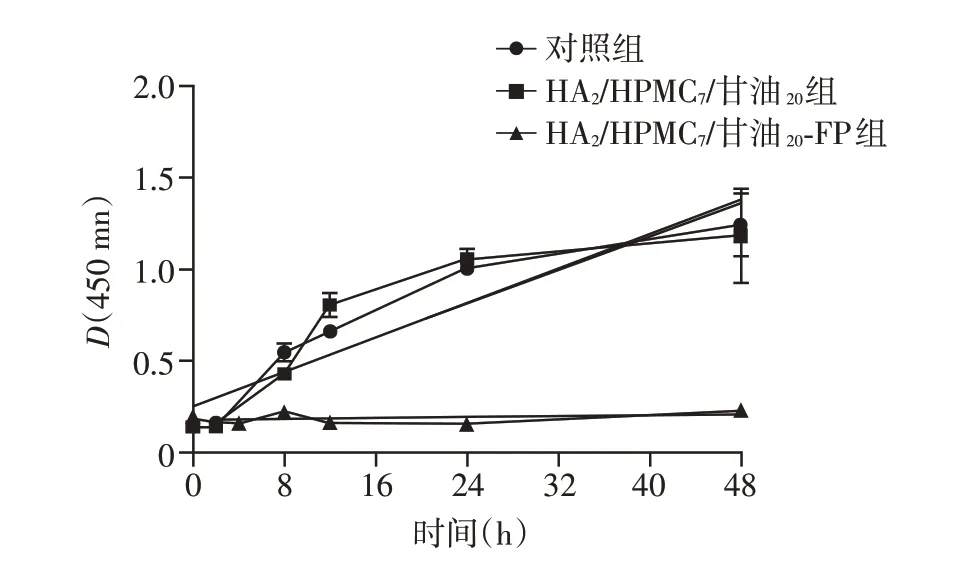
图6 水凝胶对E.coli生长的影响Figure 6 The effects of hydrogels on the bacterial growth of E.coli
E.coli与不同样品共培养24 h后进行活/死细菌染色,结果如图7 所示,活细菌呈现绿色荧光,而死细菌呈现红色荧光。同空白组一样,不含FP的HA2/HPMC7/甘油20水凝胶组观察到较多绿色荧光的点状分布,几乎没有红色荧光,说明水凝胶本身不具备显著的抑菌作用。相反,在搭载FP 的HA2/HPMC7/甘油20水凝胶组观察到强烈的红色荧光(P<0.001),表明FP的加入对E.coli具有明显的抑菌效果,也进一步证实了上述结果。

图7 活/死细菌荧光染色图以及荧光强度的定量分析Figure 7 Live/dead bacterial staining of E.coli and quantitative analysis of fluorescence intensity
2.7 创伤修复
如图8所示,在伤口形成的第5天,各组小鼠伤口表面已干燥结痂;第10 天时,各组创面进一步收缩,痂皮出现不同程度的脱落,HA2/HPMC7/甘油20-FP组的脱痂速度快于其他组;第15天时,各组创面已全部脱痂,出现不同程度的新生上皮。在整个愈合过程中,对照组、HA2/HPMC7/甘油20组和HA2/HPMC7/甘油20-FP组的剩余创面面积依次减小,其中HA2/HPMC7/甘油20-FP组创面面积明显小于其他组,创伤愈合速度更快。通过比较各组间的创面愈合率可见,在整个愈合过程中,对照组的愈合率显著低于HA2/HPMC7/甘油20组(P<0.05,P<0.01)和HA2/HPMC7/甘油20-FP 组(P<0.01,P<0.001),HA2/HPMC7/甘油20-FP 组的愈合率虽然高于HA2/HPMC7/甘油20组,但差异无统计学意义(P>0.05),因此,HA2/HPMC7/甘油20-FP 水凝胶具有良好的促进伤口愈合的效果。

图8 水凝胶对小鼠皮肤创面愈合的影响Figure 8 The effects of hydrogels on the healing of skin wounds in mice
3 讨论
临床上,由于皮肤伤口的轮廓和形状往往不规则,传统的敷料通常不能完全填充并附着于伤口表面[14],而温敏水凝胶作为新型医用伤口敷料,在室温下能够保持可流动的溶胶状态以方便给药,在达到人体生理温度后能够迅速转变成不可流动的凝胶,以维持药效。为了实现这一目标,本研究的第一步就是制备在37 ℃下能够快速发生溶胶-凝胶相转变的温敏水凝胶。试管倒置法结果显示,随着HA和甘油含量的增加,Tgel均呈下降趋势,同时凝胶化速度加快,在HA 和甘油的含量分别达到2%和20%时,水凝胶能够在35 ℃下更快发生凝胶化。HA和甘油对水凝胶Tgel的影响可能是它们与HPMC竞争水分子的结果。作为主要的温敏成分,在低温时,HPMC的亲水基团与水分子相互作用产生氢键,氢键将HPMC 包围形成一个类似“笼状”的结构,此时体系为可流动的溶胶状态;随着温度的增加,氢键吸收热量逐渐断裂,“笼状结构”被破坏,内部的疏水基团暴露并聚集在一起,从而形成水凝胶析出[15]。由于甘油比HPMC 对水的亲和力更大,甘油浓度的增加减少了与HPMC 结合的水分子,因此用于断裂HPMC 分子上的氢键所需的热量减少,凝胶温度降低[11]。而HA 由于具有独特的流变学特性,在溶液中,其长分子链交织形成无规则的卷曲柱状结构,这种柱状结构的内侧含有大量羟基,羟基也可与水分子结合形成氢键,从而进一步加速了HPMC 分子的去水化,降低了溶胶-凝胶转变温度[16-17]。在确定了水凝胶的最佳配比后,采用流变仪分析了HA2/HPMC7/甘油20水凝胶的G′和G″与温度的关系。在起始阶段,G″占主导地位,此时体系表现出与溶胶状态相对应的黏性流体行为,随着温度升高,G′超过G″,两条曲线相交,表明体系从溶胶状态转变为凝胶状态。在凝胶点之后,G′的增长速度明显快于G″,此时该体系表现出以弹性占主导地位的凝胶状态[18],表明HA2/HPMC7/甘油20水凝胶具有稳定的温敏特性。
一般来说,通过化学交联产生的水凝胶往往具备更稳定的理化性能,但化学交联需要加入一些催化剂和有机溶剂,容易产生细胞毒性[19]。红外光谱可通过监测化合物分子间的相互作用和可能的键类型来分析是否有化学反应发生[20]。HPMC 和HA 的主要官能团为—COOH 和—OH,若发生反应则会形成酯键[21],从而在1 000~1 200 cm-1形成新的C—O—C 吸收峰,但对比样品的红外光谱图,HA2/HPMC7/甘油0并未在该波段形成新的吸收峰,其主要变化是原有吸收峰位的偏移,即1 068 cm-1→1 063 cm-1。这是由于含—OH的纤维素中会自发形成氢键,从而影响C—O—C在此处的吸收峰位和峰形。在加入甘油后,可见HA2/HPMC7/甘油20的光谱相比HA2/HPMC7/甘油0在3 200~3 500 cm-1处出现多个—OH 的伸缩振动峰,与甘油在此波段的图谱相似,此处主要体现了甘油羟基官能团的振动特征,且对比甘油原料来看,产物中—OH 峰的强度并未发生明显改变,说明—OH 并未参与反应。因此可以确定HA2/HPMC7/甘油20温敏水凝胶的混合过程为物理交联。
良好的生物相容性和抗菌性能是温敏水凝胶敷料在临床应用中必备的特征,CCK-8 结果显示HA2/HPMC7/甘油20-FP水凝胶对L929细胞没有毒性,主要得益于HA 良好的生物相容性。HA 广泛存在于结缔组织的细胞外基质中,在维持组织构造方面发挥着重要作用[18]。此外,HA 还能够被特定的细胞受体识别,从而调节细胞增殖、分化,调控免疫反应、血管生成和组织愈合过程等[22]。细菌生长曲线和活/死细菌染色结果显示,在搭载了FP 后,HA2/HPMC7/甘油20水凝胶对E.coli显示出明显的抗菌效果,这主要归因于FP优异的抗菌性能[23-24]。由于FP表面带正电荷,而微生物膜表面为负电荷,因此FP能够通过静电作用吸附到细菌细胞膜表面,这是其抗菌作用的第一步[25],当达到一定的阈值浓度后,FP 能够渗透细菌细胞膜,并与基因组的DNA 结合来抑制细菌DNA 的合成,从而起到抗菌抑菌的作用[23]。在小鼠全层皮肤缺损模型中,我们进一步评估了水凝胶促进创伤愈合的效果。结果显示,相较于对照组而言,HA2/HPMC7/甘油20-FP水凝胶显示出了明显的创面修复和皮肤再生优势,这主要归因于FP 优异的抗菌性能和HA 的生物相容性的协同作用,以及水凝胶敷料为伤口提供的湿润环境[26]。
综上所述,HA2/HPMC7/甘油20-FP温敏水凝胶具有稳定的温敏性,多孔径的三维网络状结构和良好的生物相容性,对E.coli能够产生显著的抑菌作用,并且具有促进皮肤创伤修复的能力,提示HA2/HPMC7/甘油20-FP 温敏水凝胶可能在医用创伤敷料领域具有潜在优势。

