温度/超声双重响应型相变液滴对水凝胶结构性能的调控
赵 婵,刘 昊,陈洁莹,徐雪琴,胡 克,段 磊
南京医科大学生物医学工程系,江苏 南京 211166
相变液滴(phase-change droplet,PCD)是一种在微气泡研究基础上发展起来的具有液-气相变能力的诊疗一体化微纳材料[1],相变液滴使用具有低溶解度和扩散率的全氟化碳(perfluorocarbon,PFC)作为核心[2],使用白蛋白[3]、表面活性剂[4]、高分子聚合物[5]、脂质[6]等作为膜壳材料,在其膜壳内外可进一步装载药物、蛋白等活性物质或氧化铁、金等纳米材料,在外界温度、超声、磁场、激光等能量介导下,其内核PFC 可由液态转变为气态,从而引起相变液滴结构、尺寸、超声成像能力、释药能力等一系列的变化,赋予其“智能响应”能力。
水凝胶(hydrogel,Hy)是一类通过单体与亲水性基团的物理和化学交联,形成的三维网络结构聚合物[7],可用于药物释放、组织工程和生物学研究等,是良好的生物医用材料[8]。智能响应型水凝胶可以通过单体与交联方式等的改变实现其对pH[9]和温度[10]等的响应,进而实现逆体积转变或凝胶-溶胶转变等。但目前制备智能响应型水凝胶,大多对原材料性能要求较高、成本高、制造工艺相对复杂,且无法控制水凝胶的孔隙数量与尺度、无法引入治疗性气体;与此同时,提高其对外界响应的灵敏度和精准度也是一大挑战。
相变液滴与水凝胶的结合,为水凝胶的智能调控赋予了新的思路,将相变液滴作为中间媒介,通过外部能量场对液滴相转变阈值的精准、联合调控,间接影响水凝胶的结构与性能。这种新思路的优点在于:一方面,相变液滴本身即是一种优良的诊疗一体化载体材料,在增强超声成像、药物/基因可控传递、高/低强度聚焦超声引导下的肿瘤消融等方面极具潜力,相变液滴的引入不仅能赋予水凝胶以上诸多新功能,还可通过对相变液滴的结构设计实现对外界刺激的快速、精确、多重响应;另一方面,这种通过间接响应达到智能调控的思路,降低了对水凝胶单体和制备工艺的要求,且可引入气体、可控制水凝胶的孔隙数量与尺寸,对其结构和力学性能的调控将更加精准。相变液滴与水凝胶复合材料的研究近年来仍然较少报道,主要的研究有:作为细胞培养或组织工程支架,调控细胞的生长迁移或生长因子的释放[11-12];作为药物载体,进行局部药物递送等[13]。
基于以上思路,本研究以脂质作为膜壳材料,以全氟己烷(perfluorohexane,PFH)作为内核,制备出脂质相变液滴(lipid phase-change droplet,LPCD),探究其对温度或低强度聚焦超声(low intensity focused ultrasound,LIFU)的响应能力及相变前后的超声造影能力,并将其与光固化型水凝胶进行复合,构建脂质相变液滴-水凝胶复合材料(LPCD@Hy),研究温度或LIFU对LPCD@Hy结构、浮力、压缩和溶胀等力学性能的影响。
1 材料和方法
1.1 材料
1,2-二棕榈酰-sn-甘油-3-磷脂酰胆碱(1,2-dipalmitoyl-sn-glycerol-3-phosphatidylcholine,DPPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-羧基(distearoyl phosphatidylethanolamine polyethylene glycol carboxyl,DSPE-PEG-COOH)、全氟己烷(perfluorohexane,PFH)、聚乙二醇二丙烯酸酯[poly(ethylene glycol)diacrylate,PEGDA]和N,N’-亚甲基双丙烯酰胺[N,N’-methylenebis(acrylamide),BIS](上海阿拉丁控股集团有限公司);胆固醇(cholesterol)(上海赛默飞世尔科技中国有限公司);三氯甲烷和甲醇(上海国药集团化学试剂有限公司);磷酸盐缓冲液(phosphate buffered saline,PBS)(江苏凯基生物技术股份有限公司);苯基-2,4,6-三甲基苯甲酰基膦酸锂(lithium phenyl-2,4,6-trimethylbenzoyl phosphonate,LAP)(江阴司特易生物技术有限公司);细胞膜红色荧光探针(1,1’-dioctadecyl-3,3,3’,3’-tetramethylindocarbocyanine perchlorate,DiI)和细胞膜绿色荧光探针(3,3’-dioctadecyloxacarbocyanine,DiO)(上海碧云天生物科技有限公司)。
1.2 方法
1.2.1 LPCD的制备
采用薄膜水化法[14]制备LPCD,将DPPC、胆固醇和DSPE-PEG-COOH按照5∶1∶0.78质量比溶于有机溶剂中,溶剂由三氯甲烷和甲醇按照9∶1 的体积比配备而成,加入50 μL 1 mmol/L的DiI或DiO溶液(DiI 或DiO 染色LPCD)。40 ℃旋转蒸发仪(上海贤德实验仪器有限公司)旋转2 h 后,放入真空干燥箱中过夜,加入30 mL PBS 缓冲液旋转蒸发仪水化2 h。水化后加入300 μL PFH,使用超声波细胞破碎仪(南京先欧仪器制备有限公司)超声5 min,功率为130 W,得到LPCD。
1.2.2 LPCD的结构和粒径表征
使用光学显微镜(Life Technologies 公司,美国)和扫描电子显微镜(scanning electron microscope,SEM)(JEOL 公司,日本)观察LPCD 的形貌、大小及膜壳情况。使用粒度仪(Anton Paar 公司,奥地利)测定LPCD在常温下的粒径分布和zeta电位。
1.2.3 LPCD相变温度阈值的确定
使用粒度仪分别测定LPCD 在常温、56 ℃、60 ℃、66 ℃的粒径大小,分析其在核心PFH 相转变温度附近的粒径变化。并通过光学显微镜观察相转变前后的形貌变化。
1.2.4 超声对LPCD粒径的调控
制备与人体软组织声阻抗相似的体模,体模中有1个用于注入样品的孔洞,将样品注入体模后,使用低强度聚焦超声(low intensity focused ultrasound,LIFU)(深圳一粟医疗科技有限公司)经体模照射LPCD,观察LPCD液-气相变现象。超声探头距离样品约1 cm,超声频率为840 kHz,输出功率为7.3 W,脉冲重复周期为20 ms,脉冲持续时间为8 ms。在超声时间分别为0、10、15、20 min时,光学显微镜下观察LPCD的粒径和形貌的变化。
1.2.5 液-气相变对LPCD超声造影能力的影响
将相变前和相变后的LPCD 样品注入体模,使用小动物超声成像系统(Visual Sonics 公司,加拿大)进行成像,超声探头频率为18 MHz,增益为30 dB。并通过荧光显微镜(OLYMPUS 公司,日本)观察相转变前后的形貌变化。
1.2.6 LPCD@Hy的制备
将PEGDA、LAP、BIS按照摩尔比3.6∶1.7∶1放入LPCD溶液中,加入适量的DiI溶液对整个水凝胶染色(浮力实验),待完全溶解后,取160 μL 溶液于模具中,405 nm 蓝紫光固化15 s,得到LPCD@Hy。单纯水凝胶(Hy)的制备方法与LPCD@Hy 相似,只需将第一步中的LPCD溶液换成PBS即可。
1.2.7 温度对LPCD@Hy结构的调控
使用荧光显微镜、场发射SEM(FEI公司,美国)和小动物CT(苏州海斯菲德信息科技有限公司)观察25 ℃和65 ℃加热3 min后LPCD@Hy的内部结构。
SEM 样品制备:将25 ℃和65 ℃加热3 min 后的LPCD@Hy 放入西林瓶中冻干,撕成长条状,喷金,观察剖面的孔洞和网络结构。
小动物CT 成像参数:X 线管扫描条件设置为60 kV 和133 μA,单次曝光时间为50 ms,扫描分辨率为50 μm,扫描角度间隔0.5°。成像后对图像进行三维重建,得到LPCD@Hy的三维立体图。
1.2.8 超声对LPCD@Hy结构的调控
将LPCD@Hy放入盛有PBS的6孔板中,超声探头对准6 孔板,和PBS 的液面直接接触,探头距离LPCD@Hy 约2 cm,超声参数与1.2.4 相同。在超声时间分别为0、10、30、50、60 min 时,荧光显微镜下观察水凝胶中LPCD的粒径和形貌的变化。
1.2.9 温度/超声对LPCD@Hy浮力的调控将Hy 和LPCD@Hy 装入带有刻度封闭透明玻璃瓶中,65 ℃水浴加热,观察水凝胶的浮力变化,然后将加热后的水凝胶放入4 ℃冰箱,观察降温对水凝胶浮力的影响;用LIFU 照射Hy 和LPCD@Hy,步骤与1.2.6 相同,观察LIFU 对水凝胶中LPCD 的作用,及其引起的水凝胶内部结构和浮力的改变,最后用125 W超声初步评估水凝胶中LPCD 相变后形成的微气泡破碎所需超声参数。
1.2.10 液-气相变对LPCD@Hy机械性能的调控
压缩性能:将Hy 和LPCD@Hy 制备成直径约10 mm,高4 mm 的圆柱体。样品分为Hy 25 ℃组、Hy 65 ℃组、LPCD@Hy 25 ℃组、LPCD@Hy 65 ℃组。使用生物材料力学性能测试系统(MTS 公司,美国)进行压缩,压缩程度为85%,每个样品重复3次。
溶胀性能:通过称重法测量水凝胶的溶胀率,样品分为Hy 37 ℃组、Hy 65 ℃组、LPCD@Hy 37 ℃组、LPCD@Hy 65 ℃组。每隔一段时间取出水凝胶,用湿润的吸水纸擦去水凝胶表面的水,然后用天平称重,得到Wt,待水凝胶溶胀达到平衡后,取出水凝胶冻干,得到干凝胶的重量W0,计算水凝胶的溶胀率:溶胀率=(Wt-W0)/W0×100%。
2 结果
2.1 LPCD粒径和形貌表征
常温时(25 ℃)LPCD 的平均水动力尺寸为165.7 nm(图1A),zeta 电位为-7.8 mV(图1B),说明液-气相变前,LPCD 处于纳米尺度。这一尺度使其在光学显微镜下很难被观察到(图1C),进一步通过SEM 进行表征(图1D),可以清晰地观察到LPCD 的空壳结构,在SEM 拍摄过程中,由于电子束的作用使得相变液滴内核瞬间汽化,导致LPCD粒径增大,直至膜壳破裂,形成了大量直径在微米量级的空腔结构,这也一定程度上验证了LPCD 在外界刺激下的液-气相转变能力及相转变所引起的尺度变化情况。

图1 25 ℃时LPCD 的表征Figure 1 Characterization of LPCD at 25 ℃
2.2 温度/超声对LPCD粒径的调控
相变液滴的内核成分PFC 在环境温度超过其沸点或压力大于汽化阈值时,可以实现从液态到气态的转变。PFH 是一种常用的PFC,沸点为56 ℃,在37 ℃下相对稳定[15],且在重复激活方面表现优异[16],因此本研究使用PFH 作为LPCD 的液态核心。脂质膜壳的包裹通常会对PFH 的相转变能力产生影响,改变其发生相转变的阈值温度,通过对常温、56 ℃、60 ℃、66 ℃条件下,LPCD粒径和zeta电位的检测,明确了LPCD的相变温度。
图2A 为不同温度下LPCD 的粒径分布变化情况,可以看出当温度升高至PFH 的相变温度56 ℃时,LPCD 的平均水动力尺寸由165.7 nm 增加至344.1 nm,粒径分布出现了双峰,说明此时一部分相变液滴内核发生明显汽化,粒径增加明显形成了微米粒度峰,而另一部分相变液滴内核还未发生明显汽化,粒径稍许增加保持纳米粒度峰;当温度升至60 ℃时,LPCD的平均水动力尺寸增长至1 277.7 nm,粒径分布成为单峰,说明此时,绝大部分LPCD的内核均发生了明显液气相变,成为粒径为微米级的脂质微气泡;当温度继续升高至66 ℃时,LPCD的平均水动力尺寸继续增加为1 380.2 nm,而粒径分布又一次出现双峰趋势,这是因为随着温度的进一步升高,内核进一步汽化,导致部分微气泡继续长大甚至破裂,留下粒径较小的微气泡稳定存在,使原来的单峰分化为双峰。图2B 为不同温度下LPCD 的zeta电位变化情况,表明温度变化不会对其表面zeta电位造成太大影响。光学显微镜下观察,也直观地验证了以上粒径变化的结果(图2C)。以上结果表明,使LPCD 发生较完全相变的温度范围在60 ℃至65 ℃之间,此时LPCD 的粒径会由纳米尺度变化为微米尺度。
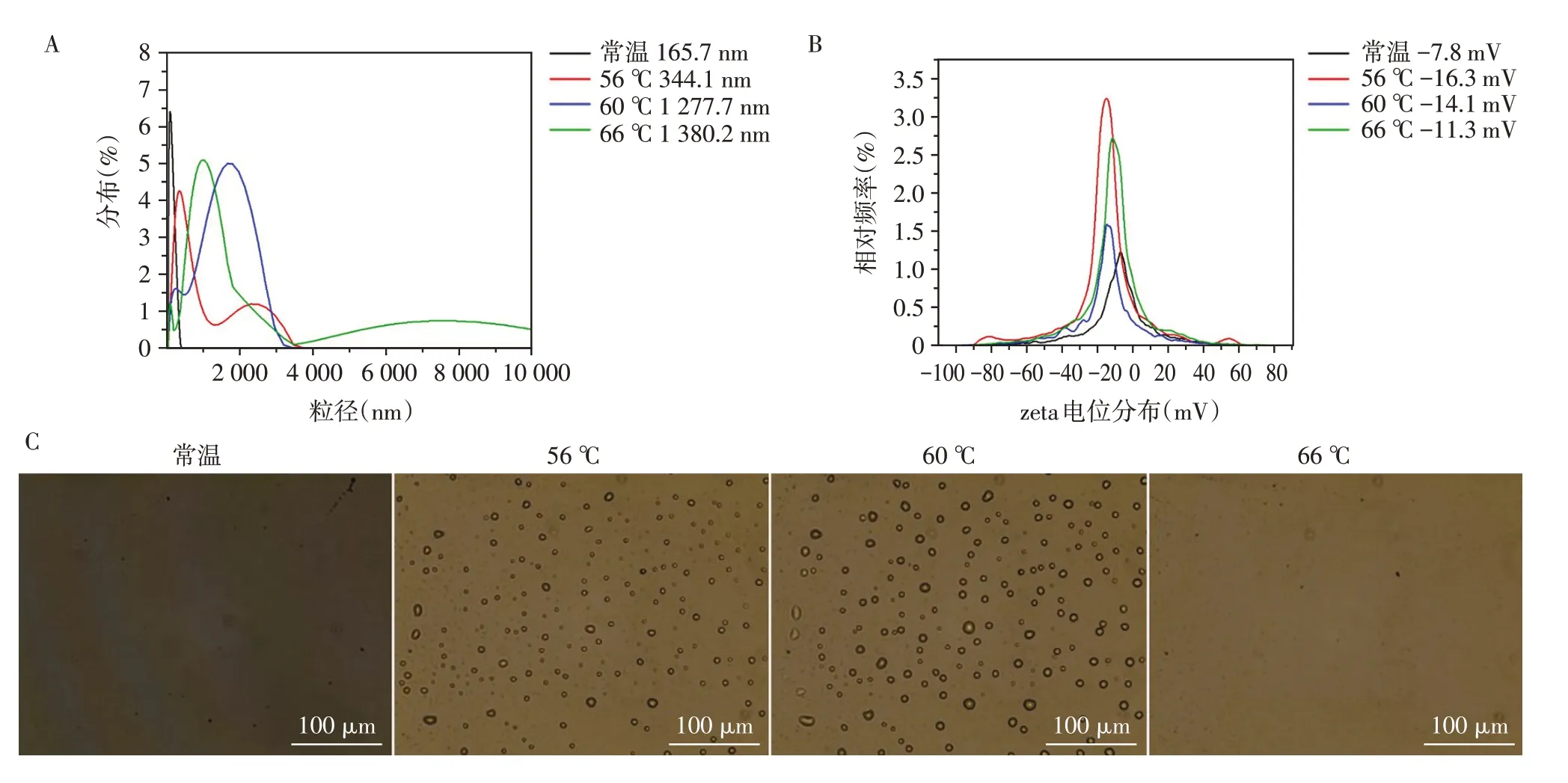
图2 温度对LPCD粒径的调控Figure 2 Regulation of temperature on particle size of LPCD
温度调控LPCD相变需要将温度升高到PFH的相变点56 ℃以上,这在体内应用时比较受限。压力的变化也能够引起液滴发生相变,称为声液滴汽化现象(acoustic droplet vaporization,ADV)。超声具有无创、无辐射、成本低等特点[17-18],尤其是低强度聚焦超声,在临床上具有较高的应用安全性,可作为声液滴汽化的激励源。图3 为LIFU 照射0、10、15、20 min 时LPCD 的光学显微镜图。可以观察到超声照射15~20 min 时,部分LPCD 发生明显相变,粒径显著增加至微米量级。随着超声照射时间的延长,发生液-气相转变的LPCD 数量逐渐增多。以上实验结果表明,温度/超声调控下LPCD 的粒径均能够发生巨大变化,这赋予了LPCD良好的应用潜力。

图3 超声对LPCD粒径的调控Figure 3 Regulation of ultrasound on particle size of LPCD
2.3 液-气相变对LPCD超声造影能力的影响
内核液-气相变使得纳米级液滴变为微米级气泡,理论上可显著提高其超声造影能力,图4是相变前、后LPCD 的体外超声成像结果。可以看出无论是B-模式还是造影模式,发生相变之后LPCD 的超声图像灰度均高于相变之前(图4A),说明相变液滴液-气相转变能够增强超声成像效果。图4B为造影模式下,相变前、后LPCD的平均信号强度随时间变化曲线,可以看出,相变后LPCD的超声图像增强时间可持续4 min以上,在造影开始的1 min内信号强度最高,之后由于微气泡逐渐发生团聚、破裂等现象,导致超声造影能力逐渐减弱。图4B中也给出了LPCD 相变前后的荧光显微镜图片,可以观察出相变前后其形貌的明显变化。

图4 LPCD的体外超声成像图片Figure 4 Ultrasound images of LPCD in vitro
2.4 温度/超声对LPCD@Hy结构的调控
将LPCD与水凝胶复合后,分别对25 ℃与65 ℃加热3 min后的LPCD@Hy 结构进行表征,研究液滴相变对水凝胶结构的影响。图5 为加热前后,LPCD@Hy的宏观形貌、CT、荧光显微镜和扫描电镜观察结果。可以看出温控下液滴的相变形成的气泡,可以使水凝胶内部形成密集的孔洞,如图5A 中白色空泡和图5E中黄色亮点所示,由于水凝胶内部网络结构的限制,孔洞形状大部分呈梭形而非球形(图5G),直径在几十微米量级,尺寸大于水凝胶自身的空隙结构(图5H)。
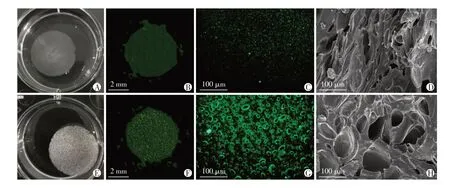
图5 温度对LPCD@Hy结构的调控Figure 5 Regulation of temperature on the structure of LPCD@Hy
虽然温度能够通过调节LPCD相变调控水凝胶的内部结构,但超声是更为有效和实用的方法。前述实验已经证实LIFU 能够促使LPCD 在水溶液中发生相变,但液滴汽化的声压阈值与周围介质的硬度和黏度有关,因此,本文通过荧光显微镜观察,探究了不同照射时间下LPCD 在水凝胶中的相变情况,研究超声调控下液滴相变对水凝胶结构的影响。图6 为LIFU 照 射0、10、30、50、60 min 时LPCD@Hy 的荧光显微镜图。可以观察到,随着照射时间的增长,LPCD 在水凝胶中的相变程度不断增大,逐步形成大量百微米量级的气孔。与温度调控相比,超声调控可通过对照射时间和强度的调节,实现在特定的时间和空间位置,对水凝胶结构的更精准和连续调控。上述表征结果证实了相变液滴可以作为中间媒介,通过响应外部温度或超声变化,间接而明显地改变水凝胶的结构。为水凝胶在细胞培养、组织工程和药物递送等方面的应用提供了新思路。

图6 超声对LPCD@Hy结构的调控Figure 6 Regulation of ultrasound on the structure of LPCD@Hy
2.5 温度/超声对LPCD@Hy浮力的调控
理论上,LPCD@Hy 内部结构的变化会对其性能造成影响。图7A 直观地表明液滴相变会引起水凝胶浮力的显著变化,外部温度或超声能量的介导,均无法使未与相变液滴复合的水凝胶Hy浮力发生变化,而与相变液滴复合的水凝胶LPCD@Hy,65 ℃加热32~42 s即开始浮起并最终稳定漂浮于液面上,降温至4 ℃未明显改变水凝胶在水溶液中的位置,说明降温未对水凝胶的结构和浮力产生明显影响。同样,LPCD@Hy 在LIFU 照射50 min 时开始浮起,60 min 时能够稳定地漂浮在液面上。当增大超声功率至125 W照射15 min后,LPCD@Hy再次下沉至溶液底部,光学显微镜观察发现125 W 超声作用前后水凝胶的结构发生了明显变化,超声前水凝胶中存在的大量微米级气泡(图7B),超声作用后气泡消失(图7C),表明调节超声强度和作用时间,不仅可以使水凝胶中的LPCD 发生相变,还可以产生破裂。以上结果提示,与LPCD 的结合不仅可将气体成分引入水凝胶,还可通过对温度和超声的更细致调控,精准控制水凝胶在溶液或血液中的位置。

图7 LPCD@Hy温度/超声调控下的浮力变化Figure 7 Buoyancy variation of LPCD@Hy under temperature/ultrasound regulation
2.6 液-气相变对LPCD@Hy机械性能的影响
为了对比LPCD 液-气相变对水凝胶压缩性能和溶胀性能的改变,通过加热的方式使水凝胶中的LPCD 发生相转变,因为相比于超声,温度升高时水凝胶受热更均匀,LPCD 相转变更完全,水凝胶整体结构的改变更显著。首先,分析了液滴引入对水凝胶压缩性能的影响。图8A中的压缩应力-应变曲线表明,未复合相变液滴的水凝胶Hy,升温前后的应力曲线变化不大,说明升温对水凝胶自身的机械性能影响较小。而复合了相变液滴的水凝胶LPCD@Hy,与Hy相比表现出较低的压缩强度,这是因为液滴的加入使得水凝胶的内部有了新的结构单元,交联网络更加不规则,导致凝胶强度降低。另一方面,升温对LPCD@Hy 的压缩性能也会产生影响。65 ℃加热后,在压缩应变为60%时,压缩应力从21.06 kPa 上升到28.99 kPa,而最大压缩应变由71.22%降低到65.44%,这是因为相变液滴在此过程成为微气泡,原本的液态内核成为气态,使凝胶抗压能力增强;而微气泡进一步撑大了水凝胶的网络结构,增加了其结构的不规则度,使其增强硬度的同时降低了韧性。
水凝胶的溶胀率是评价水凝胶性能的重要指标,也在一定程度上影响水凝胶在各方面的应用。图8B中溶胀率随时间的变化曲线表明,未复合相变液滴的水凝胶Hy 升温后的溶胀速率和平衡溶胀率大于37 ℃升温前,说明升温使得水凝胶网络结构变得疏松,对溶胀产生较大影响。而复合了相变液滴的水凝胶LPCD@Hy,与Hy 相比,在37 ℃和65 ℃都表现出较低的溶胀率,这是因为LPCD 在水凝胶网络结构中起一定的支撑和空间占据的作用,导致37 ℃时水凝胶不容易发生溶胀;另一方面,65 ℃时LPCD 粒径变为微米级,在水凝胶网络结构中占据一定的空间,使得外环境的PBS 溶液无法进入水凝胶内部。这也说明LPCD的加入使得水凝胶的网络更加稳定,溶胀性能相对减小。通过4 条曲线的对比,可以发现水凝胶的溶胀率在温度较高时表现出一定的退溶胀性质,随后在不同的条件下均随时间逐渐增大至平台期。
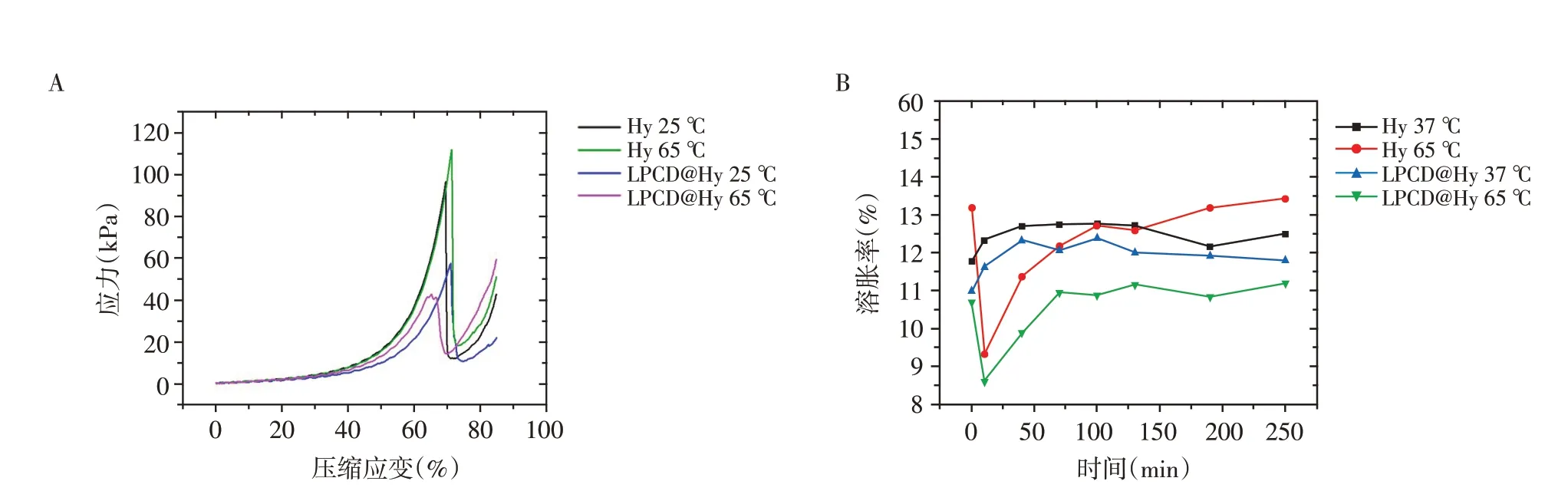
图8 相变液滴-水凝胶复合材料的压缩和溶胀性能Figure 8 Compression and swelling properties of phase-change droplets-hydrogel composites
3 讨论
相变液滴与智能响应水凝胶均是近年来研究的热点,而将两者结合,设计能够响应外部多种激励的复合水凝胶的研究还鲜有报道。本研究制备了一种温度/超声双重响应型脂质相变液滴,并对其在温度/超声激励下的相转变能力,液-气相变前后的超声造影能力进行评估,同时,当其与水凝胶复合后,研究了温度/超声激励下,相变液滴对水凝胶的结构与性能的调控。
在温度和超声调控下,脂质相变液滴能够发生液-气相转变,由纳米级液滴蒸发形成微米级气泡。和温度产生的单纯热效应相比,超声能够通过空化作用、机械作用等综合效应刺激液滴发生相变[19]。相变液滴相转变后能够增强超声造影效果,主要是由于与纳米液滴相比,微米级气泡有更大的散射面积,内核气体也比液体有更大的声阻抗,从而可以有效反射声波。外部激励对相变液滴超声造影能力的调控,一定程度上解决了传统微气泡的应用弊端。外界激励前,PFC核心保持液态,相变液滴粒径处于纳米量级,在血管内有较好的循环稳定性[20],且可以通过血管壁扩张进入病变组织,克服了传统微气泡由于微米尺度的限制易被网状内皮系统清除[21],无法透过血管进入肿瘤组织内部,从而仅适用于血管造影的不足;外界能量激励之后,纳米液滴转化为微气泡,又克服了纳米尺度造影剂对超声信号的增强作用不足的弊端。
和水凝胶结合后,在温度和超声的调控下,相变液滴同样能够发生液-气相转变,在水凝胶内部形成大量孔洞,从而改变水凝胶内部的结构;同时,能够通过调节相变液滴的相变程度控制水凝胶浮力的变化。除此之外,液-气相转变会影响水凝胶的机械性能,相变液滴的引入会降低水凝胶的压缩强度,升温后,使水凝胶的硬度增加,韧性下降。本文研究了温度和超声场对相变液滴-水凝胶复合材料的调控,但在超声对水凝胶结构性能变化的更精准调控方面,还有待进一步深入。
综上所述,本研究制备了一种温度/超声双重响应型脂质相变液滴,可在温度/超声激励下实现液-气相转变,能有效提高相变液滴的超声造影能力,同时,当与水凝胶复合后,通过温度/超声激励,可以间接调控水凝胶的结构与性能。该研究目前尚处于初步阶段,后续将从以下几个方面深入:优化相变液滴的结构,构建适用于体内应用的低沸点相变液滴;对相变液滴进行精准调控,细化超声参数,并探索不同尺寸相变液滴液-气相变所需的超声强度阈值;研究水凝胶结构和力学性能的改变对药物释放、组织工程、细胞培养等应用的影响。

