负载HIP的耐受性树突状细胞对BDC2.5 T细胞的免疫调节作用
祁颜艳,顾 愹,杨 涛
南京医科大学第一附属医院内分泌科,江苏 南京 210029
1 型糖尿病(type 1 diabetes mellitus,T1DM)是一种T 细胞介导的以胰岛β细胞靶向破坏为特征的自身免疫疾病,自身反应性T细胞在β细胞破坏中起核心作用,诱导胰岛自身抗原耐受有望治愈T1DM。但目前不管是针对胰岛自身抗原如胰岛素、谷氨酸脱羧酶(glutamate decarboxylase,GAD),还是针对一些致病表位肽如胰岛素B9-23、DiaPep277等的抗原特异性免疫耐受治疗,均未达到理想的效果,这主要由于自身反应性T 细胞识别的表位仍未完全明确[1]。越来越多的证据表明,免疫系统对β细胞的攻击很可能是由于β细胞受到应激或病毒感染从而产生新生抗原或表位引起的[2-4],新表位在T1DM 发病机制中可能发挥重要作用[5-6],它的产生解释了为何自身反应性T细胞能逃脱胸腺的阴性选择来攻击β细胞。美国的Kathryn 教授利用致糖尿病性BDC CD4+T细胞克隆系来识别β细胞蛋白提取物,发现了一种由胰岛素与β细胞分泌颗粒内其他抗原共价交联剪切融合而成的新表位多肽,将其命名为“hybrid insulin peptide(HIP)”[7]。在T1DM 患者和动物模型NOD(non-obese diabetic)小鼠体内均存在识别这种致病性表位的自身反应性CD4+T细胞[8-9]。基于这种新表位诱导抗原特异性免疫耐受为T1DM的治疗提供了新的研究方向[6]。
树突状细胞(dendritic cell,DC)作为强大的专职抗原提呈细胞,不仅可以诱导免疫反应发生,而且在诱导中枢和外周耐受、维持免疫稳态中也发挥着重要作用[10]。一方面,在经典免疫反应中,外周未成熟DC(imature DC,iDC)在遇到抗原和危险信号后上调共刺激分子(CD80、CD86、CD40 等)、主要组织相容性复合体(major histocompatibility complex,MHC)分子和促炎细胞因子、趋化因子的表达,成为成熟的DC(mature DC,mDC)从而能够迁移到淋巴结并诱导免疫反应发生;另一方面,还存在着一群耐受性DC(tolerogenic DC,tolDC)通过低表达共刺激分子、高表达共抑制分子、分泌抗炎细胞因子等机制诱导T 细胞克隆失能、凋亡等。因此,tolDC 作为一种细胞疗法在自身免疫疾病包括T1DM的治疗中富有前景[11-13]。然而目前tolDC 在T1DM 方面的研究主要是非抗原特异性或是仅针对单一抗原(GAD)或抗原肽(胰岛素原肽)[14],而表位扩展等原因产生的新表位如2.5HIP可能在T1DM发病机制中发挥了重要作用。2.5HIP是由胰岛素原的C肽片段(LQTLAL)与嗜铬粒蛋白A的WE14片段(WSRMD)融合形成的杂交肽,它是NOD小鼠体内分离出来的致糖尿病性的T 细胞克隆系BDC2.5 T 细胞[15]特异性识别的抗原表位[7]。针对2.5HIP诱导抗原特异性免疫耐受是T1DM 治疗的新思路,所以本研究旨在探究负载2.5HIP的tolDC对致糖尿病性BDC2.5 T细胞的免疫调节作用。
1 材料和方法
1.1 材料
实验动物均为SPF级别,实验所用的8~12周龄NOD 雌鼠、6~13 周龄BDC2.5 TCR 转基因雌鼠均来自南京大学模型动物研究中心。实验动物的饲养、使用及处理均经过南京医科大学实验动物伦理委员会审批(批准编号:IACUC-2011058)。实验所用的试剂包括:RPMI1640培养基、胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲液(phosphate buffer saline,PBS)(Gibco 公司,美国);粒细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、白介素(interleukin,IL)-4(Peprotech 公司,美国);1α,25-二羟基维生素D3(VitD3)、脂多糖(lipopolysaccharide,LPS)(Sigma 公司,美国);CellTrace CFSE 细胞增殖试剂(Invitrogen 公司,美国);小鼠IL-12p70 细胞因子检测试剂盒(R&D 公司,美国);小鼠转化生长因子-β(transforming growth factor-β,TGF-β)细胞因子检测试剂盒(深圳欣博盛);2.5HIP 序列EVEDPQVAQLELGGGPGAGDLQTLALWSRMDQL-AKELTAE(上海吉尔生化公司合成);小鼠CD4+T 细胞阴选磁珠、autoMACS Runnning Buffer(美天旎公司,德国)。实验中所用的流式抗体包括:FITC-CD11c、PE-CD80、Percpcy5.5-CD86、APC-MHCⅡ、APC-PD-L1、APC-CD4、FITC-CD44、PE/cyanine7-CD69、BV421-CD25、PEFoxp3 均来自美国Biolegend 公司;流式细胞术所用破核试剂eBioscienceTMFOXP3/Transcription Factor Staining Buffer Set(Invitrogen公司,美国)。
1.2 方法
1.2.1 小鼠骨髓来源的DC培养
取8~12 周龄的NOD 雌鼠,分离其肱骨、胫骨,75%酒精消毒5 min后用PBS冲洗去除两端骨骺,用1 mL注射器冲洗骨髓腔内的骨髓细胞至RPMI1640完全培养基中,裂红处理后用200 目的滤网过滤并洗涤,每只鼠大概可以获得2×107~4×107个骨髓细胞,计数后用RPMI1640 完全培养基重悬并调整密度至1×106个/mL。实验设置iDC 组、tolDC 组、LPS-tolDC 组、LPS-iDC 组(即mDC 组),每组均加入GM-CSF 20 ng/mL 和IL-4 10 ng/mL,tolDC 及LPStolDC 组额外加入VitD3(1×10-8mol/L)于6 孔板中培养,每隔2~3 d 进行换液,于培养的第7 天收集4 组DC 计数并按1×106个/mL 铺板,向LPS-tolDC 组以及LPS-iDC 组加入LPS(1 μg/mL)刺激24 h,然后进行下一步表型鉴定及功能试验。
1.2.2 DC的表型鉴定
在DC 培养的第8 天收集部分iDC、tolDC 以及用LPS 刺激后的LPS-tolDC、LPS-iDC,显微镜下观察其形态后1 500 r/min 离心5 min,收集其上清液于-80 ℃保存,后续用ELISA 做细胞因子检测。收集的DC用PBS洗涤后调整至1×106个/100 μL,置于流式管中,加入流式抗体FITC-CD11c、PE-CD80、Percp-cy5.5-CD86、APC-MHCⅡ、APC-PD-L1,避光4 ℃孵育30 min 后加入4 mL PBS 洗涤,1 500 r/min离心5 min,200 μL PBS 重悬,流式细胞仪检测,对各组DC进行纯度及表型鉴定。
1.2.3 BDC2.5 TCR转基因小鼠脾脏细胞的获取
BDC2.5 T 细胞克隆过继转移给未发病的NOD鼠或者NOD-SCID 鼠都会迅速导致糖尿病的发生,目前被广泛应用在糖尿病相关研究中。本研究采用来自BDC2.5 TCR转基因鼠的BDC2.5 T细胞作为研究对象。准备1 个装有200 目滤膜的培养皿,加入5 mL 美天旎autoMACS Runnning Buffer 并置于冰上,选择6~13周龄的BDC2.5 TCR转基因小鼠,麻醉后颈椎脱臼处死,取其脾脏细胞,置于培养皿中,再覆上1张滤膜,用5 mL注射器的尾部进行研磨获得单细胞悬液,将脾脏细胞离心后裂红处理,Buffer洗涤后用滤膜过滤,最终进行计数。按照说明书用CD4+T细胞阴选磁珠分选出CD4+T细胞,在96孔U型底培养板中按每100 μL 培养基中2.5×105个T 细胞每孔进行铺板。需进行细胞增殖实验的T细胞在铺板前用CFSE 染色:CFSE 储存液用PBS 稀释至2.5 μmol/L,1 mL 的CSFE 稀释液可染至多1×107个T细胞,染色后置于37 ℃培养箱中避光孵育3~4 min,然后用10 mL的RPMI1640完全培养基终止反应,洗涤后同上述步骤进行计数铺板。
1.2.4 DC与T细胞的共培养
在DC培养的第8天将2.5HIP(1 μg/mL)分别加入iDC、tolDC、LPS-tolDC、LPS-iDC 组共孵育4 h(对照组加入乙型肝炎病毒抗原肽作为无关肽共孵育4 h)。用PBS 洗涤后计数,按照1∶10与上述获得的T 细胞共培养,即每孔2.5×104个DC、2.5×105个T 细胞。共培养72 h后,用流式细胞术检测CD4+T细胞的增殖、活化情况以及诱导Treg生成的情况。染有CFSE的CD4+T细胞用APC-CD4流式抗体进行染色并避光孵育30 min,洗涤后流式细胞仪进行检测。未染CFSE的T细胞用APC-CD4、FITC-CD44、PE/cyanine7-CD69、BV421-CD25 流式抗体先进行细胞表面染色并避光孵育30 min,洗涤后用Foxp3 转录因子染色试剂盒进行破核处理,用PE-Foxp3进行染色并避光孵育30 min,洗涤后用流式细胞仪检测。
1.3 统计学方法
本研究应用FlowJo 10.4 进行流式数据的分析,Graphpad Prism 9 进行绘图及统计学分析。正态分布数据用均数±标准差()表示,两组定量资料的比较采用t检验(符合正态性和方差齐性),多组定量资料组间差异比较用单因素方差分析(one-way ANOVA)检验,多组间的两两比较应用LSD 检验。P<0.05时差异有统计学意义。
2 结果
2.1 1α,25-二羟基维生素D3 诱导的tolDC 具有稳定的耐受表型
显微镜下观察培养第8 天的DC 可见:由GMCSF、IL-4 诱导的iDC 呈圆球形,表面可见树突状结构伸出,LPS可以通过DC膜上的Toll样受体刺激其成为LPS-iDC(mDC),其表面树突状结构更加明显且倾向聚集形成集落。在培养基中额外加入VitD3可诱导出纺锤形的tolDC,LPS 刺激后其形态如图1A 所示。用流式细胞术检测DC 表面的CD11c分子进行纯度鉴定,结果显示培养8 d 的iDC 纯度可达80%~90%左右,且tolDC的纯度更高,多达90%以上(图1B)。
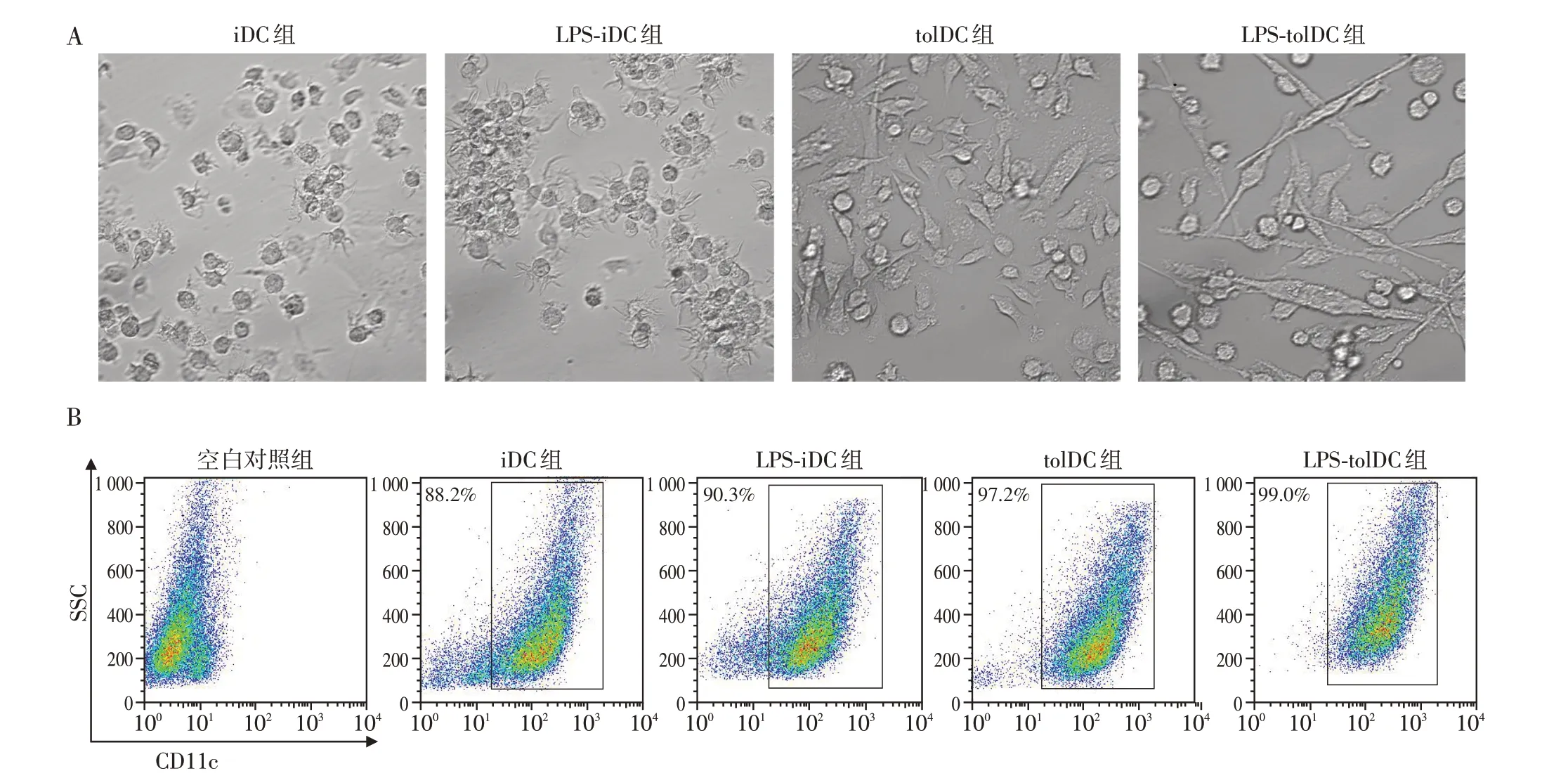
图1 培养8 d后的DC形态及纯度Figure 1 Morphology and purity of DC after 8 days of culture
进一步对DC 的表面分子进行流式检测(图2A~D),结果显示tolDC 的CD80、CD86 分子表达明显低于iDC(平均荧光强度CD80:172.3±7.8vs.277.8±61.2,CD86:36.4±3.9vs.87.8±31.4,P均<0.05)。tolDC 的MHCⅡ分子表达低于iDC 但没有统计学差异,但在LPS 刺激24 h 后,LPS-tolDC 的CD80、CD86 及MHCⅡ分子表达均明显低于LPS-iDC(P均<0.01)。tolDC 表面的PD-L1 分子表达显著高于iDC(平均荧光强度:363.3±33.0vs.126.2±18.0,P<0.001),且LPS刺激24 h后仍高于LPS-iDC(平均荧光强度:1 389.0±348.2vs.738.8±32.9,P<0.05)。分别检测LPS 刺激后的tolDC 和iDC 细胞因子分泌情况,发现tolDC 分泌的炎症细胞因子IL-12p70 显著下降[(49.1±3.0)pg/mLvs.(127.7 ± 7.4)pg/mL,P<0.001],而具有免疫抑制作用的TGF-β细胞因子则明显升高[(970.7±109.9)pg/mLvs.(747.9±48.6)pg/mL,P<0.05,图2E、F]。
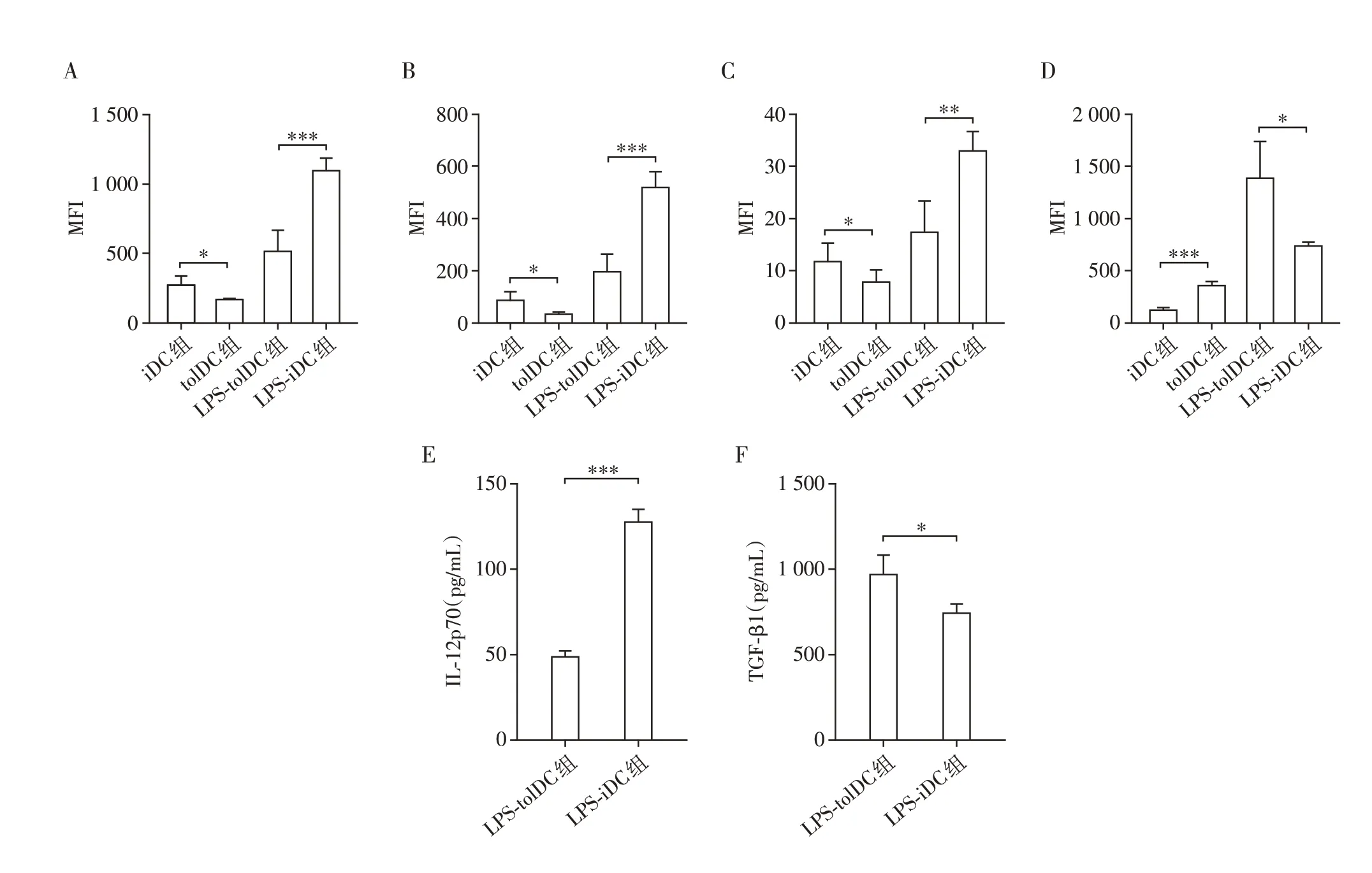
图2 DC的表面分子鉴定及细胞因子分泌情况Figure 2 Surface molecular identification and cytokine secretion of DC
2.2 负载2.5HIP 的tolDC 及LPS-tolDC 可抑制BDC2.5 T细胞的增殖和活化
将培养了8 d 并负载2.5HIP 或无关肽的iDC、tolDC、LPS-tolDC、LPS-iDC 分别与BDC2.5 CD4+T细胞进行共培养,72 h 后检测T 细胞的增殖、活化情况。结果发现2.5HIP-tolDC 组[(37.40±5.18)%]以及2.5HIP-LPS-tolDC组[(49.23±4.85)%]的T细胞增殖率与2.5HIP-iDC 组[(71.53±7.56)%]及2.5HIPLPS-iDC 组[(84.03±4.88)%]相比明显下降(P<0.001,图3A)。2.5HIP-tolDC 组[(19.57±2.67)%]以及2.5HIP-LPS-tolDC组CD44+CD69+活化T细胞的比例[(49.37±4.84)%]与2.5HIP-iDC 组[(81.67±4.23)%]以及2.5HIP-LPS-iDC组[(83.90±2.42)%]相比也明显降低(P<0.001,图3B)。负载无关肽的4组DC 均与T 细胞无反应,组间无差异性,因为共培养所用的BDC2.5 T细胞是2.5HIP特异性的T细胞。

图3 BDC2.5 CD4+T细胞与负载2.5HIP的DC共培养后的增殖活化情况及产生Treg的比例Figure 3 Proliferation,activation and proportion of Treg of BDC2.5 CD4+T cells co-cultured with 2.5HIP-loaded DC
2.3 负载2.5HIP的tolDC可诱导更高比例的Treg细胞产生
tolDC 诱导免疫耐受的机制之一是诱导Treg 的产生[11],本研究进一步检测了与各组DC 共培养的T 细胞中Treg(CD4+CD25+Foxp3+)的比例。结果发现,2.5HIP-tolDC 组可以诱导最高比例的Treg 细胞产生[(10.77±0.82)%],与2.5HIP-iDC[(5.62±1.73)%]及2.5HIP-LPS-iDC 组[(4.11±0.52)%]相比差异显著(P<0.001,图4)。但2.5HIP-LPS-tolDC 组的Treg 比例[(6.05±1.27)%]与2.5HIP-LPS-iDC 组[(4.11±0.52)%]相比差异并无统计学意义。负载无关肽的各组DC几乎不诱导产生Treg且组间差异无统计学意义。
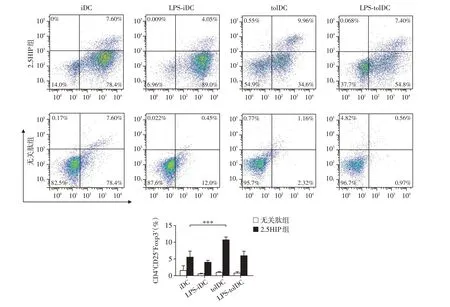
图4 BDC2.5 CD4+T细胞与负载2.5HIP的DC共培养后产生Treg的比例Figure 4 Proportion of Treg in BDC2.5 CD4+T cells co-cultured with 2.5HIP-loaded DC
3 讨论
T1DM 作为一种自身免疫疾病,使用外源性胰岛素进行治疗并不能阻止胰岛自身免疫的发展,而通过诱导自身抗原免疫耐受有望治愈T1DM。tolDC细胞疗法作为一种极具潜力的诱导免疫耐受方法受到了人们的关注,但目前大多数基于tolDC 的治疗都是非抗原特异性的。负载抗原的tolDC 疗法可以避免广泛的免疫抑制并有望诱导抗原特异性免疫耐受,但其效果是否更佳尚没有定论。研究表明负载胰岛素原的tolDC 在体外可以诱导具有各种表型的抗原特异性Treg,表达调节标志物如Lag-3、CD161,并有效抑制效应CD8+和CD4+T 细胞[16],且一项对T1DM 患者皮内注射负载胰岛素原肽tolDC的临床研究显示负载抗原的tolDC 疗法似乎是安全可行的[17];但也有临床前研究发现负载GAD65 的tolDC降低了tolDC对T1DM的保护作用[18]。而新生表位在T1DM 发病机制中可能起重要作用,研究负载新生表位的tolDC 也许会为抗原特异性tolDC 疗法打开新思路。所以本研究的创新之处在于首次针对新生表位2.5HIP,探究抗原特异性tolDC 细胞疗法对致糖尿病性BDC2.5 T细胞的免疫调节作用。
已有多个研究为tolDC 的体外诱导提供了参考,GM-CSF 及IL-4 可诱导人外周血单核细胞来源或小鼠骨髓祖细胞来源的iDC 的生成,同时加入药物(如地塞米松、雷帕霉素、VitD3等)或免疫调节剂(IL-10、TGF-β等)可产生tolDC[14,19]。tolDC 的特征是其半成熟(semi-mature)的表型,低表达CD80、CD86、CD40和MHC等分子,高表达PD-L1等共抑制分子,分泌低水平的抗炎细胞因子、高水平的免疫抑制细胞因子,tolDC通过这些机制使得T细胞克隆失能、凋亡。iDC虽然也低表达共刺激分子,但其未成熟状态是不稳定的,在体内治疗或者炎症情况下可能被激活,所以tolDC 的稳定性也是保证其诱导免疫耐受的一个重要方面。本研究用维生素D3 诱导出的tolDC 低表达CD80、CD86,高表达PD-L1,在LPS 刺激后仍能保持稳定的半成熟耐受表型,且炎性细胞因子IL-12p70分泌减少,免疫抑制细胞因子TGF-β分泌增多。tolDC 的MHCⅡ分子表达低于iDC,虽然两者没有统计学差异,但在LPS刺激后,两者的MHCⅡ分子表达有显著差异,tolDC 这种在外来危险信号或炎症刺激下仍保持表型稳定性也是其耐受性的一种表现。
研究提示在tolDC 体内治疗前用LPS 进行刺激十分必要[20],LPS 刺激是其获得迁移活性和增强抗原提呈所必需的,且不会降低其耐受功能。本研究结果也证实了这一点,尽管LPS-tolDC 诱导抗原特异性Treg产生的能力并不如tolDC 显著,但tolDC 和LPS-tolDC均可以显著抑制致病性BDC2.5 CD4+T细胞的增殖和活化。所以LPS 刺激后的tolDC 不仅可以保持稳定的耐受表型,而且也维持了其抑制T 细胞增殖活化的能力,其是否具有更好的迁移能力还需要进一步的体内实验进行验证。需要作出解释的是,本研究结果显示iDC 刺激T 细胞增殖及活化的能力接近LPS-iDC,这是由于iDC的耐受表型的不稳定性[11],在吞噬抗原后可以获得更活跃的表型和迁移能力,从而刺激了T细胞的增殖和活化[21]。
综上所述,本研究发现负载HIP的tolDC可以通过其稳定的耐受表型和功能来抑制BDC2.5 T 细胞的增殖活化,诱导抗原特异性Treg 的产生,这为今后T1DM 的抗原特异性细胞疗法提供了参考,但对于T1DM的具体治疗效果还需要更进一步的探究。

