Bay11-7082通过抑制足细胞焦亡减轻膜性肾病组织损伤
吕道远 蒋 松 王 慧 张明超 朱小东 杨 帆 李 申 刘 丰 曾彩虹 秦卫松 李丽民 刘志红
膜性肾病(MN)的形态学特征是肾小球基膜上皮侧免疫复合物沉积,因补体系统异常活化致足细胞及肾小球滤过屏障受损,典型临床表现为肾病综合征的肾脏特异性自身免疫性疾病[1],但足细胞损伤的确切机制尚不完全明确。
细胞焦亡是一种近来发现的细胞程序性死亡方式,炎症小体活化是焦亡发生的关键环节,GSDMD是焦亡主要执行蛋白,焦亡的发生以GSDMD的活性N端片段与细胞膜结合并寡聚化形成孔道后细胞内外渗透压差失衡,细胞肿胀、破裂为特征[2-3]。本团队前期通过MN患者队列,C3a/C5a介导的体外足细胞损伤模型和被动Heymann肾炎(PHN)大鼠模型已证实,以经典炎症小体NLRP3为主要途径的NLRP3-ASC-Caspase-1-IL-1β/IL-18/GSDMD焦亡信号通路活化导致的足细胞焦亡的发生是MN肾组织损伤的重要机制,焦亡抑制剂MCC950、VX-765、Ac-FLTD-CMK、双硫仑均可通过抑制足细胞焦亡有效保护MN肾组织损伤[4-5]。上述发现揭示出焦亡在补体介导的足细胞损伤机制中的重要地位及焦亡抑制剂在MN治疗中的应用前景。因此,更多焦亡抑制剂在MN中的应用价值,亟待进一步明确。
Bay11-7082是经典的核因子κB(NF-κB)信号通路抑制剂,新近研究发现,Bay11-7082可通过共价修饰GSDMD的Cys位点进而抑制其活化后的膜打孔过程从而抑制细胞焦亡[6]。Bay11-7082对焦亡信号通路的关键分子NLRP3、Caspase-1、Caspase-11亦具有抑制效应[6-7]。为了证实Bay11-7082在MN中的潜在抗焦亡治疗效应,本研究利用体外补体C3a/C5a介导的足细胞损伤模型和PHN大鼠模型对此进行了观察和验证。
材料与方法
细胞培养与损伤模型建立人永生化肾小球足细胞系由Saleem教授(University of Bristol,UK)惠赠,参照既往文献[8]方法培养后置换为无血清培养液,加入50 nmol/L C3a/C5a孵育1h以建立C3a/C5a介导的足细胞损伤模型。在1 nmol/L~20 μmol/L范围内使用乳酸脱氢酶(LDH)细胞毒性检测试剂盒(Beyotime Biotechnology)检测细胞LDH释放量以明确Bay11-7082的最佳保护剂量,确定其干预剂量为50 nmol/L,于模型建立前1h加入。所有细胞实验每次均设置1个复孔并重复3次。
碘化吡啶(PI)染色接种细胞于激光共聚焦细胞培养皿中行PI(3.34 μg/mL)染色,DAPI(15 μg/mL)染细胞核后置共聚焦荧光显微镜(LSM710,Carl Zeiss Meditec AG)下观察并采集图像,计算PI染色阳性细胞数占总细胞数的比例。
动物模型建立与样本收集根据Salant等[9]的方案制备兔Fx1A抗血清,取雌性SD大鼠,体质量150~180 g,腹腔注射Fx1A抗血清2 mL,间隔1 h再注射1 mL建立PHN模型,同法注射正常兔血清建立对照。在2.5~20 mg/(kg·d)摸索PHN模型大鼠对Bay11-7082腹腔注射的较大耐受剂量,确定Bay11-7082的干预方案为2.5 mg/(kg·d),于建模前1 d连续腹腔注射至观察终点。剔除PHN及Bay11-7082干预组中建模15 d尿蛋白定量<10 mg/d及意外死亡的个体,最终分组:(1)正常对照(NC)组(n=6);(2)PHN组(n=6);(3)PHN+Bay11-7082干预组(n=6)。收集各组大鼠自建模后第1天、第5天、第8天、第15天血清、24 h尿及建模后第15天(观察终点)的肾组织标本进行后续检测。动物实验方案经东部战区总医院实验动物中心医学伦理审查委员会讨论批准(批准文号:2019JLHGKJDWLS-136)。
尿蛋白及血生化检测Bradford法检测尿蛋白定量,全自动生化分析仪(7180, Hitachi, Ltd.)检测血清肌酐(SCr)、尿素氮(BUN)、血清白蛋白(Alb)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)水平。
病理染色及分析大鼠肾组织石蜡切片行Masson与PASM-Masson染色后置显微镜下观察并摄片;大鼠肾组织超薄切片行醋酸铀-柠檬酸铅双染色后置透射电子显微镜(H-7500,Hitachi, Ltd.)下观察并摄片,根据公式:(π/4)×(Σ基膜长度/Σ基膜上足突的个数)计算足细胞足突宽度(π/4为基于足突形态假设的系数)[10]。
免疫荧光染色接种细胞于爬片上,4%多聚甲醛固定,5%BSA封闭后GSDMD(N)抗体(Affinity Biosciences LTD.,1∶200稀释)/ZO-1抗体(Proteintech Group, Inc., 1∶200稀释)4℃孵育过夜,FITC/Cy3标记二抗(Beyotime Biotechnology,1∶200稀释)孵育后DAPI(10 μg/mL)染细胞核,置共聚焦荧光显微镜下观察并采集图像;取大鼠肾组织冰冻切片,10%小牛血清封闭后GSDMD(N)抗体(1∶200稀释)/Synaptopodin抗体(Santa Cruz Biotechnology, Inc., 1∶500稀释)及GSDMD(N)抗体(1∶200稀释)/ZO-1抗体(1∶200稀释)常温孵育过夜,FITC/Cy3标记二抗(1∶200稀释)孵育后置共聚焦荧光显微镜下观察并采集图像。
免疫组化染色取大鼠肾组织石蜡切片行抗原修复,10%小牛血清封闭后常温孵育以下抗体过夜:结蛋白(Desmin)(Maixin Biotech, Co., Ltd.),Wilms瘤基因1(WT-1)(Abcam plc, 1∶300稀释),GSDMD(N)(1∶200稀释),NF-κB p65(Proteintech Group, Inc., 1∶500稀释),p-NF-κB p65 (Ser536)(Affinity Biosciences LTD., 1∶500稀释),NLRP3(Affinity Biosciences LTD., 1∶200稀释),ASC(Affinity Biosciences LTD., 1∶200稀释),Caspase-1(Cell Signaling Technology, Inc., 1∶200稀释),IL-1β(Cell Signaling Technology, Inc., 1∶200稀释)和IL-18(Affinity Biosciences LTD., 1∶200稀释),二抗孵育,DAB显色,苏木素复染后置显微镜下观察。每张切片随机拍摄3张含肾小球照片,使用《Image-Pro Plus 6.0》软件(Media Cybernetics)计算肾小球染色阳性区域积分光密度(IOD)、面积并计算二者比值。取3张照片肾小球IOD面积比均值为该样本目的蛋白表达量。
实时荧光定量PCR(RT-qPCR)根据Salant等[9]的方案使用筛网法分离新鲜大鼠肾小球,提取RNA并进行逆转录,使用TB Green®Premix Ex TaqTMⅡ(Takara Biomedical Technology Co., Ltd.)配制qPCR反应体系并置于快速RT-qPCR系统(7900HT, Thermo Fisher Scientific Inc.)内检测并读取Ct值。各基因引物序列为:GSDMD (F: 5’-AGATCGTGGATCATGCCGTC-3’; R: 5’-AGGAGGCAGTAGGGCTTGAA-3’); NLRP3 (F: 5’-CCTTCTGAACCGAGACGTGA-3’; R: 5’-CCAAAGAGGAAGCGTACAACA-3’); ASC (F: 5’-GCTGAGCAGCTGCAAAAGAT-3’; R: 5’-GCAATGAGTGCTTGCCTGTG-3’); Caspase-1 (F: 5’-TAGACTACAGATGCCAACCAC-3’; R: 5’-CTTCTTATTGGCATGATTCCC-3’); IL-1β (F: 5’-CAGAAGAATCTAGTTGTCCGT-3’; R: 5’-TGTGCTTCATTCATAAACACT-3’); IL-18 (F: 5’-TATCGACCGAACAGCCAACG-3’; R: 5’-GATAGGGTCACAGCCAGTCC-3’); GAPDH (F: 5’-GCTCTCTGCTCCTCCCTGTTCT-3’; R: 5’-GGCAACAATGTCCACTTTGTCAC-3’)。使用2-ΔΔCt法计算并比较各组各基因的相对表达量。
蛋白质免疫印迹(Western-blot)提取细胞总蛋白及大鼠肾皮质总蛋白和核蛋白并配平各组样品蛋白浓度,加入Loading Buffer煮沸变性后置于6%~15%聚丙烯酰胺凝胶电泳中分离蛋白并转移至PVDF膜,5%BSA封闭后4 ℃孵育以下抗体过夜:GSDMD(Affinity Biosciences LTD., 1∶1 500稀释);NF-κB p65、p-NF-κB p65 (Ser536)、NLRP3、ASC、Caspase-1、IL-1β、IL-18均按1∶1 000稀释;GAPDH(Cwbio IT Group, 1∶3 000稀释),Histone H3(Proteintech Group, 1∶3 000稀释);二抗孵育后显影液显影,置于全自动化学发光/荧光图像分析系统(5 200,Tanon Science & Technology Co., Ltd.)中采集图像。
酶联免疫吸附试验(ELISA)使用human IL-18 ELISA Kit(Boster Biological Technology Co., Ltd.)检测培养细胞上清IL-18含量;使用rat IL-1β/IL-18 ELISA Kit(Boster Biological Technology Co., Ltd.)检测大鼠血清IL-1β及IL-18含量。
统计学处理使用《SPSS 20.0》软件(IBM Corporation)进行统计分析。以均数±标准差描述数据,联用方差分析(ANOVA)与最小显著差异t检验(LSD-t)(如数据方差齐)/Welch近似方差分析与Dunnett’s T3检验(如数据方差不齐)推断多组组间差异并进行两两比较。P<0.05为差异具有统计学意义。
结 果
Bay11-7082通过抑制焦亡减轻C3a/C5a介导的足细胞损伤与NC组相比,C3a/C5a致足细胞GSDMD活化片段GSDMD(N)显著上调,且与细胞膜标记蛋白ZO-1存在共定位(图1A),提示C3a/C5a致足细胞发生焦亡。Western-blot及ELISA结果显示,与NC组相比,C3a/C5a致足细胞GSDMD、NF-κB p65、p-NF-κB p65 (Ser536)、NLRP3、ASC、Caspase-1、IL-18上调,IL-18释放增多(图1B、C)。同时,焦亡足细胞见明显损伤特征,表现为PI染色阳性率增加(图1D、E),LDH释放增多(图1F)。与C3a/C5a处理组相比,Bay11-7082干预组足细胞膜转移的GSDMD(N)减少(图1A),GSDMD、NF-κB p65、p-NF-κB p65 (Ser536)、NLRP3、ASC、Caspase-1、IL-18均下调(图1B),IL-18释放减少(图1C),足细胞PI染色阳性率降低(图1D、E),LDH释放减少(图1F)。上述结果提示Bay11-7082可通过抑制C3a/C5a介导的NF-κB-NLRP3-ASC-Caspase-1-IL-18/GSDMD焦亡信号通路的活化减轻足细胞损伤。
Bay11-7082减轻PHN大鼠肾组织和足细胞损伤在观察周期内,各组大鼠体质量变化的差异无统计学意义(图2A)。PHN大鼠呈典型肾病综合征表现,自建模5 d起尿蛋白定量显著上升(图2B),Alb显著下降(图2C),自建模8 d起见血脂紊乱,TC、TG、HDL、LDL陆续升高(图2F~I),建模15 d见SCr升高(图2D),PHN组与NC组BUN无差异(图2E)。光镜下PHN组见肾小球上皮侧嗜复红蛋白沉积和钉突形成(图3A);电镜下见肾小球上皮下电子致密物沉积、足细胞足突弥漫性融合(图3B、C)。免疫病理染色亦见足细胞显著损伤特征,表现为足细胞损伤标记蛋白Desmin显著上调(图3D、E),WT-1核表达显著下调且分布异常(图3D)。与PHN组相比,Bay11-7082显著缓解PHN大鼠肾组织和足细胞损伤,表现为干预组大鼠建模15 d尿蛋白定量下降(图2B),Alb上升(图2C),Desmin表达下调,WT-1核表达增加,异常分布减少(图3D、E),足细胞足突融合显著减轻(图3B、C),大鼠血脂谱改善,建模15 d HDL及LDL下降(图2H、I)。然而,Bay11-7082对PHN组肾小球免疫复合物沉积及补体活化的影响并不显著,肾小球上皮下可见免疫复合物沉积(图3A、B),肾小球IgG、C3、C5b-9与PHN组亦呈相似上调趋势。

图2 Bay11-7082缓解PHN大鼠肾病综合征
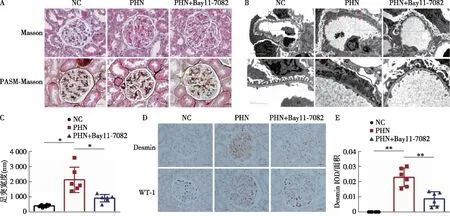
图3 Bay11-7082减轻PHN大鼠肾组织和足细胞损伤
Bay11-7082抑制PHN大鼠肾组织焦亡信号通路的活化和足细胞焦亡的发生免疫荧光染色显示,与NC组相比,PHN组显著上调的GSDMD(N)与足细胞标记蛋白Synaptopodin及细胞膜标记蛋白ZO-1均存在显著共定位(图4A),提示GSDMD于足细胞中活化并发生膜转位,足细胞是PHN大鼠肾小球发生焦亡的主要细胞。免疫组化、RT-qPCR、Western-blot及ELISA结果共同显示,焦亡信号通路NLRP3-ASC-Caspase-1-IL-1β/IL-18/GSDMD在PHN大鼠肾组织中显著活化上调,IL-1β及IL-18释放增加(图4B~G)。免疫组化和Western-blot显示,NLRP3上游重要的调控分子NF-κB p65及其磷酸化水平在PHN大鼠肾组织中亦显著上调(图4B、C、E)。与PHN组相比,Bay11-7082显著抑制PHN大鼠肾组织焦亡信号通路的活化和足细胞焦亡的发生,表现为足细胞膜转位的GSDMD(N)减少(图4A),肾组织NF-κB p65、p-NF-κB p65 (Ser536)、NLRP3、ASC、Caspase-1、IL-1β、IL-18、GSDMD表达下调(图4B~E),IL-1β及IL-18释放减少(图4F、G)。以上结果共同提示,Bay11-7082可通过抑制肾组织焦亡信号通路NF-κB-NLRP3-ASC-Caspase-1-IL-1β/IL-18/GSDMD的活化和足细胞焦亡的发生,从而减轻PHN大鼠肾组织损伤。
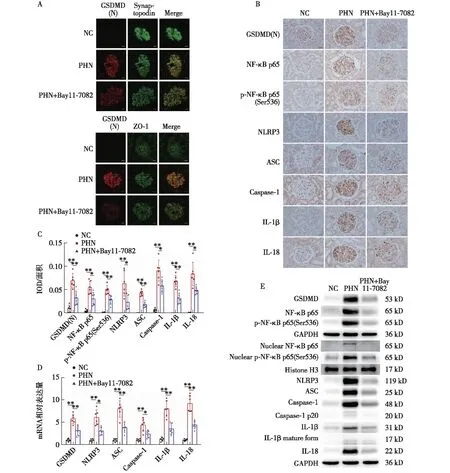
图4 Bay11-7082抑制PHN大鼠肾组织焦亡信号通路的活化和足细胞焦亡的发生
讨 论
本研究证实,Bay11-7082通过作用于NF-κB-NLRP3-ASC-Caspase-1-IL-18/GSDMD信号通路抑制足细胞焦亡,在C3a/C5a致足细胞损伤及PHN大鼠肾组织损伤过程中发挥保护效应。C3a/C5a又被称为过敏毒素,是补体活化过程中的重要片段。既往研究显示,C3a可通过介导cAMP信号通路依赖的线粒体分裂、改变线粒体膜电位与氧化还原水平、干扰线粒体能量代谢等机制推动足细胞死亡并影响其与基质的黏附[11],亦可通过其受体C3aR影响IL-1β/IL-1R1信号通路进而降低nephrin表达水平,推动足细胞骨架重排[12];本团队则首次证实C3a/C5a可通过推动线粒体去极化和活性氧生成进而导致足细胞焦亡[4]。本研究通过检测足细胞损伤及NLRP3-ASC-Caspase-1-IL-18/GSDMD焦亡信号通路的活化复现了本团队的前期发现,并通过免疫荧光双重染色直观展示出GSDMD(N)在C3a/C5a致足细胞损伤过程中的膜转移现象,进一步证实了焦亡是C3a/C5a致足细胞损伤的重要机制。同时,本研究更进一步发现了NF-κB在C3a/C5a致足细胞焦亡过程中的显著活化现象。该结果提示,作为已被证实的NLRP3活化最重要上游信号通路之一[13],NF-κB很可能在补体致足细胞焦亡过程中发挥调控效应。
利用迄今最为公认的MN动物模型——PHN大鼠模型以及MN患者队列,本团队前期亦在体内观察到了NLRP3-ASC-Caspase-1-IL-1β/GSDMD在MN足细胞中的显著活化上调现象,提供了焦亡参与MN足细胞损伤机制的直接证据[4],本研究夯实了上述发现并于PHN大鼠模型肾小球中观察到了足细胞GSDMD(N)的膜转移现象。此外,NF-κB信号通路在PHN大鼠肾组织中亦随焦亡信号通路呈显著活化上调状态,该结果与本研究体外实验结果共同证实了焦亡信号通路NF-κB-NLRP3-ASC-Caspase-1-IL-18/GSDMD的活化是推动MN肾小球足细胞损伤的重要因素。
本团队前期发现焦亡抑制剂MCC950、VX-765、Ac-FLTD-CMK、双硫仑对PHN大鼠良好的肾脏保护效应使我们迫切探索更多焦亡抑制剂在MN中的应用价值。Bay11-7082原属NF-κB抑制剂,通过抑制IκB激酶抑制IκBα的磷酸化从而影响IκBα的多泛素化降解,进而抑制NF-κB的活化[14]。近来已有研究陆续发现,Bay11-7082可抑制细胞焦亡信号通路的多个节点:例如,Bay11-7082可通过抑制NLRP3活化过程中所需的ATP酶的活性进而抑制NLRP3的活化[7],亦可分别抑制Caspase-1和Caspase-11,在依赖或不依赖经典炎症小体的细胞焦亡过程中均发挥保护效应[6]。2020年,Hu等[6]进一步发现,Bay11-7082还可通过共价修饰人/小鼠GSDMD的Cys191/Cys192位点进而抑制其活化后的膜打孔过程,通过直接抑制焦亡执行蛋白GSDMD发挥抗焦亡效应。本研究在C3a/C5a致足细胞损伤模型及PHN大鼠肾组织中均观察到,Bay11-7082有效抑制NF-κB及其下游NLRP3-ASC-Caspase-1-IL-18/GSDMD焦亡信号通路的活化,并可显著抑制GSDMD(N)的膜转位,在体内外足细胞损伤过程中发挥抗焦亡保护效应,该结果展现了Bay11-7082在MN治疗中的应用前景。当然,也应指出,由于Bay11-7082对NF-κB与焦亡信号通路抑制的多重性,不应忽视本研究中Bay11-7082肾脏保护效应的“多重机制”,因既往研究显示,NF-κB信号通路过度活化本身即参与到MN肾脏损伤的机制中,抑制NF-κB亦见肾脏保护效应[15-17]。同时,焦亡信号通路也并非MN中NF-κB过度活化致肾组织损伤的唯一信号通路。因此,本研究观察到的肾脏保护效应可能是Bay11-7082抗NF-κB与抗焦亡效应的综合。此外,本研究在Bay11-7082的剂量探索中发现,PHN大鼠难以耐受10 mg/(kg·d)及以上剂量的Bay11-7082干预,多数模型鼠于给药后一周内死亡,因此,更优化的剂量仍是未来应用Bay11-7082于MN治疗中需探索的问题。
综上所述,本研究证实Bay11-7082可通过抑制焦亡减轻补体介导的MN肾小球足细胞损伤,为MN的治疗提供了新的思路。

