细胞G2/M周期阻滞与肾间质纤维化
柳敏娜 刘天龙 综述 席春生 审校
慢性肾脏病(CKD)是以肾脏结构损伤或功能下降为特征的常见慢性疾病[1]。随着人口老龄化和糖尿病、高血压等患病率的增长,CKD进展到终末期肾病的人群逐年递增,其发病率高达10%~15%,已成为严重威胁人类健康的全球公共卫生问题[2]。肾间质纤维化是CKD进展至ESRD的共同病理表现,以肌成纤维细胞增殖及细胞外基质过度沉积为主要特征,导致肾脏功能随时间进行性下降[3]。肾间质纤维化病理机制复杂,深入研究其关键的分子靶点,有助于全面认识该疾病的病理特征和研发安全有效的治疗药物。2010年,哈佛医学院Yang等[4]在《Nature Medicine》上首次发现肾小管上皮细胞(TEC)G2/M周期阻滞与纤维化之间存在因果关系。随后诸多研究均证实G2/M周期阻滞可导致肾间质纤维化的发生和进展,是CKD的重要细胞事件[5]。本综述旨在系统阐述细胞G2/M周期阻滞与肾脏纤维化之间的相关研究进展,为CKD的临床诊治和新药研发提供思路。
细胞周期调控
细胞周期过程完整的细胞周期包括G0、G1、S、G2和M期。细胞周期的正常推进是确保子代细胞遗传一致性的关键,然而这一过程中细胞进行着复杂活跃的分子水平变化,容易受内外环境的影响。为确保细胞周期中DNA复制和染色体分配的准确性,机体存在一套反馈调节机制,即细胞周期检查点[6]。不同检查点发挥不同生理作用:G1期检查点主要监测细胞体积是否足以进入S期,S期检查点主要监测DNA是否有损伤,G2期检查点主要监测有丝分裂前所有准备是否完成,M期检查点主要监测染色体是否准确分配到纺锤体两极[7]。在以上检查点中,G1/S和G2/M检查点尤为重要。如果前一步骤未顺利完成,检查点会将细胞周期阻滞在该阶段,即发生细胞周期阻滞。
细胞周期调控蛋白细胞周期的进展有赖于细胞周期蛋白(Cyclin)和周期蛋白依赖性激酶(CDK)的精确调控[8]。其中Cyclin包括Cyclin A/B/D/E四个亚型,CDK包括1/2/4/6四个亚型。生理条件下,不同类型Cyclin与CDK形成异二聚体复合物,激活CDK并进一步活化下游底物,实现对细胞周期的调控[9]。当Cyclin D与CDK 4/6相结合时,可使下游底物蛋白pRb发生磷酸化,细胞处于G1期。在G1后期,Cyclin E与CDK 2结合,使pRb磷酸化水平进一步升高,细胞进入S期。处于S期的细胞内Cyclin A与CDK 2结合,推动细胞进入G2期。G2初期Cyclin A与CDK 1结合,而在G2后期,Cyclin B与CDK 1结合促进细胞进入M期调控有丝分裂。以上过程中,Cyclin B-CDK 1复合物是G2/M期的总开关,精确调控G2/M期转化。
除以上正性调控蛋白外,细胞周期还受一系列负性调控蛋白制约,主要包括CDK4抑制剂(INK4)家族(p15、p16、p18和p19)和Cip/Kip家族(p21、p27和p57)。这些负性调控蛋白与Cyclins-CDKs复合物结合,抑制其对下游底物的活化。p21在G2/M期调控中发挥重要作用,当细胞受到不良刺激后,p21和p53表达会升高,抑制Cyclin B-CDK 1复合物的活性,使细胞发生G2/M期阻滞[10]。细胞周期及相应调控蛋白见图1。
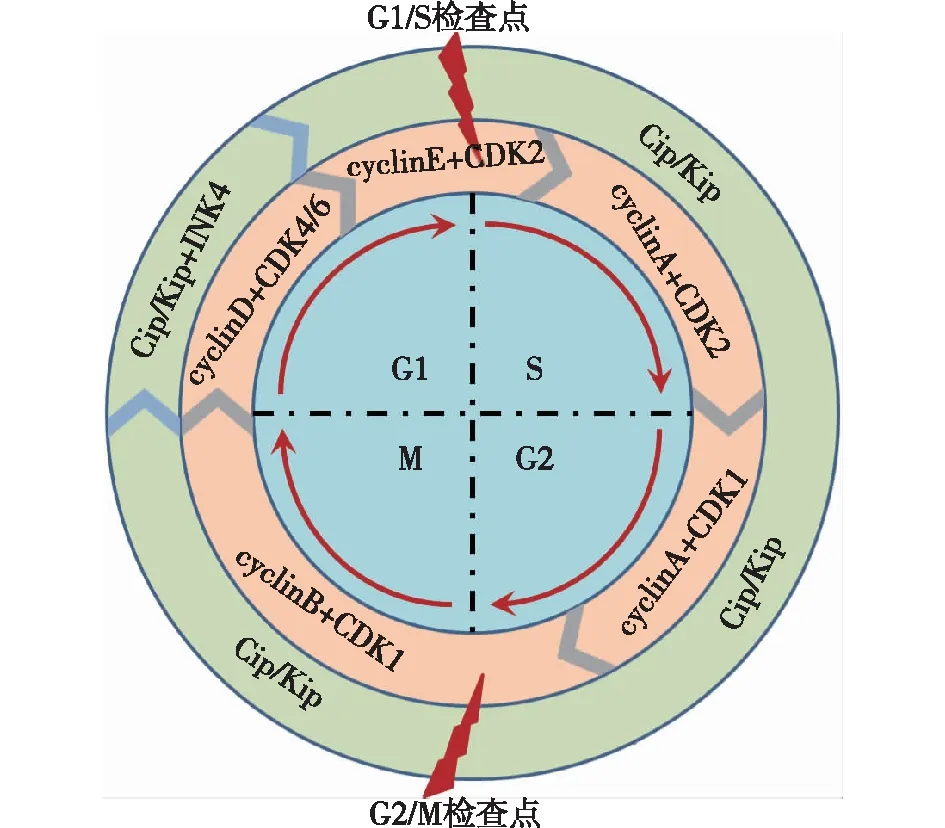
图1 细胞周期及相应正负调控蛋白
细胞周期阻滞的检测在临床诊断和体内研究中,由于组织样本的特殊性,一般采用免疫染色法进行细胞周期检测。其中,5-溴脱氧尿嘧啶(BrdU)和5-溴-2-脱氧尿嘧啶(EdU)为胸腺嘧啶类似物,能够在细胞S期替代胸腺嘧啶掺入正在复制的DNA中,用来检测G1/S期阻滞情况[11]。组蛋白3(H3)的Ser10磷酸化是有丝分裂期的特征性事件,使用磷酸化H3(p-H3)抗体进行免疫染色可分析G2/M期阻滞情况[12]。体外研究中,除以上免疫染色方法外,常用流式细胞术检测处于各调控周期的细胞比例,确定细胞周期阻滞。此外,还可通过免疫印迹法分析特定细胞周期调控蛋白的表达情况,以此判定细胞周期阻滞[13]。
细胞周期调控与肾间质纤维化
生理条件下,TEC低频率(<1%)进行细胞周期循环,以维持正常细胞更新[14]。当肾脏受到内外环境影响,如轻度肾小管损伤时,细胞分裂活动被激活,大量上皮细胞进入细胞周期以加速增殖,确保肾单位结构和功能的及时修复。在此过程中,分裂按照细胞周期依次精确进入和退出每一期。如在某一期出现阻滞,则会对修复过程产生干扰[15]。细胞周期阻滞在急性肾损伤(AKI)向CKD转变中发挥重要作用。
G1/S周期阻滞与AKI细胞周期调控有智能的正负反馈调节机制,短暂的周期阻滞是一种保护机制。细胞在G1期的短暂阻滞,会以凋亡的方式停止紊乱的分裂活动[16]。而当细胞持续性阻滞在G1/S期,由于DNA等物质的大量合成,导致细胞出现肥大和衰老,释放炎性因子,加重肾脏损伤。研究发现[17],在AKI模型中,TEC中细胞周期负性调控蛋白表达升高,产生G1/S阻滞,增强细胞对损伤的抵抗。类似地,用CDK4/6抑制剂处理细胞可诱导G1/S阻滞以减轻肾损伤。与细胞周期G1/S阻滞相关的金属蛋白酶组织抑制剂2(TIMP-2)和胰岛素样生长因子结合蛋白7(IGFBP-7),在AKI早期迅速升高,可作为临床检测早期AKI的标志物。
G2/M周期阻滞与肾间质纤维化在损伤严重或者发生慢性损伤时,常规修复活动可能出现不适应的情况[18]。不适应的修复会导致肾脏组织结构和功能无法完全恢复,小管表现出病理信号、旁分泌和自分泌活性。研究证实,TECs发生G2/M期阻滞是导致AKI后异常修复和肾纤维化的重要驱动因素。停滞在G2/M期的细胞可促进转化生长因子β1(TGF-β1)、结缔组织生长因子(CTGF)、Ⅳ型胶原蛋白(COL4)及α平滑肌肌动蛋白(α-SMA)等的分泌,促使成纤维细胞激活和增值,同时诱导TECs发生转分化为成纤维细胞,并分泌大量的细胞外基质,最终促进间质纤维化的发生和发展[19]。研究表明[20],处于G2/M期阻滞的细胞百分比与纤维化程度呈正相关。通过不同方式使细胞克服G2/M期阻滞,在损伤阶段维持细胞周期的正常进展,是延缓和治疗肾间质纤维化的重要途径。
G2/M周期阻滞参与肾间质纤维化的机制
如前所述,由于内外环境稳态的变化,细胞周期出现阻滞可导致肾间质纤维化的发生。此过程涉及复杂的信号通路互作(Cross-talk)调控。一方面,损伤发生时,可激活体内相关因子,进而通过一系列信号级联反应干扰细胞周期调控蛋白的表达。细胞周期出现阻滞后,诱发下游纤维化因子的产生,导致肾脏纤维化的发生和进展。另一方面,肾脏纤维化的发生,会通过反馈调节机制,进一步影响细胞周期的调控,改变纤维化进程。当前研究主要涉及以下相关机制(图2)。
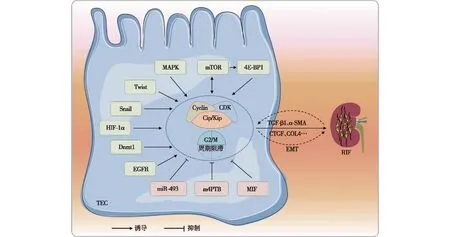
图2 细胞G2/M周期阻滞参与肾脏纤维化的信号通路
促分裂素原活化蛋白激酶(MAPK)途径MAPK链是细胞中信号传递网络中的重要途径之一,有ERK1/2、JNK、p38MAPK和ERK5等四个主要的亚族。Chen等[21]发现从间充质干细胞中提取的微泡可通过ERK1/2信号途径使细胞G2/M周期阻滞消除,改变上皮间质转化和细胞周期相关蛋白的表达水平,从而改善肾纤维化。Yang等[4]发现G2/M阻滞的近端肾小管细胞中JNK信号通路被激活并促纤维化细胞因子的产生,用JNK抑制剂绕过G2/M期阻滞,可缓解纤维化进展。有学者发现马兜铃酸可导致ERK1/2和p38的活化,进而激活DNA损伤检查点ATM-Chk2-p53-p21通路,诱导细胞阻滞于G2/M期,最终促进纤维化的发生[22]。
自噬途径自噬是一种高度保守的溶酶体降解途径,在维持肾脏细胞内稳态方面发挥重要作用,自噬功能障碍与各种肾脏疾病的发病机制有关[23]。Narita等[24]曾提出雷帕霉素(TOR)-自噬空间耦合室靶细胞(TASCC)的概念,这是一种具有分泌表型的细胞形态。近期有研究提示[25],细胞周期蛋白G1通过促进TECs的G2/M阻滞发生,诱导TASCC的形成,进而导致促纤维因子的分泌和肾脏纤维化的进展。4E结合蛋白1(4E-BP1)是自噬途径中mTOR的下游底物蛋白,有学者在肾纤维化动物模型中,发现TECs中4E-BP1蛋白磷酸化水平升高[26],同时伴随G2/M阻滞发生。在4E-BP1被干扰后,G2/M期细胞数量和纤维化因子水平均降低。这表明抑制4E-BP1磷酸化可能缓解肾小管细胞G2/M期阻滞和肾间质纤维化。
Twist1/Snai1途径上皮-间充质转化(EMT)是肾纤维化的重要原因之一,Sun等[27]发现Twist1和Snai1在肾脏纤维化EMT中扮演重要角色。Twist1和Snai1的过表达可促进TGF-β1诱导的TEC出现G2期延长,限制细胞修复和再生的能力。在肾纤维化小鼠模型中,近端TEC中Twist1或Snai1的条件性缺失可抑制EMT进程,维持TEC的完整性,同时也恢复了肾实质修复和再生并减轻间质纤维化[28]。另一项研究在纤维化动物模型中过表达Snail1后,细胞G2/M周期阻滞和随着纤维化显著增强。进一步机制研究发现,Snail1通过调控核因子κB(NF-κB),促进肾间质细胞EMT的发生,进而促进纤维化进展[29]。
p53/p21途径抑癌基因p53在体内分布广泛,发挥十分重要的生理作用。其作为p21转录的调节因子,可抑制细胞周期进程,导致G2/M细胞聚集,激活促纤维化TGF-β和CTGF介导的信号通路,引起细胞外基质生成和纤维化。单侧输尿管结扎(UUO)小鼠模型中,损伤的初始阶段p21表达迅速升高,而在损伤后期p21逐渐降低。在构建的p21缺陷转基因小鼠中纤维化程度则加重。因此在肾脏损伤的初始阶段,p21使肾小管细胞通过阻滞于G2期,发挥肾脏保护作用[30]。Liu等[13]通过体内外研究发现,在TECs缺氧发生时,缺氧诱导因子1α(HIF-1α)活化并诱导p53表达上调。p53的上调进一步抑制CDK1和cyclinB1/D1的表达,导致细胞G2/M周期停滞。而在特异性下调p53后,细胞G2/M阻滞和纤维化的发生显著缓解。
其他途径研究表明,HK-2细胞在缺氧后miR-493表达升高,而miR-493的过度表达可降低细胞周期调节器STMN-1的表达,并增加G2/M期细胞和促纤维化因子的比例,这表明miR-493/STMN-1通路可通过调控细胞周期阻滞影响肾脏纤维化进展[12]。有研究将组蛋白脱乙酰酶抑制剂m4PTB用于AKI小鼠的治疗,发现m4PTB可通过减少G2/M期细胞数量,加速细胞恢复,减少损伤后的间质纤维化[31]。此外,小鼠肾脏缺血后表皮生长因子受体(EGFR)激活,导致细胞周期G2/M阻滞,促进了纤维化的发生发展[32]。一项表观遗传修饰对纤维化进展的研究发现,大鼠肉瘤蛋白激动剂类似物1(RASAL1)的高甲基化与肾脏中成纤维细胞活化和纤维化的持续存在有关。RASAL1的高甲基化由甲基转移酶Dnmt1介导,而Dnmt1(+/-)杂合子小鼠肾纤维化程度缓解[33]。在不同肾脏损伤模型中,巨噬细胞迁移抑制因子(MIF)在TECs中表达降低,肾小管细胞特异性敲除MIF可导致G2/M周期阻滞发生,进而加重纤维化程度[34]。
小结:肾间质纤维化是CKD到ESRD的共同通路,然而目前临床没有针对肾脏纤维化的有效药物。近些年诸多高质量研究提示细胞G2/M周期阻滞与肾间质纤维化的发生和进展密切相关,靶向G2/M周期阻滞成为逆转肾脏纤维化的重要途径。目前已有多种细胞周期阻滞标志物用于临床诊断,为各种急/慢性肾脏病的早期预防和治疗提供了重要指导。在后期研究中,一方面应该注重对G2/M周期阻滞调控肾间质纤维化的分子机制进行更深入的挖掘,以期找到其核心调控靶点。另一方面,针对G2/M细胞周期的调控机制,进行相关抑制剂的活性筛选研究,为抗肾间质纤维化的新药研发奠定基础。

