羟氯喹治疗IgA肾病的研究进展
魏凯悦 米 焱 综述 王彩丽 审校
IgA肾病(IgAN)是全球最常见的原发性肾小球疾病,也是导致慢性肾衰竭的主要原因之一,20%~40%患者在10~20年之内发展为终末期肾病[1],严重危害患者的生命,给社会和家庭带来沉重的经济负担。IgAN临床表现多样,主要为持续无症状镜下血尿或肉眼血尿,可伴有不同程度的蛋白尿和高血压,严重者会出现肾功能衰竭。组织病理学表现为半乳糖缺陷型IgA1(Gd-IgA1),伴有补体C3、IgG和IgM共沉积于肾小球系膜区。目前对IgAN患者主要采取肾素-血管紧张素-醛固酮系统抑制剂(RASSi)等保护肾脏功能、或联合激素和(或)免疫抑制剂等治疗,但仍有一些患者治疗效果差,出现明显副作用。羟氯喹(HCQ)是在奎宁的基础之上开发的一种新型抗疟药,作为经典老药,用于狼疮性肾炎取得了好的疗效[2]。因其免疫调节作用受到广泛认可,有学者认为HCQ可以用于IgAN的治疗,多项研究已证实HCQ能够减少IgAN患者的蛋白尿,和糖皮质激素相比,具有较好的依从性和较少的副作用,得到肾脏病临床医师的认可。本综述从以下几个方面剖析HCQ与IgAN之间的联系。
IgAN的发病机制
IgAN的发病是由Gd-IgA1沉积于肾脏后激活一系列炎症反应引起的肾脏损伤。学者将此过程称之为经典的“四步打击”学说。第一步:循环血中Gd-IgA1的形成[3];第二步:特异性抗体IgG、IgA的形成;第三步:Gd-IgA1与IgG、IgA形成循环免疫复合物;第四步:Gd-IgA1-IgG、Gd-IgA1-IgA等免疫复合物沉积于肾小球系膜细胞,引起肾脏损伤。
Gd-IgA1与IgAN的相关性成为近几年研究的热点话题,多项研究表明血清Gd-IgA1与IgAN的临床表现和肾脏病理的严重程度相关。但引起Gd-IgA1形成的机制尚未完全明确。Toll样受体(TLRs)可能参与IgAN的致病,如TLR4、TLR7、TLR8、TLR9等[4],由于IgAN常伴有上呼吸道感染的前驱病史,病原体结合TLR受体,刺激促炎因子的产生,导致Gd-IgA1的形成。B细胞活化因子(BAFF)和增殖诱导配体(APRIL)也参与了B细胞免疫反应中Gd-IgA1的过度表达,另外T细胞及其细胞因子,尤其是白细胞介素4(IL-4)、IL-6、IL-17、IL-21均能够刺激Gd-IgA1的产生[5]。
补体激活在IgAN中的作用受到广泛认可,部分IgAN患者肾穿病理标本中可见C1q少量沉积,最新研究表明C1q与IgG、IgM的共沉积可能通过激活C2、C3、C4启动补体经典途径,参与IgAN的致病[6-7],由于IgAN的系膜区常伴有备解素、补体因子C3、C4、补体因子H(CFH)和H相关蛋白(CFHR)的沉积[8],推测补体替代途径(AP)和凝集素途经(LP)在IgAN的肾脏损伤中发挥至关重要的作用[9]。作为LP途径的关键成分,血清甘露糖结合凝集素相关丝氨酸蛋白酶3(MASP3)和MASP2在IgAN的疾病进展中均起作用[10]。未来有望成为IgAN的新型无创生物标志物,为寻找新的治疗靶点提供可靠依据。
HCQ治疗IgAN的可能机制
抑制抗原提呈,干扰TLRs信号传导TLRs是先天免疫的重要模式识别受体,先天免疫是机体抵抗病原体入侵的第一道防线。当机体受到微生物、病毒或细菌入侵时,可识别病原体相关分子模式,激活机体免疫反应,诱导细胞因子的产生和分泌。研究表明在IgAN中,TLR9能够刺激树突细胞中BAFF的过度表达,诱导APRIL和IL-6的表达,在APRIL和IL-6的协同或单独作用下促进Gd-IgA1的产生[11]。临床发现外周血单个核细胞中TLR9水平与血清Gd-IgA1的表达水平升高有关,也支持了上述分子机制。研究表明TLR4可能通过与肾小球系膜细胞结合,诱导TLR4的表达,进一步激活髓样分化因子88(MyD88)-核因子κB(NF-κB)信号通路导致肿瘤坏死因子α (TNF-α)、IL-6、IL-8、IL-1β、单核细胞趋化蛋白1(MCP-1)的产生,调节Gd-IgA1的浓度[12-13]。福建医科大学林森钦等的研究结果显示敲除大鼠BAFF基因可以减少IgAN中TLR4活化与TGF-β1的表达,进而降低24 h蛋白尿和血清肌酐,减轻肾脏损伤[14]。最新研究发现TLR7能够通过MyD88依赖性信号通路,刺激B细胞增殖、免疫球蛋白的分泌和细胞因子的产生,包括IL-6、IL-12、IL-1β,同时TLR7的过表达能够增加Gd-IgA1的水平[15]。以上研究说明TLRs信号传导参与IgAN的发病过程。由于TLR的激活和下游的信号传导只在酸性环境中进行,HCQ具有弱碱性,能提高细胞内的PH值,破坏其酸性环境,干扰TLRs(如TLR4、TLR7、TLR9)与其配体结合,进一步抑制TLRs的信号传导[16-18](图1),减少细胞因子的产生,减轻IgAN患者肾脏的损伤程度。另外中国医科大学李优等发现TLR4参与IgAN大鼠肾内炎症的发生,提示TLR4的表达与肾内IgA沉积有关,同时HCQ能够通过降低TLR4的水平,抑制IgAN大鼠肾脏系膜细胞增生和减轻纤维化,减少Gd-IgA1的沉积,抑制免疫反应减少肾损伤,进一步证实以上推论[19]。
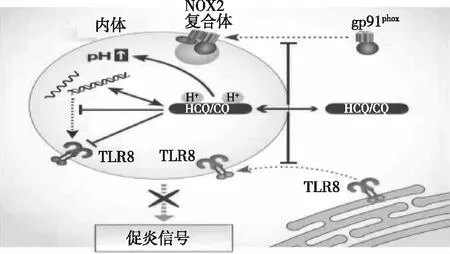
图1 HCQ通过抑制抗原提呈干扰TLRs信号传导[18]
抑制抗原加工,阻断T细胞活化T细胞及其细胞因子,尤其是Th2细胞、Th17、Th22、Tfh在IgAN的发病机制中发挥重要作用。IL-4、IL-6、IL-17、TGF-β能够抑制β-1,3半乳糖基转移酶(C1GALT1)及其特定分子伴侣Cosmc的表达,改变IgA1的正常结构,促进Gd-IgA1的表达。IL-21通过上调B细胞中胞甘脱氨酶的过表达,在B细胞分化为浆细胞期间介导IgA的类别转换[20]。IL-6表达水平是IgAN患者的预后影响因素,IL-6能够诱导肾小球系膜细胞的增殖和足细胞的凋亡,促进细胞外基质产生,调节血管内皮细胞功能,破坏肾组织[21]。在动物试验中IL-12能够诱导干扰素γ(INF-γ)的产生,促进肾组织中新月体的形成[22]。HCQ抑制浆细胞样树突状细胞对自身抗原的加工和Ⅱ类MHC与抗原肽的结合,阻断T细胞的活化、分化和共刺激分子的表达,进而减轻IgAN患者体内的自身免疫反应;另外HCQ能重新平衡Th17和调节性T细胞(Treg)的细胞数量,降低促炎细胞因子水平,增加抗炎细胞因子产生,进一步抑制自身免疫反应[18](图2)。
抑制NADPH氧化酶信号传导,减少促炎因子NADPH氧化酶(NOX)是体内广泛分布的一种膜蛋白,是体内唯一产生活性氧簇(ROS)的酶,参与多种促炎症信号级联反应,比如TNF-α和IL-1β诱导的炎症级联反应。四步打击学说中第四步循环免疫复合物形成后沉积于肾小球系膜细胞,诱导促炎因子的产生,破坏肾脏正常组织。Müller-Calleja等[23]研究发现HCQ能够抑制单核细胞中NOX介导的信号级联反应减少下游促炎症因子IL-8、TNF-α的产生,而促炎因子的诱导依赖于NOX刺激产生的ROS对核因子κB在(NF-κB)的激活。Bai等[24]研究发现HCQ能够抑制NF-κB信号和NLRP3炎症相关蛋白的表达,减少促炎因子(IL)的释放,改善IgAN大鼠肾脏功能。因此HCQ治疗IgAN可能是通过干扰NOX的信号传导,减少ROS的产生,进一步阻碍NF-κB/NLRP3的活化,抑制促炎因子产生,这对监测IgAN的预后具有重要价值(图2)。
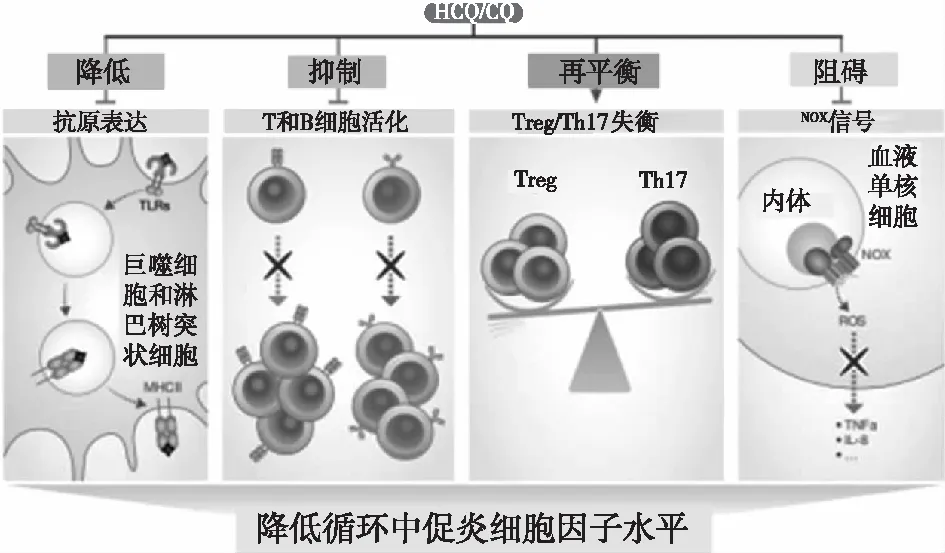
图2 HCQ通过减少炎症因子产生的机制[18]
抑制自噬体与溶酶体融合,减轻足细胞损伤梁世凯等[25]研究发现与正常对照组相比,IgAN患者足细胞自噬体数量明显减少,差异有统计学意义,提示自噬抑制可能导致足细胞过度增殖,引起肾脏病理损伤。HCQ通过细胞质膜,阻断自噬体与溶酶体的融合,导致自噬体在细胞质中蓄积,有助于增强自噬体介导的信号输出[26],增强足细胞自噬功能,减轻足细胞过度增殖(图3),进而缓解IgAN患者症状。同时HCQ能够提高溶酶体内的PH值,干预溶酶体的酸化,进而影响自身抗原在抗原提呈细胞(APC)中的加工处理,减轻IgAN患者体内的自身免疫反应。
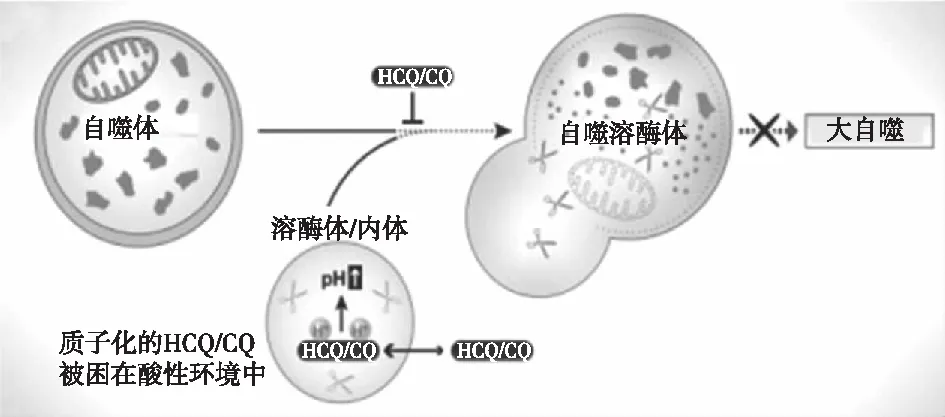
图3 HCQ抑制自噬与溶酶体融合,减轻足细胞损伤[18]
HCQ治疗IgAN的临床效应
HCQ属于4-氨基喹啉类磷脂酶A2抑制剂,在1955年经过美国食品药品管理局批准用于系统性红斑狼疮的治疗,现已成为系统性红斑狼疮的首选药,主要用于皮肤狼疮患者,同时可以降低患者晚期骨质疏松和动脉粥样硬化的发生率,减少器官损伤。具有广泛的免疫调节作用,能够通过调节免疫系统、抑制促炎因子的释放等机制缓解患者的症状。近年来,随着对HCQ研究的不断深入,发现许多新的临床应用价值,如间质性肺炎、抗磷脂抗体综合征、艾滋病、难治性肾病综合征和肿瘤等。研究表明HCQ对新型冠状病毒肺炎有一定的作用[27],可能是因为新型冠状病毒肺炎患者体内存在许多细胞因子,HCQ属于亲脂类弱碱性药物,很容易通过细胞膜,破坏细胞器生存的酸性环境,影响细胞器的正常功能,进而减少细胞因子的产生,缓解患者的症状。另外HCQ用于IgAN的治疗也受到肾内科医生的广泛认可。中国一项对照试验结果显示IgAN患者HCQ组蛋白尿减少的百分比(43%)显著高于单独使用RASSi组的百分比(19%),表明在RASSi基础上加用HCQ显著且安全地降低了IgAN患者的蛋白尿[28]。西南医科大学刘密迦等研究发现IgAN患者在优化的支持治疗、激素、免疫抑制剂治疗的基础上,加用HCQ组的蛋白尿下降率(36.59%)明显高于未用HCQ组(15.49%)[29]。王超超等[30]发现常规RASSi治疗组蛋白尿缓解率为18.75%,HCQ治疗组为56.25%,可见与常规RASSi治疗组相比,HCQ可增加蛋白尿缓解率,减少蛋白尿的排泄,差异有统计学意义。以上研究均证实HCQ对IgAN有明显的治疗作用。
HCQ治疗IgAN的优势及注意事项
IgAN现有治疗方案主要是使用RASSi等药物对症治疗,减少患者蛋白尿,同时控制血压,延缓疾病进展。对于疾病活动期患者,糖皮质激素和免疫抑制剂也发挥一定作用,但有部分患者用糖皮质激素之后未见明显成效,反而出现严重的副作用,因此目前临床上是否用糖皮质激素存在一定争议,HCQ的应用为临床医师提供了新思路。Tang等[31]研究发现对于使用糖皮质激素治疗后蛋白尿仍保持在1 g/d以上的患者,加用HCQ能减少蛋白尿,减轻肾脏损伤。北京大学第一医院的一项病例对照研究结果显示HCQ组治疗6月后蛋白尿减少48.5%,糖皮质激素组减少62.9%,虽然HCQ减少蛋白尿的作用在6月内略逊于糖皮质激素,但糖皮质激素组有6.5%的患者出现严重不良事件,包括肺孢子菌肺炎、需要住院治疗的严重感染、胃肠道出血、高血糖,而HCQ组未观察到严重不良事件。由此证明HCQ治疗IgAN比糖皮质激素更加安全[32]。由北京大学张宏、吕继成牵头组织的国际多中心临床试验IgAN全球类固醇治疗评估(TESTING)研究发现,IgAN患者糖皮质激素治疗半年后蛋白尿完全缓解率为7.8%,部分缓解率为45.1%,能延缓肾小球滤过率的降低,但是在带来显著疗效的同时,有14.7%的患者出现严重不良反应(主要是严重感染),需要谨慎使用和采取预防感染措施[33]。以上研究均支持在IgAN患者治疗过程中,使用HCQ比糖皮质激素更有优势。
如前所述,HCQ的临床应用比较安全,但其不良反应仍不能忽视。HCQ起效时间长、作用时间久,口服吸收迅速,其血药浓度达峰时间约2~4.5 h,平均生物利用度约为74%,血浆蛋白结合率约为50%,约50%的HCQ经过肝脏代谢,42%经肾脏代谢,25%~50%的HCQ以原型药物从肾脏排出体外,HCQ的半衰期较长,其血浆终末半衰期为(50±16)d,全血为(44±12)d。在临床应用时,建议对于估算的肾小球滤过率(eGFR)<30 mL/(min·1.73 m2)的患者减少50%的剂量[34]。HCQ主要的不良反应包括视网膜病变、心脏毒性、消化系统疾病(恶心、呕吐)和皮肤黏膜病变等[35],其中视网膜病变虽然发病率不高,但其会引起视网膜脱落失明,后果严重。引起视网膜病变的危险因素包括(1)疗程>5年;(2)剂量>5.0 mg/(kg·d);(3)合并肝肾疾病及肥胖。因此,IgAN患者使用HCQ时建议每年进行一次眼科检查,随时调整用药,防止不良反应的发生。
小结:研究发现,HCQ可能通过干扰TLRs信号传导、阻断T细胞活化、抑制NADPH氧化酶信号传导、阻碍自噬体与溶酶体结合等机制,用于IgAN的治疗。目前国内外研究均证实HCQ能降低IgAN患者的蛋白尿,但未来仍有待于进一步的基础和临床研究证实其具体分子机制和疗效。

