一种新型钴铁双金属配合物的合成及其晶体结构
蔡幸然, 徐 芬, 孙立贤, 郭晓磊, 韦思跃, 张晨晨, 吴 怡,廖鹿敏, 魏 胜, 程日光, 管彦洵, 李 彬
(桂林电子科技大学 材料科学与工程学院,广西 桂林 541004)
人类对传统化石能源的过量使用不仅导致化石能源几近枯竭,而且排放的大量CO2所带来的环境问题已成为人类社会发展的一大阻碍。因此,控制和减少CO2的排放,增加CO2的循环利用,从而减少其对气候变化的影响,成为未来高新技术必须攻克的难题。CO2的光催化还原技术可一步完成对太阳能的转换与存储,实现CO2的有效利用,减少CO2排放[1-3]。
过渡金属配合物作为光催化剂,在还原CO2过程中,CO2可被高选择性地还原为CO或者HCOOH等[2-8]。1986年,Jeannot课题组[8]首次合成了一系列过渡金属配合物{[Re(bpy) (CO)3X],X=Cl或Br},并将其作为均相催化剂使用在光催化还原CO2中,用于选择性地、持续地将CO2通过光化学或电化学催化还原为CO。在过量的Cl-离子存在下,测得底物转化效率为14%、法拉第效率为98%,开拓了光催化还原CO2的新篇章,成为过渡金属配合物应用于光催化CO2领域的里程碑。Ryo等[9]使用介孔石墨氮化碳(C3N4)与RuII双核络合物偶联,在可见光(λ> 400 nm)条件下,将CO2还原为HCOOH,选择性可达74%,即使在水溶液中也具有很高的耐久性。用Ag纳米粒子对C3N4进行修饰制备的RuRu′/Ag/C3N4光催化剂表现出很高的周转率(TON>33 000),同时保持了对HCOOH的高选择性(87%~99%)。
但是,贵金属的生产使用成本很高,因此不适合大规模推广使用。而随着对非贵金属配合物研究的深入,发现非贵金属形成的配合物也可进行光催化还原CO2,且性能可观[10]。Chen等[11]研究了CoII络合物[CoII(L)](ClO4)2和FeIII络合物[FeIII(L)Cl2](ClO4)(L为五齿N5配体)的光催化性能,结果表明该催化系统对CO2的还原具有很高的选择性和效率,且在22 h后获得了270的周转数(turnover number,简称TON,以CO的摩尔数除以催化剂的摩尔数计算)。TON随时间的变化在8 h内呈线性增长(TOF=21.9 h-1),表明系统具有良好的稳定性。该研究中获得的TON和周转率(turnover frequency,简称TOF)与使用更昂贵的光催化剂获得的催化效率相当,甚至更高。
基于Fe、Co基配合物的光催化性能表现较为突出,选取Co2+、Fe3+两种金属离子作为节点。一氧化碳与吡啶是很好的π酸配体,能够稳定过渡金属的低氧化态,故选取1,10-菲啰啉(phen)、2,6-吡啶二羧酸(DPC)两种配体。借助水热合成法制备了一种双金属钴铁配合物[Co(phen)3·Fe(phen)3·2Co(DPC)2·2Fe(DPC)2]·2H2O,并测定了其晶体结构。
1 实验部分
1.1 仪器与试剂
实验使用的仪器有德国Bruker公司的Bruker AXS SMART APEX II CCD型单晶衍射仪和美国Thermo Fisher Scientific公司Nicolet 6700型红外光谱仪(KBr压片法)。所用试剂和原料直接使用,未进一步提纯,均为分析纯,购自国药集团。
1.2 配合物[Co(phen)3·Fe(phen)3·2Co(DPC)2·2Fe(DPC)2]·2H2O的合成
将六水合硝酸钴0.29 g(1 mmol)和九水合硝酸铁0.40 g(1 mmol)溶于8 mL去离子水中,得到A溶液;称取邻菲罗啉(1,10-phen)0.396 g(2 mmol)和2,6-吡啶二甲酸(DPC)0.336 g(2 mmol),溶于8 mL乙醇中,得到B溶液。待溶质溶解完全后,将A和B两种溶液混合移至玻璃锥形瓶中,用保鲜膜封口,匀速搅拌反应1 h。将反应液转移至反应釜的内衬中,温度设定在120 ℃,反应72 h。待反应完成后,让反应釜温度缓慢冷却至室温,将产物用反应溶剂过滤洗涤,自然干燥,得到红色块状晶体,产率为59%(基于Co2+、Fe3+),分子式为C128H76O34N20Co3Fe3。
2 结果与讨论
2.1 红外分析
由红外光谱图(见图1)分析可知:3 442 cm-1处强而宽的吸收带是由分子中结晶水的O-H伸缩振动所造成。根据文献[12]可知,峰变宽且向低波数移动的现象归因于氢键的缔合作用。在1 672、1 384 cm-1处的吸收峰分别来自νas(COO-)和νs(COO-);在1 672、1 595和1 321 cm-1处的吸收峰属于DPC配体的特征峰;在1 422 cm-1及982~843 cm-1处的吸收峰属于1,10-phen配体的特征峰。配合物吸收峰相比配体吸收峰的峰位置均发生了漂移,表明配体和金属离子发生了配位反应。

图1 配合物和配体的红外光谱图
2.2 配合物的晶体结构
挑选一颗无明显缺陷,尺寸大小为0.16 mm × 0.10 mm × 0.06 mm的晶体置于单晶衍射仪上,测试温度为293 K,采用石墨单色Mo-Kα射线为衍射光源(λ=0.710 73 Å),记录该晶体的数据。用SHELTXS-97程序解析晶体结构,用SHELXL-97程序通过全矩阵最小二乘法对非氢原子和氢原子的温度因子进行精修[13-14]。将得到的主要晶体学数据、键长和键角分别列于表1和表2,其中,
R1=Σ‖Fo| - |Fc‖/Σ|Fo|,
wR2=[Σw(Fo2-Fc2)2]/[Σw(Fo2)2]1/2。
根据单晶X射线衍射数据,所合成的配合物 [Co(phen)3·Fe(phen)3·2Co(DPC)2·2Fe(DPC)2]·2H2O属于三斜晶系、P1空间群,如图2所示,由3个Co2+、3个Fe3+、8个2,6-PDC、6个1,10-phen和2个自由水分子构成了配合物的最小不对称单元。Co2+和Fe3+与配体的配位方式基本一致,为六配位;

表1 配合物的晶体学数据和精修参数

表2 配合物的主要氢键键长和键角
在不对称单元内,Fe1离子与3个phen配体(N9、N10、N11、N12、N13、N14)配位,Fe2离子与2个DPC配体(O11、O12、O15、O16、N3、N4)配位,Fe3离子与2个DPC配体(O19、O21、O23、O24、N7、N8)配位;Co4离子与2个DPC配体(O3、O4、O7、O8、N1、N2)配位,Co5离子与3个phen配体(N15、N16、N17、N18、N19、N20)配位,Co6离子与2个DPC配体(O27、O28、O31、O32、N5、N6)配位,均构成畸形的八面体结构。Co—O和Co—N的键长分别为1.985(7)~2.032(8)Å、1.974(8)~ 2.080(8)Å。Fe—O和Fe—N的键长分别为1.981(7)~2.030(8)Å、1.997(7)~2.078(8)Å。此外,O—Co—O键、N—Co—N和O—Co—N的键角分别为91.8(3)°~152.2(3)°、82.1(3)°~174.2(3)°和75.4(3)°~117.4(3)°。O—Fe—O键、N—Fe—N和O—Fe—N的键角分别为92.2(3)°~152.8(4)°、81.6(3)°~175.4(3)°和75.6(3)°~118.1(3)°。
可见,该配合物超分子结构由吡啶环和菲啰啉环结构堆积区域的π-π作用力、C—H…O氢键和分子之间的静电力相互作用建立[15]。在晶体结构中,单胞内分子通过C—H…O(C51—H51…O25、C81—H81…O28、C137—H137…O21)氢键和π-π作用力连接;单胞间通过π-π作用力和C—H…O(C2—H28…O10、C82—H82…O11)氢键形成一维链(如图3所示),通过C—H…O(C38—H38…O15、C92—H92…O9、C111—H111…O26、C153—H153…O2W、C156—H156…O2、C178—H178…O32)氢键形成二维面。苯环结构堆积区域会形成π-π堆积作用,三维网络结构由面间的π-π堆积作用形成[15-17](如图4所示)。
3 结束语
采用水热法,以DPC、phen 2种螯合型配体与过渡金属Co2+和Fe3+在同一反应体系中实现了同时配位,成功合成了一种结构新颖的二维层状钴铁双金属配合物[Co(phen)3·Fe(phen)3·2Co(DPC)2·2Fe(DPC)2]·2H2O。该配合物超分子结构由吡啶环和菲啰啉环结构堆积区域的π-π作用力、C—H…O氢键和分子之间的静电力相互作用建立。Fe、Co基配合物在廉价过渡金属配合物的光催化CO2性能表现中较为突出,而金属配合物在光催化CO2材料中又具有高效、高选择性的特点,所制备的钴铁双金属配合物材料合成工艺简单且造价低廉,在光催化CO2方面具有一定开发潜力。准确地表征了材料的晶体结构,可为该材料进行理论计算与实验结果的比较研究提供支持,对于探讨该材料晶体结构对性能的影响有一定参考价值。

图2 配合物中Co2+和Fe3+的配位环境
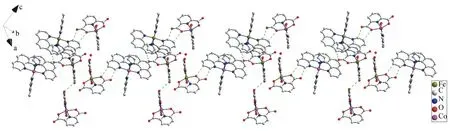
图3 配合物的一维链结构
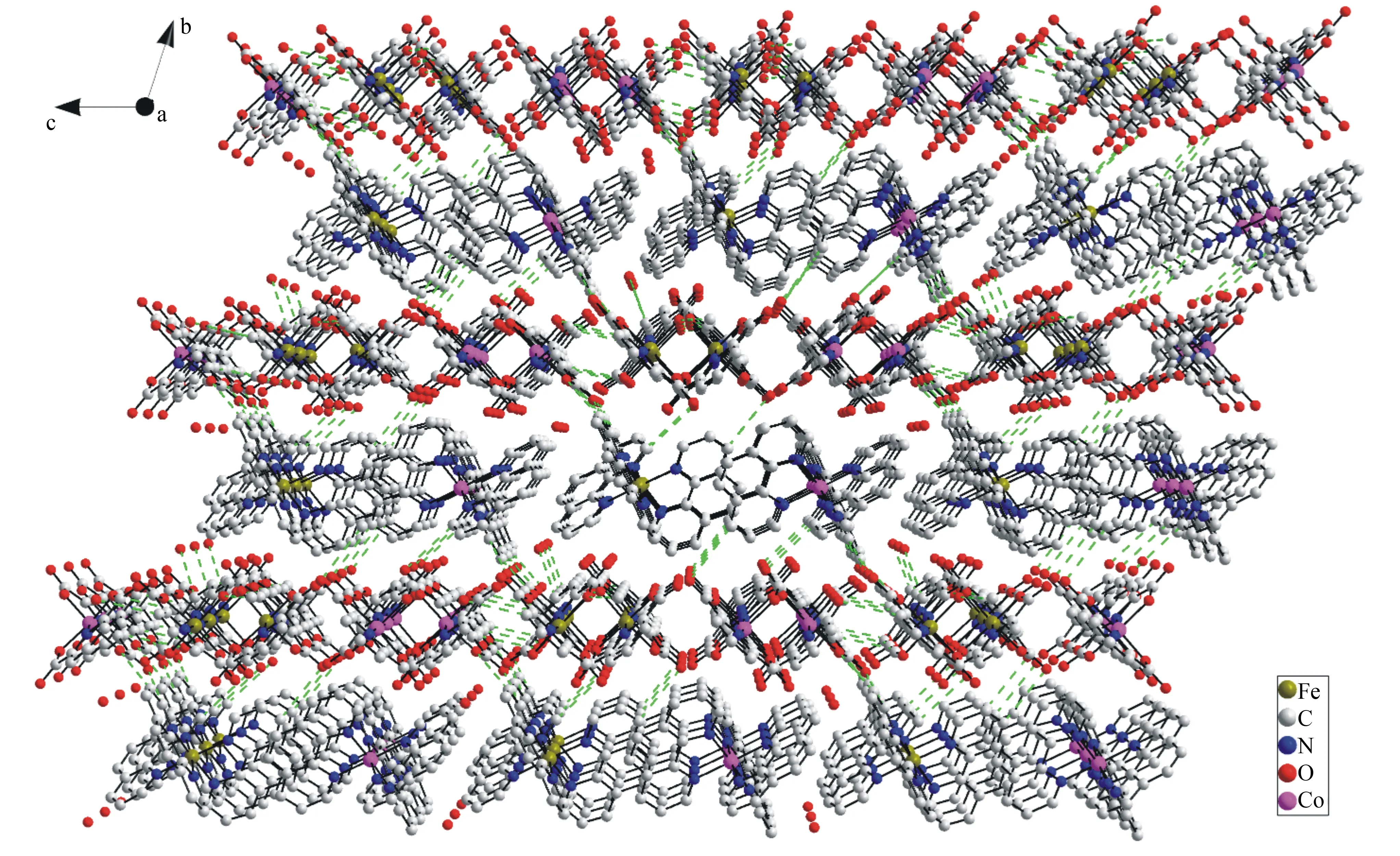
图4 含有氢键的配合物的3D超分子结构

