心肌缺血病人脯氨酸羟化酶2的表达及其干预HL-1缺氧损害的机制
骆元平,吴钟伟,曾垂旭
心血管疾病带来沉重的医疗和社会负担,美国约500万例病人受到影响,其中缺血性心脏病是心力衰竭的主要原因,也是导致临床心血管疾病发病率和死亡率较高的主要原因,是世界范围内的主要公共卫生问题[1]。有研究显示,缺血性心脏病引起的心肌损伤可能是由于心肌缺血或缺氧后血供恢复所致[2],然而,潜在的机制尚未明确。因此,从缺氧诱导的心肌细胞损伤模型中寻找有效的治疗靶点和潜在机制,可为临床预防和治疗心肌缺血疾病提供科学思路。
脯氨酸羟化酶结构域蛋白(PHDs)是一种双加氧酶,通过羟基化低氧诱导因子(HIF-1)中保守的Prolyl残基,与细胞对氧可用性的反应密切相关[3]。PHD家族由3个成员组成,PHD1、PHD2和PHD3,每个亚型均显示出组织和细胞系的特异性功能[4]。在3种PHDs中,PHD2在PHD活性中作用最强,在结肠癌、肝癌和黑色素瘤中表达较低,对癌细胞存活和肿瘤细胞增殖具有抑制作用[5-7]。然而,关于评估PHD在缺氧诱导的心肌细胞损伤中作用的研究较少。因此,探讨PHD2在缺氧诱导的心肌细胞损伤模型中的作用及潜在机制,可为缺氧造成的心肌缺血性疾病提供新方向。本研究检测心肌缺血病人血清PHD2表达,进一步探讨PHD2在缺氧诱导的心肌细胞损伤中的作用和潜在分子机制。
1 材料与方法
1.1 实验材料
1.1.1 临床样本 收集我院健康体检者和心内科心肌缺血病人血清样本各35份。所有研究对象均签署知情同意书,所有血清样本保存于-80 ℃条件下待用。
1.1.2 实验细胞 小鼠心肌细胞HL-1购自中国科学院上海细胞生物学研究所。
1.1.3 实验试剂 PHD2酶联免疫吸附(ELISA)测定试剂盒购自美国LSBio公司;肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)和白细胞介素1β(IL-1β)ELISA试剂盒购自北京欣博生公司;DMEM培养液、胎牛血清(FBS)、青霉素和链霉素均购自美国Gibco公司;谷氨酰胺购自美国Sigma-Aldrich公司;过表达PHD2的质粒和载体pcDNA3.1由Invitrogen公司提供,Lipofectamine 3000试剂购自Life Technologies公司;四唑盐(MTT)和结晶紫染色液购自美国Sigma公司;聚偏二氟乙烯(PVDF)膜和Transwell试剂盒购自美国Millipore公司;TRIzol试剂购自美国Invitrogen公司;SYBR Premix Ex TaqTM和SYBR PrimeScript PLUS RT-RNA PCR试剂盒购自日本TaKaRa公司;RIPA裂解缓冲液购自中国碧云天生物技术研究所,PHD2、p65、p-p65、核因子抑制蛋白α(IκB-α)、磷酸化IκB-α(p-IκB-α)和GAPDH抗体购自美国Cell Signaling Technologies公司;辣根过氧化酶(HRP)标记的抗小鼠和兔二抗购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞的培养和缺氧模型的构建 小鼠心肌细胞HL-1在含有10%FBS、100 U/mL青霉素、100 mg/mL链霉素、2 mmol/L的L-谷氨酰胺DMEM培养基中培养。常氧条件下,细胞在37 ℃,95%O2和5%CO2的培养箱中培养。为刺激缺氧,细胞被孵育在含有94%N2、5%CO2和1%O2的37 ℃的培养箱中。
1.2.2 细胞转染 选择对数生长期的细胞进行转染。准备2个灭菌的1.5 mL EP管,A管加入500 μL的DMEM和4 μg质粒,B管加入500 μL的DMEM和8 μL的Lipofectamine 3000,再缓慢将A管中液体滴入B管,边滴边震荡混匀,室温静置20 min,将混合液加入对应的细胞中,转染24 h后检测相关蛋白表达。
1.2.3 细胞存活率 采用MTT法测定细胞存活率。将细胞以1×105个/孔的接种密度接种到96孔板中,于37 ℃、5%CO2中培养2 d。将MTT溶液(5 mg/mL)在缺氧后12 h、24 h、72 h和96 h分别加入每孔中,在37 ℃下孵育4 h。每孔加入100 μL二甲基亚砜后,使用不含细胞的孔作为空白,使用酶标仪在570 nm处读取吸光度。细胞存活率(%)=(处理细胞/对照细胞)×100%。
1.2.4 细胞迁移和侵袭能力 24孔Transwell室用于细胞侵袭实验。将1×105个细胞(200 μL)无血清培养基中的细胞接种于24孔Transwell培养室的上腔室中,将600 μL含10%FBS的细胞培养液加入下腔室中培养。细胞在37 ℃、5%CO2的湿化环境中培养24 h,使用棉签小心地从过滤器的上表面去除未侵袭的细胞。之后用100%甲醇固定细胞30 min,0.5%结晶紫染色20 min。迁移细胞在相差显微镜下计数。同样迁移的测定方法不覆盖上腔室基质,并在24 h内计数迁移细胞。
1.2.5 流式细胞术 使用碘化丙啶(PI)和异硫辛酸荧光素(FITC)结合的Annexin V染色进行细胞凋亡分析。细胞在磷酸缓冲盐溶液(PBS)中洗涤,悬浮在结合缓冲液中,并根据实验说明书,在50 μg/mL RNase A存在下,用PI和FITC-Annexin V染色。流式细胞术分析采用FACScan,数据分析使用FlowJo软件。
1.2.6 实时荧光定量逆转录聚合酶链式反应(RT-qPCR) 使用Trizol试剂按照说明书从细胞中提取总RNA。使用SYBR Premix Ex TaqTM进行逆转录和定量PCR。采用一步法SYBR PrimeScript PLUS RT-RNA PCR试剂盒测定PHD2表达水平。PHD2正向引物序列为5′-TGAGCAGCATGGACGACCTGAT-3′,反向引物序列为5′-GACATAGCCTGTTCCGTTGCCT-3′;GAPDH正向引物序列为5′-CATCACTGCCACCCAGAAGACTGT-3′,反向引物序列为5′-ATGCCAGTGAGCTTCCCGTTCAG-3′。以GAPDH为内参,采用2-△△Ct法计算相对表达水平。
1.2.7 蛋白免疫印迹法(Western Blot) 收集细胞采用添加蛋白酶抑制剂和蛋白磷酸酶抑制剂的RIPA裂解缓冲液提取。使用8%~12%的聚丙烯酰胺凝胶电泳(SDS-PAGE)分离出相同数量的蛋白质,并采用电印迹法转移到聚偏二氟乙烯膜上,用5%的牛奶室温封闭膜1 h,1×TBST洗涤3次后,用PHD2、p65、p-p65、IκB-α、p-IκB-α和GAPDH等特异性抗体4 ℃孵育过夜。次日用HRP标记的抗小鼠和兔二抗(1∶10 000)孵育1 h。1×TBST洗涤后,用电化学发光(ECL)显影液进行显影。使用Image J软件分析蛋白灰度分析。
1.2.8 ELISA 使用ELISA试剂盒测定HL-1培养上清液促炎细胞因子水平。收集100 μL细胞培养上清液,根据ELISA说明书测定TNF-α、IL-6、IL-1β促炎因子。每一样品做3个复孔,取均值。

2 结 果
2.1 健康体检者和心肌缺血病人血清PHD2表达 RT-qPCR结果显示,与健康体检者比较,心肌缺血病人血清PHD2表达下调(P<0.001)。详见图1。

与健康体检者比较,*P<0.001。图1 健康体检者和心肌缺血病人血清PHD2表达
2.2 缺氧对HL-1损伤和PHD2的影响 与常氧比较,缺氧后24 h、72 h和96 h细胞存活率均降低(P<0.05),缺氧处理后细胞迁移和侵袭能力降低(P<0.05),细胞凋亡增加(P<0.01)。RT-qPCR和Western Blot分析结果显示,与常氧比较,缺氧处理后HL-1中PHD2表达下调(P<0.05)。详见图2。提示缺氧可抑制细胞活力、迁移,促进HL-1凋亡,同时下调PHD2表达。

与常氧比较,*P<0.05,#P<0.01,△P<0.001。图2 缺氧对HL-1损伤和PHD2表达的影响[A为MTT分析缺氧对HL-1存活率的影响;B为Transwell分析缺氧对HL-1迁移和侵袭的影响(×40);C为缺氧对HL-1迁移影响的柱状图;D为缺氧对HL-1侵袭影响的柱状图;E为缺氧对HL-1凋亡影响的柱状图;F为缺氧对HL-1中PHD2 mRNA表达影响的柱状图;G为Western Blot分析缺氧对HL-1中PHD2蛋白表达影响的电泳图]
2.3 PHD2过表达质粒验证 为进一步探讨PHD2对缺氧诱导的HL-1损伤的影响,首先构建了pcDNA3.1-PHD2过表达质粒。将pcDNA3.1阴性对照质粒和pcDNA3.1-PHD2过表达质粒分别转染至HL-1,采用RT-qPCR和Western Blot检测PHD2表达,验证质粒是否构建成功。结果显示,相较于常氧+pcDNA3.1组,常氧+pcDNA3.1-PHD2组PHD2 mRNA表达升高(P<0.01)。详见图3。说明pcDNA3.1-PHD2过表达质粒构建且转染成功。
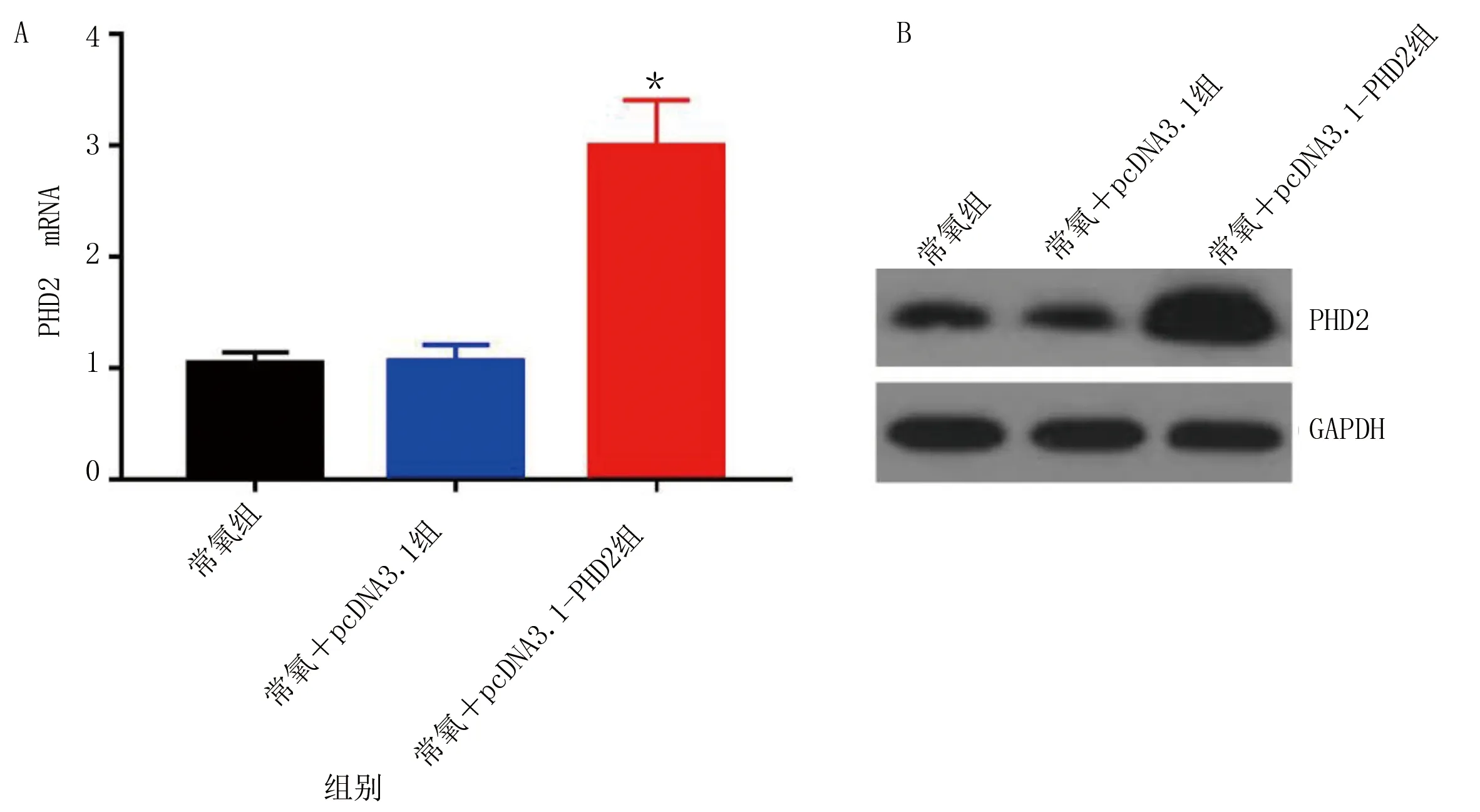
与常氧+pcDNA3.1组比较,*P<0.01。 图3 过表达PHD2质粒验证(A为RT-qPCR检测过表达PHD2后HL-1中PHD2 mRNA水平;B为Western Blot检测过表达PHD2后HL-1中PHD2蛋白水平)
2.4 过表达PHD2对缺氧诱导的HL-1损伤的影响 进一步检测过表达PHD2对缺氧诱导的HL-1损伤的影响。结果显示,与缺氧+pcDNA3.1组比较,缺氧+pcDNA3.1-PHD2组缺氧24 h、72 h和96 h后可增加细胞存活率(P<0.05),同时促进了HL-1的迁移和侵袭能力(P<0.05),细胞凋亡被抑制(P<0.01)。详见图4。提示过表达PHD2可抑制缺氧诱导的HL-1损伤,包括提高细胞存活率,促进细胞迁移和侵袭,同时抑制细胞凋亡。
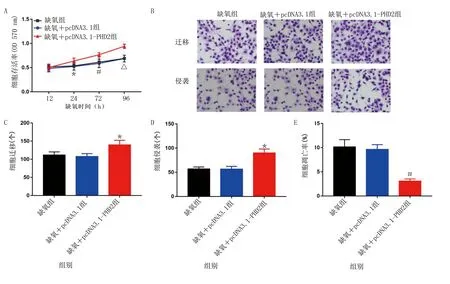
与缺氧+pcDNA3.1组比较,*P<0.05,#P<0.01,△P<0.001。图4 过表达PHD2对缺氧诱导的HL-1损伤的影响[A为MTT分析过表达PHD2对缺氧诱导的HL-1存活率的影响;B为Transwell分析过表达PHD2对缺氧诱导的HL-1迁移和侵袭的影响(×40);C为过表达PHD2对缺氧诱导的HL-1迁移影响的柱状图;D为过表达PHD2对缺氧诱导的HL-1侵袭影响的柱状图;E为过表达PHD2对缺氧诱导的HL-1凋亡影响的柱状图]
2.5 过表达PHD2对HL-1中NF-κB信号通路的影响 采用Western Blot分析过表达PHD2对缺氧条件下HL-1中NF-κB信号通路的影响,结果显示,相较于缺氧+pcDNA3.1组,缺氧+pcDNA3.1-PHD2组p65、p-p65、IκB-α和p-IκB-α蛋白水平降低。采用ELISA检测各组促炎因子TNF-α、IL-6和IL-1β表达,结果显示,相较于缺氧+pcDNA3.1组,缺氧+pcDNA3.1-PHD2组促炎因子TNF-α水平降低(P<0.01),IL-6和IL-1β水平无明显变化。详见图5。提示过表达PHD2对缺氧条件下HL-1损伤的保护作用可能通过抑制NF-κB信号通路引起的。

与缺氧+pcDNA3.1组比较,*P<0.01。 图5 过表达PHD2对NF-κB信号通路的影响(A为Western Blot检测过表达PHD2对NF-κB信号通路相关蛋白表达条带图;B为ELISA分析过表达PHD2对促炎因子TNF-α水平影响的柱状图;C为ELISA分析过表达PHD2对促炎因子IL-6水平影响的柱状图;D为ELISA分析过表达PHD2对促炎因子IL-1β水平影响的柱状图)
3 讨 论
随着人们生活方式的改变,心血管疾病开始在我国流行。目前,心血管疾病是我国民众严重的健康问题之一,发病率和死亡率较高[8]。其中急性心肌梗死、心力衰竭和缺血性心脏病是世界范围内导致死亡和残疾的主要原因[9]。有研究显示,这些疾病主要与心肌缺血相关,而心肌缺血主要是由缺氧引起的,表现为流向心脏的血液量减少,心肌无法获得充足的氧气,使心肌细胞受损[10]。本研究通过构建缺氧诱导的心肌细胞损伤模型,进一步探讨治疗心肌缺血的潜在靶点和分子机制。
PHDs是负责催化氧化低氧诱导因子-1(HIF-1)的特定保守脯氨酸残基的酶,但关于PHD蛋白的其他作用尚未明确。已鉴定的PHD酶中,PHD2认为是关键的分子氧传感器,PHD2通过羟基化作用调节常氧条件下的HIF-1蛋白水平,促进蛋白酶体降解,负责多种反应,如血管生成、红细胞生成、细胞代谢、生存能力和增殖[11-13]。相关研究显示,PHD2对缺氧条件下肿瘤的发生和转移、肿瘤相关的成纤维细胞活力及巨噬细胞的代谢和功能有一定的抑制作用[12,14-15]。在心肌缺血和缺氧条件下对心肌细胞的影响报道较少。因此,本研究观察PHD2对心肌缺血和缺氧诱导的心肌细胞损伤的影响,结果显示,相较于健康体检者,心肌缺血病人血清PHD2表达水平较低。同时,在缺氧诱导的HL-1中,HL-1存活率、迁移和侵袭降低,同时细胞凋亡增加,PHD2 mRNA表达为较低水平。在缺氧诱导的HL-1中过表达PHD2时,显著抑制了缺氧诱导的HL-1损伤。因此,PHD2对缺氧诱导的心肌细胞损害具有保护作用。
NF-κB是代表一个家族的诱导转录因子,参与调节不同的免疫和炎症反应,是与细胞周期调控和炎症相关的关键因子,可促进细胞凋亡和抑制细胞存活率[16]。有研究显示,PHD2通过抑制NF-κB活动进而发挥抗癌和抗炎作用,如直肠癌、骨关节炎和自身免疫疾病等[17-18]。本研究中,过表达PHD2抑制了缺氧诱导的HL-1中NF-κB激活,可能通过抑制IκB-α磷酸化实现的。采用ELISA检测了NF-κB的下游基因TNF-α、IL-6和IL-1β,结果显示,缺氧诱导的HL-1中TNF-α水平被过表达的PHD2抑制,而IL-6和IL-1β无明显变化。表明这些促炎因子可能受其他微环境的影响。因此,PHD2通过抑制NF-κB进而对缺氧诱导的HL-1损伤具有保护作用。
综上所述,PHD2在心肌缺血病人血清和缺氧诱导的HL-1中低表达,过表达PHD2可抑制缺氧诱导HL-1存活率、迁移和侵袭,促进细胞凋亡,进而抑制缺氧对HL-1损伤,其分子机制可能是通过抑制NF-κB信号通路实现的。本研究为临床诊断和治疗心肌缺血造成的心血管疾病提供了一个新靶点。
——一道江苏高考题的奥秘解读和拓展

