乌鸡肠道中一株乳酸菌的分离鉴定及生物学特性研究
付 祥, 刘晓娜, 刘瑞雪, 苏建青, 褚秀玲
(聊城大学农学院,山东聊城 252000)
长期使用抗生素所带来的食品安全问题、生态环境问题等正在显现(尹珺伊等,2021)。根据中华人民共和国农业农村部第194 号公告的要求(中华人民共和国农业农村部,2019),全面停止生产和使用除中药外的所有促进生长类的药物饲料添加剂。 因此,选择一种绿色、健康的饲料添加剂是现在畜牧业的重点方向。
乳酸菌是目前益生菌研究和应用的重点对象之一,研究认为,乳酸菌作为畜禽肠道内重要的一种益生菌,不仅直接影响畜禽的健康和生长,还对畜禽的自身免疫系统稳态发展起到重要的协助保护作用(王天威等,2020);其通过产乳酸菌素以及多种有机酸来改善机体肠道菌群 (Wu 等,2019;匡珍等,2019); 通过产酸以及附着于宿主肠道细胞的方式, 来抑制抑制动物消化道中诸如沙门氏菌、 大肠杆菌、 葡萄球菌等有害菌群的定植(Yousef Nami 等,2018;Nejati 等,2016;谢璐娜等,2016); 还可以降低炎症反应 (Shilan Wang 等,2019)以及清除氧自由基,抑制细胞产生活性氧,发挥其抗氧化(贺腾飞等,2019)的作用。 因此,筛选出具有良好性能的乳酸菌菌株具有重要意义(王文梅等,2013)。
本试验以乌鸡肠道微生物菌群为试验研究的样本, 使用肠道微生物的试验方法 (何江波等,2021),从健康乌鸡的肠道中,筛选出性能良好的乳酸菌(刘小兰等,2020),并研究所选菌株N 的生物学特性以及抑菌性能(张磊等,2021),为分离的乳酸菌菌株N 应用于微生态制剂以及饲料添加剂提供参考。
1 材料与方法
1.1 材料和仪器 乌鸡粪便来自30 周龄的健康乌鸡。试验所需液体以及固体培养基、革兰氏染色以及生化试验所需试剂均购自青岛高科技工业园海博生物技术有限公司。 病原菌由聊城大学实验室分离保存。 药敏片购自杭州微生物试剂有限公司;PCR 相关试验用品购自上海生工生物工程股份有限公司。
UV-5900 紫外可见分光光度计, 上海元析仪器有限公司;电热恒温培养箱,上海一恒科学仪器有限公司;净化工作台,苏州净化设备有限公司;琼脂糖凝胶电泳仪,北京市六一生物科技有限公司。
1.2 试验方法
1.2.1 样品处理 健康乌鸡的粪便用无菌生理盐水稀释后, 使用灭菌纱布过滤除去乌鸡肠道中的剩余内容物(杨逢清等,2020)。使用无菌生理盐水稀释滤液,按10-1、10-2、10-3、10-4、10-5、10-6、10-7依次进行梯度稀释,置于4 ℃冰箱保存备用。
1.2.2 分离纯化 使用一次性注射器抽取稀释的粪便滤液,将其加入灭菌完毕的MRS 肉汤培养基中,37 ℃增菌培养24 h, 增菌完成后将菌液梯度稀释至10-7,移液器吸取梯度稀释至10-5~10-7的菌液各100 μL, 均匀涂布在加入了2%碳酸钙的选择培养基上(尹乐斌等,2016),平板在37 ℃培养24 h。 用接种环在选择培养基上挑取含有溶钙圈的单菌落,使用平板划线法在MRS 琼脂培养基上进行划线纯化, 直至出现革兰氏染色为阳性的菌株。 从平板中挑取单个菌落, 将单株细菌纯化增菌培养,用体积分数50%甘油保存纯化增菌后的菌株,并将其放于-80 ℃超低温冰箱中,以上工作均在超净工作台中进行。
1.2.3 革兰氏染色和生化鉴定 用接种环取单菌落涂布于滴加生理盐水的干净载玻片上, 通过革兰氏染色进行初步鉴定; 染色完毕后对菌株形态特征进行观察记录; 用接种环蘸取一环菌液涂于干净载玻片上,进行过氧化氢酶试验,无气泡产生则为阴性; 再进行10 种糖醇类发酵产酸试验,进行进一步的验证。
1.2.4 16S rDNA 鉴定 用煮沸法提取纯化后菌株N 的基因组DNA,使用细菌16S rDNA 通用引物27F 和1492R 扩增目的基因片段 (上游引物:27F:5'-AGAGTTTGATCATGGCTGAG-3; 下游引物1492R:5’-GGTTACCTTGTTACGACTT-3’)。以基因组DNA 为模板, 进行菌株N 的16S rDNA PCR 扩增。PCR 反应体系(25 μL):Premix 13 μL,ddH2O 8 μL,上下游引物各1.0 μL,DNA 2 μL。反应条件:95 ℃预变性5 min;94 ℃变性30 s;54 ℃退火45 s;72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。 PCR 产物经1.0%琼脂糖凝胶电泳检测,凝胶成像分析仪观察结果。
将纯化的菌株, 挑选出平板划线法单菌落多的一次性平皿,送往青岛测序公司进行测序,将菌株N 的测序结果在NCBI 网站上进行同源性比较。下载同源性最高的模式菌株核苷酸序列,利用MEGA 7.0 软件构建菌株N 的系统进化树。
1.2.5 生物学特性研究
1.2.5.1 菌株生长曲线测定 取菌株24 h 发酵液,以2%接种量接种MRS 肉汤,37 ℃培养。 间隔2 h 取样一次,使用灭菌MRS 肉汤为空白对照,在波长600 nm 处检测菌株N 发酵液OD600nm值。 以培养时间为横坐标, 测定的OD600nm值为纵坐标,制作菌株N 的生长曲线图。
1.2.5.2 菌株产酸曲线测定 取菌株N 的24 h发酵液,按照2%接种量,将其接种至灭菌MRS 肉汤,37 ℃培养。 每隔6 h 取样,测定不同培养时间菌株发酵液pH。以培养时间为横坐标,测定的pH为纵坐标,制作菌株N 的产酸曲线图。
1.2.5.3 菌株的耐酸、 耐胆碱能力 配制pH 为2.0、3.0、4.0、5.0 和6.0 的MRS 肉 汤 培 养 基,在121.6 ℃条件下灭菌15 min。 取菌株N 的24 h 发酵液,以2%接种量接种MRS 肉汤,于37 ℃培养24 h, 使用无菌MRS 肉汤为空白对照。 在波长OD600nm处取样, 测定培养基pH 不同时菌株N 发酵液的OD600nm值。 以pH 为横坐标,OD600nm值为纵坐标,制作菌株N 的耐酸能力曲线图。
配制浓度条件为0.10%、0.15%、0.20%、0.25%和0.30%的牛胆酸钠, 将其顺序加入至MRS 肉汤培养基中,在121.6 ℃条件下灭菌15 min。 取菌株N 的24 h 发酵液,以2%接种量接种,于37 ℃培养24 h,使用无菌MRS 肉汤为空白对照。于波长600 nm 处测定胆盐浓度不同时菌株发酵液的OD600nm值。以胆盐浓度为横坐标,OD600nm值为纵坐标,制作菌株N 的耐胆碱能力曲线图。
1.2.6 抑菌试验 将金黄色葡萄球菌、大肠杆菌分别接种于普通肉汤培养基,37 ℃培养24 h; 将菌株N 按照2%接种量接种至MRS 肉汤当中,37 ℃培养24 h,调节发酵液菌体浓度为1×108cfu/mL。取致病菌的菌液100 μL 均匀涂布于麦康凯以及营养琼脂平板上,滴加50 μL 菌株N 的菌液,4 ℃放置12 h 后,将以上平板放于37 ℃培养24 h,测量菌株N 对病原菌的抑菌圈直径。
1.2.7 药敏试验 试验测定分离菌株N 的药物敏感性,将菌株N 按照2%接种量接种至MRS 肉汤当中,37 ℃培养24 h。 均匀涂布100 μL 菌株N的菌液于MRS 琼脂培养基上,用无菌镊子夹取药敏片,将其放置于培养基表面压紧,将培养基置于37 ℃培养24 h,根据产生的抑菌圈大小评定菌株N 的药物敏感性(李肖等,2017)。
2 结果
2.1 菌落形态及镜检结果 培养24 h,观察到菌株N 的菌落凸起,白色,边缘整齐(图1);在MRS 培养基中加入2%碳酸钙, 菌株N 菌落周围产生融钙圈(图2);对菌株N 染色后进行镜检,结果如图3 所示, 菌株N 的形态呈现杆菌, 两端圆, 成短链。
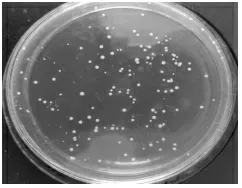
图1 分离菌菌落形态
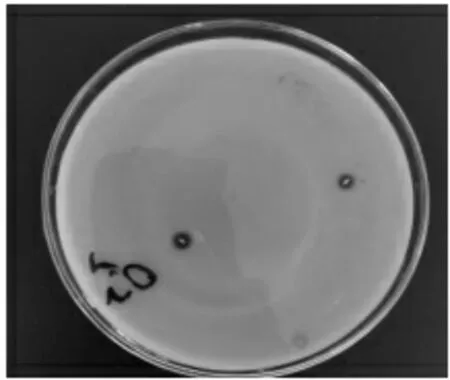
图2 分离菌产生的融钙圈
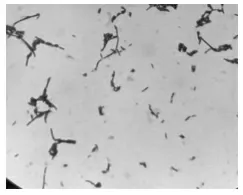
图3 分离菌染色镜检图
2.2 生化鉴定结果 由表1 可知, 菌株N 生化鉴定结果与乳杆菌基本相符。

表1 菌株N 生化鉴定结果
2.3 16S rDNA 鉴定结果 通过煮沸法提取菌株N 的基因组DNA,对菌株N 进行PCR 扩增,得到片段约为1500 bp 的特异性条带(图4),与预计得到的条带大小相符。 测序后得到的菌株N 序列在NCBI 比对结果显示,菌株N 和戊糖乳杆菌的相似度达100%。 利用MEGA 7.0 软件绘制得系统发育树(图5)。
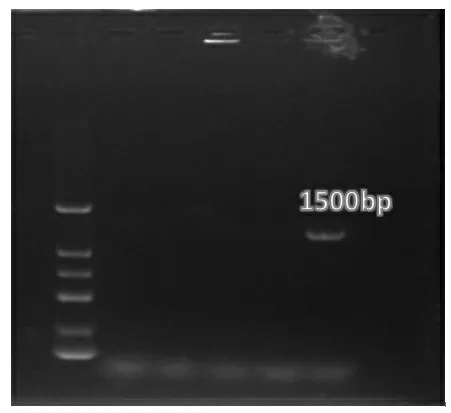
图4 分离菌电泳结果

图5 菌株N 的16S rDNA 基因系统发育进化树
2.4 生物学特性研究
2.4.1 生长曲线以及产酸试验结果 由图6 可见,0 ~6 h 菌株N 处于迟缓期,6 ~18 h 菌株N 处于对数期,18 h 后趋于稳定。 菌株N 能够较快到达对数期,生长特性良好。由图7 可见,0 ~6 h 菌株N 发酵液的pH 下降较慢,6 ~18 h 菌株N 发酵液的pH下降速度较快,18 h 后pH 趋于稳定。 数据显示,菌株N 菌液的pH 下降幅度符合菌株生长曲线增幅,pH 降低25%。结果表明菌株N 在增殖过程中产酸,其可通过降低发酵液的pH 来抑制杂菌生长。
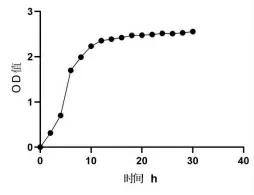
图6 乳酸菌N 生长曲线图
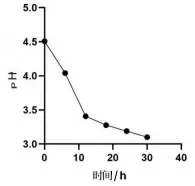
图7 乳酸菌N 产酸曲线
2.4.2 不同pH 条件对菌株N 存活数的影响 由图8 可见,pH 为6 时,菌株N 的OD600nm值为3,随着MRS 肉汤pH 的减小,其OD600nm值逐渐降低,在pH 为2 ~3 时,菌株N 的OD600nm值较小,说明菌株N 具有一定的耐酸性。
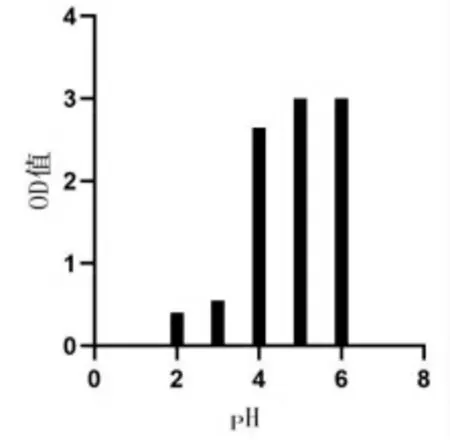
图8 乳酸菌N 在不同pH 下的OD 值
2.4.3 不同胆盐条件对菌株N 存活数的影响由图9 可见,胆盐均能抑制菌株N 的生长,菌株N 的OD600nm值与胆盐浓度呈相反的趋势,即菌株N 的OD600nm值随着胆盐浓度的不断升高而下降,但是菌株N 在高浓度的胆盐中,OD 值仍在2 以上,表明其仍然有较高的活性,因此菌株N 具有一定的耐胆盐特性。

图9 乳酸菌N 在不同浓度胆盐下的OD 值
2.4.4 抑菌试验结果 由图10、图11 可知,菌株N 对大肠杆菌和金黄色葡萄球菌两种病原菌均有良好抑菌性,抑菌圈直径分别约为35、30 mm。

图10 乳酸菌N 对金黄色葡萄球菌的抑菌效果

图11 乳酸菌N 对大肠杆菌的抑菌效果
2.4.5 药敏试验结果 根据微生物敏感性执行标准对药物敏感性进行区分, 并将药物敏感性分为敏感(S)、中介(I)、耐药(R)。 由表2 可知,菌株N对乙酰螺旋霉素等高度敏感,对环丙沙星等耐药。
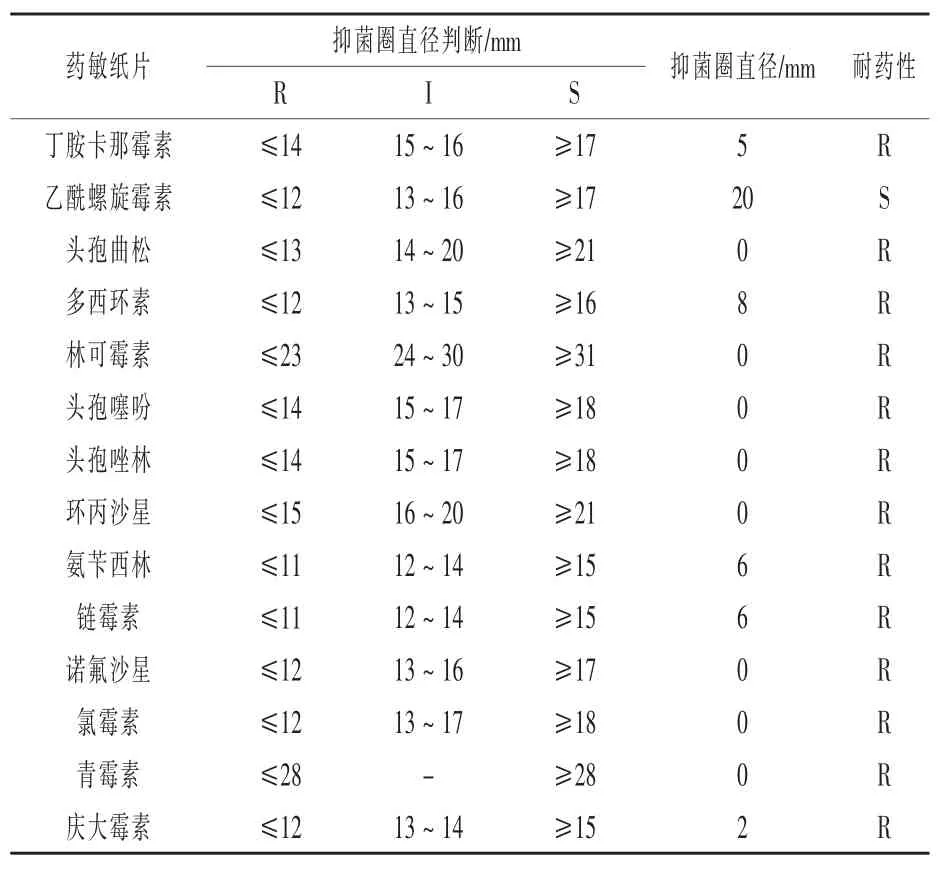
表2 分离菌药敏试验结果
3 讨论
作为动物肠道中常见的细菌, 乳酸菌与动物机体的健康有着密切的联系 (Pokorná Alexandra等,2019)。 乳酸菌作为一种益生菌具有提高饲料利用率(秦红等,2017)、改善动物消化道功能(张彩凤等,2017)、促进机体发育(周凌博等,2019)、提高免疫力(孔雨昕等,2021)等益生功能。在畜牧生产中, 用来制作饲料添加剂以及微生态制剂的菌株主要从动物和人类的消化道、 土壤以及发酵食物中分离, 而不同动物体内的乳酸菌对于肠道的黏附力也不相同(Paula Carasi 等,2013),因此筛选出抗逆性好的同源乳酸菌菌株, 对于畜牧业具有重要的意义。
乳酸菌发挥其益生作用的前提是能够定植于家畜肠道,并能够大量增殖,其通过产生有机酸和抗菌活性肽等物质阻遏致病菌群的定植(廖波等,2019;李洁等,2014),调控肠道细胞免疫功能来促进动物机体健康, 因此菌株达到对数期的时间越短,越能够发挥其良好的益生作用。通过测定并制作本试验分离菌株N 的生长曲线,发现菌株N 进入对数期较快,符合筛选菌株的要求。乳酸菌作为外来添加的菌株, 需要经过消化道的低pH 环境后,仍然有着较好的活性,能够进行生长繁殖,因此需要筛选耐酸、耐胆碱的菌株。本试验分离的菌株N 对于肠道环境有着较好的耐受性,可用于制作益生菌添加。
综上所述, 本试验从乌鸡肠道中分离鉴定到的菌株N 为戊糖乳杆菌,作为同源菌株更有利于在鸡肠道内定植, 菌株N 在8 h 左右即可到达对数期,说明其生长特性优良。而且菌株N 在pH 为4、胆盐浓度为0.3%时,仍有良好的生长性能,说明其耐酸、耐胆盐性能好,表明菌株N 适合作为饲料添加剂的优良菌种。

