一株耐药型红树林乳酸菌的筛选鉴定及培养基优化
陈 蓉, 梁嘉慧, 林柳余, 梁杏燕, 王锂韫, 饶颖竹
(岭南师范学院生命科学与技术学院,岭南师范学院应用生物技术研究所,广东湛江 524048)
随着集约化水产养殖模式的发展, 抗生素滥用加剧, 严重影响了我国水产养殖行业的可持续发展,因此,水产微生物制剂的开发利用是推动绿色海水养殖的重要措施。 乳酸菌可以有效抑制有害菌的生长(董韩博等,2016)、提高摄食率和吸收率、增强免疫力和抗病力、增加水产动物的肌肉弹性和持水性等 (夏雨等,2020; 李军亮等,2019、2018;Ghiasi 等,2018),其具有作为水产养殖饲料添加剂的前景。 此外,在养殖等水体环境中,乳酸菌具有降解氨氮和亚硝酸盐的能力 (谢凤行等,2019; 李咏梅等,2018), 还能增加水体溶解氧量(黄浦江等,2019)、 有效改善水环境 (姜松等,2018),是潜在的具有应用价值的水质改良剂。
红树林在保护生物多样性、调节气候、净化海水等方面具有重要的生态作用(但新球等,2016),从泰国南部红树林中分离出可作为食品潜在生防菌的乳酸乳球菌(Lactococcus lactis subsp.lactis)(Hwanhlem 等,2013) 和粪肠球菌(Enterococcus faecalis) (H -Kittikun 等,2015;Hwanhlem 等,2014)。广东省湛江红树林是我国面积最大的红树林自然保护区, 目前研究主要集中在生物资源调查保护、湿地沉积物等方面(何森华等,2021;但新球等,2016), 关于湛江红树林来源的乳酸菌鲜有报道,因此,立足湛江本地海洋微生物资源,深入研究本地化红树林来源的海洋乳酸菌等微生物资源, 对开发海水养殖微生态制剂具有一定的现实意义。
本研究采用形态学、 生理生化试验、16S rDNA 及gyrB序列分析鉴定等方法对广东省湛江市红树林淤泥样品中菌株进行分离鉴定, 并使用五种常用渔药进行耐药性试验(陈蓉等,2018)。通过单因素试验测定菌株最佳pH,最佳碳源、最佳氮源及其最佳浓度, 进而采用响应面Box-Behnken设计法进行试验设计,确定培养基最优组合,以期筛选出一株具有耐药性且生产量高的乳酸菌,为开发本土高效的水产养殖益生菌和微生态制剂提供基础信息。
1 材料和方法
1.1 材料和试剂 海洋淤泥样品取自广东省湛江市渔港公园红树林保护区潮间带, 按不同深度土层(0 ~10、10 ~15、15 ~20、20 ~25 cm)各采集一份,带回实验室低温保存备用。
MRS 培养基、HBI 乳酸菌生化鉴定条(GB),青岛海博生物;DN11 细菌基因组DNA 快速提取试剂盒,北京艾德莱;药敏试纸氨苄西林、四环素、甲氧苄胺嘧啶、利福平、复方新诺明,杭州滨和;Ex-Taq DNA 聚合酶, 日本TaKaRa;16S rDNA 序列 扩 增 引 物 (27F:5' -AGAGTTTGATCMTGGCTCAG-3' 和1492R:5'-TACGGYTACCTTGTTACGACYT -3')、gyrB简 并 引 物 (UP -1:5' -GAAGTCATCATGACCGTTCTGCAYGCNGGNGGN ARRTTYGA-3' 和UP-2r:5'-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNACRTCNGCRTC NGTCAT-3'),由上海生工合成。
1.2 仪器和设备 BioPhotometer 6131 生物分光光度计, 德国Eppendorf;ZD-88 双功能气浴振荡器,常州开元;MJ Mini PCR 仪,美国BIO-RAD。
1.3 试验方法
1.3.1 样品处理与菌株富集 分别取5 g 不同深度土层的淤泥样品溶于45 mL 无菌水, 振荡摇匀。 以10%比例接种到乳酸菌MRS 肉汤培养基中富集,37 ℃恒温摇床(220 r/min)培养24 h。
1.3.2 分离筛选 取1 mL 富集后的菌液进行稀释, 吸取10-4、10-5、10-6、10-7稀释梯度的菌液各100 μL,用溶钙圈法进行乳酸菌筛选,用MRS 平板分离纯化有溶钙圈的单菌落,划线数次,至单菌落形态大小相似。
1.3.3 形态学观察和生理生化鉴定 将筛选到的菌株进行革兰氏染色, 在光学显微镜下观察菌落形态特征, 并参照《乳酸细菌分类鉴定及试验方法》(凌代文等,1999)和《常见细菌系统鉴定手册》(东秀珠等,2001)进行生理生化鉴定。
1.3.4 分子鉴定 按照本实验室的细菌分子鉴定方法进行16S rDNA 和gyrB基因序列鉴定(陈蓉等,2018),以确定分离菌株的种属情况。
1.3.5 药敏试验 使用K-B 琼脂法进行药敏试验,在每一个MRS 平板上放置5 片同一种药敏纸片。根据药敏纸片抑菌圈平均直径大小,将药物敏感性分为敏感(S)、中介(I)、耐药(R)(刘开放等,2017)。
1.3.6 单因素试验
1.3.6.1 最佳碳氮源及其最佳浓度的筛选 将不同浓度的(10、20、30、40、50 g/L)碳源(葡萄糖、乳糖、麦芽糖)和氮源(蛋白胨、牛肉膏、酵母膏)分别添加到基础培养基中,按2%比例接种,37 ℃培养24 h, 结合台盼蓝染色和血细胞计数板计数法计算活菌浓度,进行最佳碳源、氮源及其最佳浓度筛选。
1.3.6.2 pH 对菌株生长的影响 在最佳碳氮源及最佳浓度条件下,分别用NaOH 溶液、HCl 溶液和pH 计将基础培养基的初始pH 调至:4.0、5.0、6.0、7.0 和8.0, 按照1.3.6.1 中方法接种培养及计数活菌浓度,以确定培养基最佳pH。
1.3.7 响应面设计试验 采用Box-Behnken 设计法,以单因素试验确定的最佳碳源浓度、最佳氮源浓度及最佳pH 为自变量, 乳酸菌LPAR1 的活菌量为响应值,设计响应面试验。 通过DesignExpert
8.0.6 软件分析数据确定培养条件的最优组合。
2 结果与讨论
2.1 菌落形态观察 通过分离纯化得到1 株乳酸菌(命名LPAR1),菌落形态呈圆形,直径1.0 ~
2.5 mm,乳白色,表面光滑湿润。 在含2% CaCO3的MRS 平板上,单菌落边缘有明显的透明圈。 革兰氏染色呈阳性,球状,成对或成四联状。
2.2 生理生化鉴定结果 根据菌株LPAR1 的形态特征和生理生化试验结果(表1),初步鉴定菌株LPAR1 为片球菌属。 菌株LPAR1 在2.5 mol/L NaCl ,pH 4.0 的条件下生长情况较好, 表明菌株LPAR1 有较强的耐酸和耐盐能力。 这与杜志琳等(2017)从青贮饲料中分离筛选获得的乳酸片球菌生理生化试验结果相似。
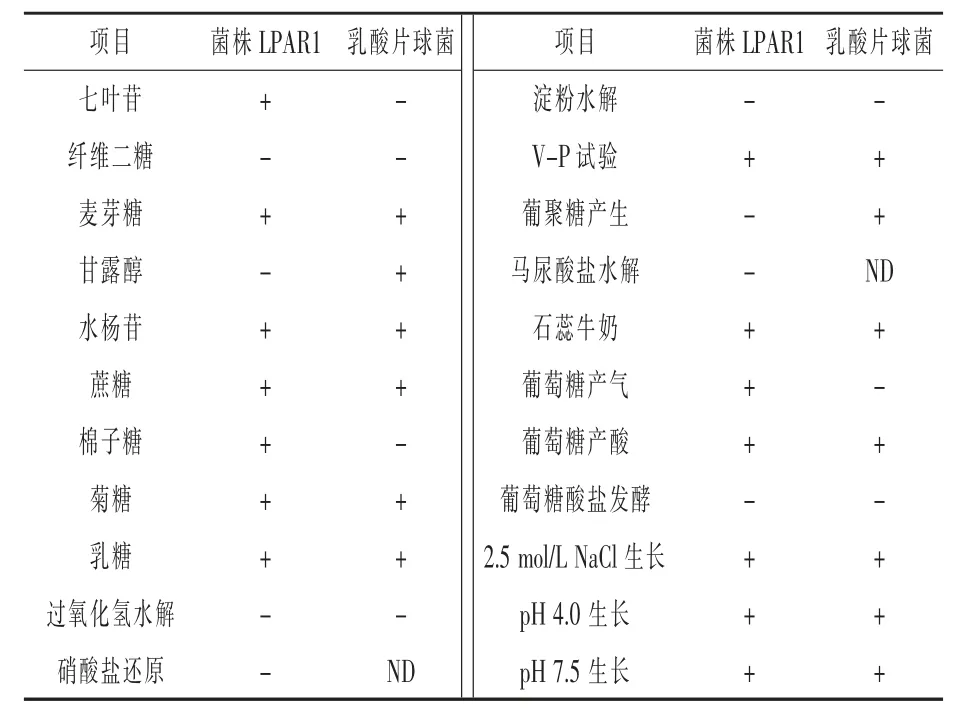
表1 菌株LPAR1 的生理生化特征
2.3 分子鉴定结果
2.3.1 PCR 扩增 以菌株LPAR1 总DNA 为模板,PCR 快速扩增16S rDNA 和gyrB基因序列,1%琼脂糖凝胶电泳检测, 结果显示, 前者在约1500 bp 处呈单一目的条带(图1-a), 后者在约1200 bp 处呈单一目的条带(图1-b)。
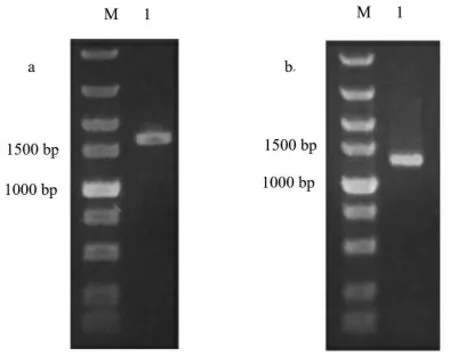
图1 菌株LPAR1 的PCR 扩增电泳结果
2.3.2 16S rDNA 序列和gyrB基因序列系统发育树分析结果 测序结果显示,菌株LPAR1 的16S rDNA 序列长度为1482 bp,gyrB序列长度为1193 bp。 登录NCBI,提交菌株LPAR1 的16S rDNA 和gyrB序列到GenBank 中,经BLAST 搜索比对,结果显示, 前者与乳酸片球菌同源性最高,为100%, 后者同样也与乳酸片球菌同源性最高,大于99%。 采用MEGA5.0 软件按Neighbor-Joining法分别构建系统发育树,菌株LPAR1 均与Pediococcus acidilactici在同一分支,即菌株LPAR1 与乳酸片球菌遗传进化距离最近(图2、图3)。 根据形态学、生理生化及分子生物学鉴定结果,可确定菌株LPAR1 为乳酸片球菌(P.acidilactici)。

图2 基于16S rDNA 序列构建的菌株LPAR1 发育进化树

图3 基于gyrB 序列构建的菌株LPAR1 发育进化树
2.4 药敏试验结果 乳酸片球菌LPAR1 对5 种常用渔药(复方新诺明、甲氧苄胺嘧啶、氨苄西林、利福平、四环素)的药敏试验结果显示,LPAR1 对利福平和氨苄西林表现为高度敏感(S),抑菌圈直径分别为 (22.37±0.18)mm 和 (24.31±0.22)mm,LPAR1 对四环素、复方新诺明和甲氧苄胺嘧啶表现为耐药(R),抑菌圈直径分别为(9.70±0.43)mm、0.00 mm 和0.00 mm (表2), 表明乳酸片球菌LPAR1 具有一定的耐药性,其对氨苄西林、复方新诺的敏感性与伍元植等(2019)在湛江海域斜带石斑鱼肠道中分离的乳酸菌药敏试验结果一致。
2.5 单因素试验结果 当基础培养基的碳源为乳糖、氮源为蛋白胨时,乳酸片球菌LPAR1 的菌落数达到最高(图4-a,图4-c)。 乳糖添加量为20 g/L 时菌落数达到最高, 乳糖浓度为30 ~50 g/L菌落数呈现下降趋势(图4-b)。 当蛋白胨添加量为20 g/L 时,菌落数达到最高,20 g/L 后菌落数呈现下降又上升的趋势 (图4-d)。 当pH 在4.0 ~6.0,菌落数逐渐增加,并在pH 6.0 时菌落数达到最高。随后随着pH 升高,菌活数降低(图4-e)。以上结果表明,在乳糖为20 g/L、蛋白胨为20 g/L、pH 为6.0 时都可以达到最佳的发酵效果。
2.6 响应面优化试验
2.6.1 Box-Behnken 结果 根据单因素试验确定响应面试验的中心点, 运用Design-Expert 8.0.6 Trail 软件进行响应面Box-Behnken 设计试验,试验设计(3 因素、3 水平)如表3 所示。

表3 三个因素(碳源、氮源、pH)编码与水平值的设计
通过Design-Expert 8.0.6 Trail 软件进行拟合分析,得出A(pH),B(乳糖),C(蛋白胨)的多元二次回归方程:菌落数=+6.95+1.60A+1.13B+0.47C+1.80AB -0.11AC+0.28BC-1.50A2-0.93B2-2.13C2。
回归方程的方差分析表如表4 所示, 模型P为0.0005,小于0.001,说明模型效果极显著。 失拟项P为0.1985,大于0.05,说明模型失拟不显著。说明模型能较好的反映实际情况,可以使用回归方程预测和分析乳酸片球菌LPAR1 的生长情况。

表4 回归方程的方差分析表
各因素交互作用的响应面图如图5 所示,pH和乳糖浓度交互作用较显著(0.001<P<0.01),pH和蛋白胨浓度交互作用不显著(P>0.05),乳糖浓度和蛋白胨浓度交互作用不显著(P>0.05)。 A2有较显著差异 (0.001<P<0.01),B2有显著差异(0.01<P<0.05),C2有极显著差异(P<0.001)。对回归方程进行求导,得到极值点,即三个影响因子的最佳值:乳糖为25.00 g/L、蛋白胨为20.77 g/L、pH 为6.5, 经响应面模型计算得到乳酸片球菌LPAR1 菌落数的预测结果为9.098×8log CFU/mL。
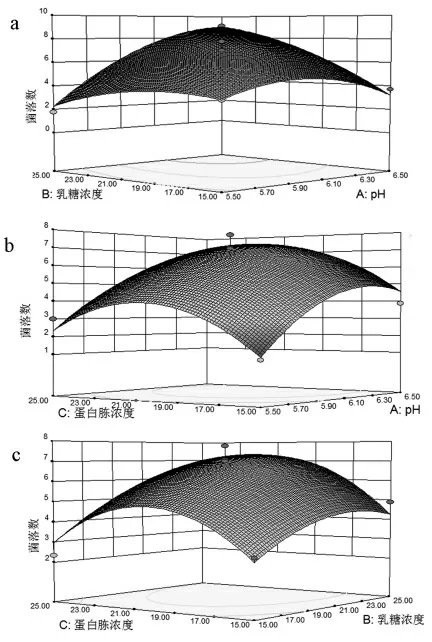
图5 各因素交互作用对菌落数影响的响应面曲线
2.6.2 验证试验 采用最优培养基条件 (乳糖25.00 g/L、蛋白胨20.77 g/L、pH 6.50)验证测试,最终测得乳酸片球菌菌落数为9.105×8log CFU/mL,这与响应面模型的预测结果9.098×8log CFU/mL接近, 表明本试验中的模型预测结果能较好地反映实际情况。
3 结论
本试验从广东省湛江市渔港公园红树林淤泥中分离筛选到一株乳酸菌LPAR1, 综合形态学、生理生化及分子鉴定分析,确定菌株LPAR1为 乳 酸 片 球 菌 (P.acidilactici)。 乳 酸 片 球 菌LPAR1 具有耐盐耐酸的抗逆性, 可在2.5 mol/L NaCl、pH 4.0 的条件生长。药敏试验结果显示,乳酸片球菌LPAR1 对氨苄西林和利福平敏感,对复方新诺明、四环素、甲氧苄胺嘧啶耐药,表明乳酸片球菌LPAR1 具有一定的耐药性。 单因素试验确定乳酸片球菌LPAR1 的最佳培养基条件:乳糖为碳源,蛋白胨为氮源,碳、氮源添加量为20 g/L,pH 6.0。 进一步通过响应面试验优化乳酸片球菌LPAR1 的最佳培养基条件为:乳糖25.00 g/L、蛋白胨20.77 g/L、pH 6.5, 验证试验测得乳酸片球菌LPAR1 菌落数为9.105×8log CFU/mL,与响应面模型的预测值9.08×8log CFU/mL 相近,表明本试验中的模型预测结果能较好地反映实际情况, 可为后续乳酸片球菌LPAR1 的量化生产及应用研究提供参考依据。
近年来研究表明, 饲喂乳酸片球菌可增强鱼肠道免疫反应(Standen 等, 2013),提高对虾的抗氧防御能力、降低对虾的弧菌感染率(Castex 等,2010),有效改善对虾养殖水质状况等(赵士力等,2016)。 乳酸片球菌作为微生态制剂,在改善水产动物肠道健康,抑制有害病菌,提高水产动物免疫力以及净化水体环境等方面具有一定的成效和潜力。 因此,推测亲缘相近的乳酸片球菌LPAR1 在水产养殖应用上具有可行性和前景性。

