淫羊藿总黄酮和戊酸雌二醇对骨质疏松症大鼠TGF-β1/Smads信号通路的影响
肖平 侯平 林正坚 刘元豪 周钢
1.海口市第三人民医院骨科,海南 海口 571100
2.海南省人民医院(海南医学院附属海南医院)关节外科,海南 海口 570311
骨质疏松症(osteoporosis,OP)已成为威胁中老年人健康的一种常见和多发骨代谢疾病,随着全球人口老龄化程度的加剧,OP的发病率逐年上升,尤其是绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)。OP严重危害老年人的生活质量和身体健康[1]。因此,OP已是不可忽视的重要世界卫生问题。目前,雌激素、钙剂等是临床治疗OP的常用药物,虽取得了一定疗效,但长期使用不良反应较大,且价格昂贵[2]。近年来,中医药在防治OP上具有独特优势,淫羊藿总黄酮(total flavonoids of epimedium,TFE)具有抗骨质疏松作用,TFE可通过促进成骨细胞分化和抑制破骨细胞骨吸收来预防骨量丢失,尤其对PMOP具有良好的保护作用[3]。近年研宄表明TGF-β1/Smads信号通路与骨形成密切相关[4]。因此,本文基于TGF-β1/Smads信号通路探讨淫羊藿总黄酮和戊酸雌二醇对骨质疏松大鼠的实验研究。
1 材料与方法
1.1 实验动物
6月龄健康成年雌性SD大鼠75只,清洁SPF级,体质量(265.28±36.32)g,购于海南药物研究所有限责任公司[实验动物许可证号:SCXK(琼)2020-0007]饲养于海南医学院实验动物中心,同等饲养条件[环境温度(22±3)℃、湿度50%,自由食水]。本研究通过海南医学院动物实验中心伦理委员会批准。
1.2 实验试剂和仪器
淫羊藿总黄酮胶囊(TFE)(江苏康缘阳光药业有限公司),戊酸雌二醇片(廊坊高博京邦制药有限公司),羊抗鼠TGF-β1、Smads和GAPDH多克隆抗体购于美国Sigma公司,TGF-β1、Smads2和GAPDH引物由英国Biorbyt公司设计并合成,血清钙(Ca)、磷(P)、碱性磷酸酶(ALP)、骨钙素(OC)、Ⅰ型原胶原N端前肽(PINP)检测试剂盒购于北京中杉金桥生物技术有限公司。全自动生化分析仪购于日本HITACHI公司,Dexa Pro-1型双能X射线骨密度仪购于美国Bose公司,骨生物力学万能材料试验机购于沧州市鑫鼎试验仪器有限公司,PIDRed 96型聚合酶链式反应(PCR)仪购于美国LUNAR公司。
1.3 方法
1.3.1实验分组、造模与药物干预:以随机数字法分为假手术组(Sham组)、模型组(Model组)、淫羊藿总黄酮组(TFE组)、雌二醇组(E2V组)、联合药物组(TFE+E2V组),15只/组。除Sham组外,其余4组大鼠均采用“卵巢摘除法”构建骨质疏松大鼠模型[5]。常规麻醉备皮消毒,背侧腰椎棘突旁开1 cm处,0.8~1 cm纵行切口,钝性分离,结扎输卵管,切除菜花状卵巢并彻底止血。Sham组仅切除卵巢周围等量脂肪,但不摘除卵巢,术后青霉素预防感染,造模成功评估标准:骨密度降低和骨小梁微结构严重受损[6]。12周后开始给予灌胃药物干预,1次/d,药物剂量按照动物剂量体表面积换算公式进行折算,Sham组和Model组:等量0.9% Nacl灌胃,TFE组:淫羊藿总黄酮胶囊(150 mg/kg),E2V组:戊酸雌二醇片(0.6 mg/kg),TFE+E2V组:淫羊藿总黄酮胶囊(150 mg/kg)+戊酸雌二醇片(0.6 mg/kg)。连续给药12周后处死各组大鼠。
1.3.2组织样品采集:于末次给药后禁食8~12 h,采用心脏抽血处死大鼠,心脏取血5 mL至离心管,3 000 r/min,4 ℃离心5 min,分离血清,-20 ℃保存待测,完整剖离右侧整段股骨和腰椎(L3~5),截取长2~5 cm腰椎和股骨,0.9% Nacl冲洗,0.9% Nacl湿纱布包裹,待检测,检测完毕留取-80 ℃保存,后置液氮冻存备用。另留部分股骨10%多聚甲醛(室温)固定48 h,75%乙醇过夜,10%乙二胺四乙酸(EDTA)脱钙2~3周。将右侧股骨沿矢状面切开,脱水透明,浸蜡包埋,常规石蜡切片,60 ℃烤箱,室温保存备用。
1.3.3检测大鼠血清骨代谢指标:取出待测血清样品,海南省人民医院检验科采用全自动生化分析仪检测血清钙(Ca)、磷(P)、碱性磷酸酶(ALP)、骨钙素(OC)、Ⅰ型原胶原N端前肽(PINP)含量。
1.3.4检测股骨和椎体骨密度和灰重比:采用双能X线吸收(DEXA)法检测骨密度(BMD),将标本放置于仪器上,小动物BMD分析软件分析,扫面信息区为兴趣区,感兴趣区BMD分析。检测完毕后取出标本,置60 ℃烤箱中过夜,取出标本置于电子天平称其干重,再置于800 ℃马氏炉煅烧6~8 h,关炉,冷却后电子天平称其灰重,计算灰重/干重百分比(灰重/干重百分比=灰重/干重×100%)。
1.3.5检测股骨骨骼生物力学参数:取出冻存标本,置于室温复温30 min,三点弯曲试验,固定标本两端,股骨中点加载点,扫描参数(支点跨距18 mm,加载速度2 mm/min),依据载荷-应力-变形曲线获得骨生物力学相关参数。
1.3.6检测股骨形态计量学参数:常规进行脱蜡复水,苏木精-伊红染液进行染色,参照常规H & E染色进行操作,光学显微镜下观察,HMROVT显微图像分析软件进行骨形态分析,静态参数[骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)、骨小梁数量(Tb.N)、单位骨小梁面积破骨细胞数(Oc.N)、骨小梁面积百分数(Tb.Ar)]。
1.3.7检测股骨TGF-β1/Smads蛋白表达:常规脱蜡水化,依据SP试剂盒说明书逐步操作,3% H2O2封闭,10%血清室温孵育,滴加稀释兔抗鼠TGF-β1/Smads多克隆抗体,4 ℃过夜,滴加羊抗兔Ig二抗,DAB显色反应,苏木素核复染,光学显微镜观察,Image proplus 6.0图象分析系统测量平均积分光密度值(IOD)。
1.3.8检测各组大鼠股骨TGF-β1/Smads2 mRNA表达:取出待测股骨组织,液氮中研成粉末并进行匀浆,参照实时荧光定量PCR(RT-qPCR)法试剂盒说明书采用Trizol法进行提取总RNA,鉴定RNA纯度、浓度,RNA逆转录合成cDNA,cDNA为模板PCR扩增,PCR反应体系:TGF-β1上游引物:5’-GACAACTTCCTGTGCTCT-3’,反向引物:下游引物:5’-ACCGAAACTCTTGCCTCTTC-3’,Smads:上游引物:5’-GGTATCGGACGCCTGGTA-3’,下游引物:5’-TGTGCTTAGCGTCCTACTGGAAA-3’,逆转录和PCR扩增体系参照试剂盒说明书设定,PCR反应条件:94 ℃预变性7 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共40个循环,扩增曲线和熔解曲线分析,以GAPDH内参,琼脂糖凝胶电泳法检测PCR产物,2-ΔΔCt法计算各目标基因mRNA表达水平。
1.4 统计学分析
采用SPSS 25.0统计学软件进行分析,计量资料以“均数±标准差”表示,单因素方差分析(One-way ANOVA),两两比较采用Student Newman Keuls检验,如方差齐LSD-t检验,如方差不齐则Tamhane’sT2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 血清骨代谢指标
Model组血清Ca、P、OC、PINP较Sham组显著降低(P<0.01),E2V组、TFE组、TFE+E2V组血清Ca、P、OC、PINP较Model组均显著增加(P<0.05),TFE+E2V组血清Ca、P、OC、PINP较E2V组、TFE组均显著增加(P<0.05)。Model组血清ALP较Sham组显著增加(P<0.05),E2V组、TFE组、TFE+E2V组血清ALP较Model组均显著降低(P<0.05),TFE+E2V组血清ALP较E2V组、TFE组均显著降低(P<0.05)。见表1。

表1 各组大鼠骨代谢指标Table 1 Bone metabolism indexes of rats in each group
2.2 股骨和椎体骨密度、灰重比
Model组股骨和椎体骨密度、灰重比较Sham组显著降低(P<0.01),E2V组、TFE组、TFE+E2V组骨密度、灰重比较Model组均显著增加(P<0.05),TFE+E2V组骨密度、灰重比较E2V组、TFE组均显著增加(P<0.05)。见表2。

表2 各组大鼠骨密度和灰/干重比
2.3 股骨生物力学指标
Model组股骨最大载荷、最大位移、最大应力和弹性模量较Sham组显著降低(P<0.05),E2V组、TFE组、TFE+E2V组最大载荷、最大位移、最大应力和弹性模量较Model组均显著增加(P<0.05),TFE+E2V组最大载荷、最大位移、最大应力和弹性模量较E2V组、TFE组均显著增加(P<0.05)。见表3。

表3 各组大鼠骨生物力学指标Table 3 Bone biomechanics indexes of rats in each
2.4 股骨形态计量学参数
Model组股骨Tb.Ar、Tb.Th、Tb.N较Sham组均显著降低(P<0.01),E2V组、TFE组、TFE+E2V组Tb.Ar、Tb.Th、Tb.N较Model组均显著增加(P<0.05),TFE+E2V组Tb.Ar、Tb.Th、Tb.N较E2V组、TFE组均显著增加(P<0.05);Model组股骨Tb.Sp、Oc.N较Sham组显著增加(P<0.05),E2V组、TFE组、TFE+E2V组Tb.Sp、Oc.N较Model组均显著降低(P<0.05),TFE+E2V组Tb.Sp、Oc.N较E2V组、TFE组均显著降低(P<0.05)。见图1和表4。

表4 各组大鼠股骨骨形态计量学静态参数Table 4 The static parameters of femoral bone morphometry of rats in each
2.5 股骨TGF-β1/Smads2蛋白表达水平
TGF-β1和Smads2均表达于股骨骨小梁周围成骨细胞胞浆和部分胞核,阳性染色呈棕黄色颗粒或棕黄色弥漫成片。Model组股骨TGF-β1和Smads2蛋白表达较Sham组显著降低(P<0.01),E2V组、TFE组、TFE+E2V组TGF-β1和Smads2蛋白表达较Model组均显著增加(P<0.05),TFE+E2V组较E2V组、TFE组TGF-β1和Smads2蛋白表达均显著增加(P<0.05)。见图2、图3和表5。
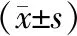
表5 各组大鼠股骨TGF-β1/Smads2蛋白表达水平Table 5 The expression level of TGF-β1/Smads 2 protein in the femur of rats in each group
2.6 股骨TGF-β1/Smads2 mRNA表达水平
Model组大鼠股骨TGF-β1和Smads2 mRNA表达较Sham组显著降低(P<0.01),E2V组、TFE组、TFE+E2V组TGF-β1和Smads2 mRNA表达较Model组均显著增加(P<0.05),TFE+E2V组较E2V组、TFE组TGF-β1和Smads2 mRNA表达均显著增加(P<0.05)。见表6。
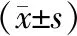
表6 各组大鼠股骨TGF-β1/Smads2 mRNA表达水平Table 6 The expression level of TGF-β1/Smads2 mRNA in the femur of rats in each group
3 讨论
OP应归属于中医学“骨痹、骨痿、骨枯”等范畴,祖国医学“肾藏精,精生髓,髓生骨,精足则髓足,髓足则骨强”[7-8]。中医认为肾藏精,主骨生髓理论,骨痿、骨枯的发生与肾虚关系颇为密切,OP发生原因是因肾精不足、骨失滋养所导致的[9]。“肾为先天之本,主骨生髓”,骨的生长、发育与肾密切相关[10]。故近年来中医药防治骨质疏松症多使用补肾药,能明显改善OP患者临床症状。淫羊藿(Epimedium)作为传统的补肾壮阳中药,属于小檗科植物淫羊藿的全草入药,具有补肾阳、益精气、坚筋骨、祛风湿的功效,是临床中治疗骨质疏松的常用药[11]。黄酮类化合物是淫羊藿的主要化学成分,TFE即可影响成骨细胞增殖、分化,促进骨形成,又可抑制破骨细胞生成,减少骨质丢失,抑制骨吸收,改善骨代谢,具有显著防治骨质疏松的作用[12-13]。研究表明合用雌激素,发挥较强的抑制骨转换作用,对增加骨量可能有协同作用,同时淫羊藿具有雄激素样作用,从而可对抗雌激素的毒副作用[14]。
转化生长因子β-1(transforming growth factor-β,TGF-β1)/Smads通路在骨重建中发挥着重要的作用[15]。TGF-β1是参与骨重建调节过程中最重要的生长因子,能促进成骨细胞增殖分化,刺激骨形成,同时加快破骨细胞形成及骨吸收,是骨形成和骨吸收过程中重要调节偶联因子,调节骨重建,维持骨代谢的平衡[16]。Smads蛋白家族是TGF-β唯一的细胞内信号转导因子,TGF-β1可活化下游Smad蛋白,最终将TGF-β的信号应答由胞膜转导入胞核内,启动靶基因转录,刺激骨形成[17]。Smad7是TGF-β/Smads通路上的抑制蛋白,可抑制阻止TGF-β1信号传导,在骨形成和骨重建过程中起着极其重要的作用[18]。研究证明TGF-β/Smads通路与骨质疏松症有密切关系[19]。
淫羊藿总黄酮温肾壮阳,戊酸雌二醇补雌激素,是中西医药防治PMOP的常用药物,二者合用,有平补阴阳、益肾健骨的功效,本研究表明去势大鼠骨组织smad2/3的蛋白和mRNA表达均降低,骨密度、骨生物力学指标、骨代谢和骨量等指标均降低,给予淫羊藿总黄酮和戊酸雌二醇药物治疗后可以明显提高OP大鼠骨组织中TGF-β1蛋白及mRNA的表达,纠正骨代谢紊乱,增加骨量,提高骨密度和骨强度,改善骨微结构,促进骨形成,抑制骨吸收。淫羊藿总黄酮联合戊酸雌二醇可能通过调控骨组织TGF-β1/Smads信号转导通路有效防治OP。淫羊藿总黄酮可通过上调骨TGF-β1/Smads2的mRNA和蛋白表达,增加BMD和骨小梁数量,改善股骨微结构,提高血清骨代谢水平,从而修复骨构建失衡,起到防治OP的作用[20-21]。
OP的发病机制与TGF-β1/Smads信号转导通路密切相关,淫羊藿总黄酮联合戊酸雌二醇可能通过调节TGF-β1/Smads信号转导通路,防止骨质疏松大鼠骨量丢失,改善骨代谢,修复骨显微结构,提高骨强度,从而发挥防治骨质疏松的作用,并为以后探索中西医预防OP方面奠定了坚实的理论基础。

