鲎血蓝蛋白的分离纯化及其酚氧化酶活性的初步研究
刘永豪,张干欢,董鸿睿,康信煌,张国光,吴育廉,邓春梅
(广东海洋大学化学与环境学院,广东 湛江 524088)
血蓝蛋白是存在于节肢动物(螯肢类、甲壳类、多足类和蜘蛛类)和软体动物(腹足类和头足类)血淋巴中含有2个铜离子的呼吸蛋白,它是一种负责运输氧的大分子多聚体,与氧结合时呈蓝色,脱氧状态下呈无色[1]。血蓝蛋白功能甚多,除了具有输氧功能,还具有酚氧化酶活性[2-4]、抗菌活性[5]、抗肿瘤活性[6]、凝集活性[7]等多种非特异性免疫学活性。研究证实,血蓝蛋白的物化性质、基因序列、蛋白质结构与酚氧化酶非常相似[8],均具有2个铜离子结合区CuA和CuB,它们与6个组氨酸连接在一起,形成一个可以与酚类底物结合的活性中心。酚氧化酶通过这个铜-氧结合位点,将邻苯二酚进一步催化生成邻苯二醌,在植物和节肢动物体内合成黑色素和排除异己成分发挥着重要的作用。目前,国内外学者对血蓝蛋白的研究主要集中在凡纳滨对虾、蟹类和其它甲壳动物,而对鲎血蓝蛋白的研究甚少。研究[9]发现,鲎血浆中血蓝蛋白的含量很高,占血浆总蛋白的90%~95%。因此,作者基于一种酚氧化酶活性蛋白的制备方法[10],分离纯化鲎血蓝蛋白,探究其表达酚氧化酶活性的影响因素,为充分利用珍贵的鲎血浆资源提供重要的实验依据。
1 实验
1.1 材料、试剂与仪器
中国鲎血浆,湛江博康海洋生物有限公司。
透析袋(MW=3500);Sephacryl S-100丙烯葡聚糖凝胶、牛胰蛋白酶、牛血清白蛋白(BSA)、考马斯亮蓝G-50、邻苯二酚、十二烷基磺酸钠(SDS)、脲(尿素)、硫酸铵、溴酚蓝、无水乙醇、盐酸、氢氧化钠、氯化钠、氯化钾、磷酸氢二钠、磷酸氢钾、氯化镁等试剂均为国产分析纯;考马斯亮蓝R-250,优级纯。
电子分析天平;DNM-9606型酶标仪;PHS-2F型pH计;台式高速冷冻离心机;DF-101S型集热式恒温磁力搅拌器;HL-2B型数显恒流泵;HD-1型核酸蛋白检测仪;HR/T20M型台式冷冻干燥机;TU-1810型紫外可见分光光度计;SPH-100B型恒温培养摇床;DYY-6C型电泳仪。
1.2 鲎血蓝蛋白的分离纯化
采用饱和硫酸铵盐析法初步纯化鲎血浆蛋白,低温高速离心,去上清,将沉淀溶于0.1 mol·L-1PBS缓冲液,通过透析袋透析除盐、丙烯葡聚糖凝胶柱层析纯化,得到鲎血蓝蛋白。
1.3 紫外可见吸收光谱分析及SDS-PAGE分析
紫外可见吸收光谱分析:将纯化后的鲎血蓝蛋白溶于0.1 mol·L-1PBS缓冲液,采用紫外可见分光光度计在250~600 nm波长范围内扫描。
SDS-PAGE分析:取纯化后的鲎血蓝蛋白溶液,加入聚乙二醇浓缩,按常规方法将浓缩后的鲎血蓝蛋白进行SDS-PAGE分析(12%分离胶,5%浓缩胶),使用考马斯亮蓝R-250进行染色,然后加入脱色液进行脱色,直到出现清晰的蛋白质条带为止。
1.4 考马斯亮蓝法(Bradford法)[11]测定鲎血蓝蛋白浓度
以0.2 mg·mL-1牛血清白蛋白溶液为标准蛋白液,分别吸取0 μL、100 μL、200 μL、300 μL、400 μL、500 μL牛血清白蛋白溶液,加蒸馏水补至1 000 μL,加入5 mL考马斯亮蓝G-50溶液,混匀后,测定595 nm处吸光度,绘制标准曲线。
取纯化后的鲎血蓝蛋白,同法测定595 nm处吸光度,根据标准曲线的线性回归方程计算鲎血蓝蛋白的浓度。
1.5 鲎血蓝蛋白酚氧化酶活性的测定
参照文献[12]测定鲎血蓝蛋白酚氧化酶活性。将50 μL鲎血蓝蛋白加入到100 μL 0.1 mol·L-1的PBS缓冲液中,恒温振荡30 min;加入50 μL邻苯二酚,混匀,记录每分钟溶液在405 nm处吸光度(OD405)变化[13];用蒸馏水代替鲎血蓝蛋白作为对照组,各组平行测定3次。
酚氧化酶活力单位定义:以邻苯二酚为底物,通过测定其被酚氧化酶氧化后的产物黑色素的生成量来确定酚氧化酶活力,每分钟每毫升鲎血蓝蛋白在实验条件下OD405值增加0.001为1个酶活力单位(U·min-1·mL-1)[14-15]。
1.6 鲎血蓝蛋白酚氧化酶活性的影响因素分析
1.6.1 单因素实验
采用单因素实验分别考察pH值(5.7、6.0、6.4、6.6、6.8、7.0、7.4、7.7、8.0)、温度(25 ℃、30 ℃、34 ℃、37 ℃、40 ℃、45 ℃、50 ℃)、邻苯二酚与鲎血蓝蛋白浓度比(0.3∶1、0.5∶1、1.0∶1、1.5∶1、2.0∶1、2.5∶1、3.0∶1)、时间对鲎血蓝蛋白酚氧化酶活性的影响,每组实验重复3次,结果取平均值。
1.6.2 响应面实验
在单因素实验的基础上,根据Box-Behnken中心组合设计原理,固定恒温振荡时间为30 min,以温度、pH值、邻苯二酚与鲎血蓝蛋白浓度比、时间为自变量,设计4因素3水平响应面实验,对鲎血蓝蛋白酚氧化酶的影响因素进行分析。
2 结果与讨论
2.1 鲎血蓝蛋白的紫外可见吸收光谱(图1)
从图1可知,280 nm处存在蛋白质吸收峰,340 nm处存在铜离子和氧离子结合的特有吸收峰,且280 nm处的吸收峰强度大于340 nm处的,这是鉴别血蓝蛋白的特征之一[4]。

图1 鲎血蓝蛋白的紫外可见吸收光谱Fig.1 UV-Vis absorption spectrum of hemocyanin from Limulus
2.2 鲎血蓝蛋白的SDS-PAGE图谱(图2)

1,2.纯化的鲎血蓝蛋白 M.marker
从图2可以看到2条分子量相近的条带,说明纯化的鲎血蓝蛋白有2个亚基,与标准蛋白比较,其分子量约为66 kDa,为典型的节肢动物血蓝蛋白。
2.3 鲎血蓝蛋白的浓度
对牛血清白蛋白的标准曲线(图3)进行拟合,得到线性回归方程为y=7.429x+0.0146。测得鲎血蓝蛋白溶液的吸光度为0.502,依据线性回归方程计算得到鲎血蓝蛋白浓度为0.065 6 mg·mL-1,由于原样稀释了50倍,因此,纯化后的鲎血蓝蛋白浓度为3.28 mg·mL-1。

图3 牛血清白蛋白的标准曲线Fig.3 Standard curve of bovine serum albumin
2.4 单因素实验结果
2.4.1 pH值对鲎血蓝蛋白酚氧化酶活性的影响(图4)
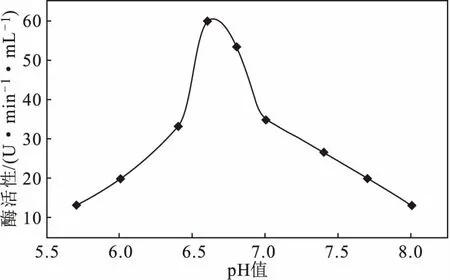
图4 pH值对鲎血蓝蛋白酚氧化酶活性的影响Fig.4 Effect of pH value on phenoloxidase activity of hemocyanin from Limulus
由图4可知,随着pH值的增大,鲎血蓝蛋白酚氧化酶活性呈先升高后降低的趋势,当pH值为6.7时,酶活性达到最高。因此,选择6.7作为响应面实验pH值的中心点。
2.4.2 温度对鲎血蓝蛋白酚氧化酶活性的影响(图5)

图5 温度对鲎血蓝蛋白酚氧化酶活性的影响Fig.5 Effect of temperature on phenoloxidase activity of hemocyanin from Limulus
由图5可知,温度对鲎血蓝蛋白酚氧化酶活性的影响较为显著,随着温度的升高,酶活性呈先升高后降低的趋势,当温度为36 ℃时,酶活性达到最高;继续升高温度至50 ℃时,几乎无活性。因此,选择36 ℃作为响应面实验温度的中心点。
2.4.3 邻苯二酚与鲎血蓝蛋白浓度比对鲎血蓝蛋白酚氧化酶活性的影响(图6)

图6 邻苯二酚与鲎血蓝蛋白浓度比对鲎血蓝蛋白酚氧化酶活性的影响Fig.6 Effect of concentration ratio of 1,2-benzenediol to hemocyanin from Limulus on phenoloxidase activity of hemocyanin from Limulus
由图6可知,随着邻苯二酚与鲎血蓝蛋白浓度比的增大,即底物邻苯二酚浓度的增大,鲎血蓝蛋白酚氧化酶活性呈先升高后降低的趋势,当浓度比为1.5∶1时,酶活性达到最高。因此,选择1.5∶1作为响应面实验邻苯二酚与鲎血蓝蛋白浓度比的中心点。
2.4.4 时间对鲎血蓝蛋白酚氧化酶活性的影响
酶活力的含义是指酶催化底物反应的初速度[16],当底物浓度足够大时,酶催化底物反应的速度达到最快,此时生成的产物浓度与特定期间的反应时间呈一定的线性关系,拟合曲线的斜率反映酶的活性[17]。测定鲎血蓝蛋白酚氧化酶活性在30 min和10 min内的表达情况,结果如图7所示。

图7 鲎血蓝蛋白酚氧化酶活性在30 min(a)、10 min(b)内的表达情况Fig.7 Expression of phenoloxidase activity of hemocyanin from Limulus during 30 min(a) and 10 min(b)
由图7a可知,在30 min内,OD405-t曲线整体呈抛物线,吸光度与时间呈线性相关,随着时间的延长,OD405值逐渐升高,且OD405值升幅越来越小并逐渐趋于平缓。为了探究酶活性的最佳表达时间,测定10 min内酶活性(图7b),发现在3 min时,OD405-t曲线线性程度最高,斜率达到最大值。因此,选择3 min作为响应面实验时间的中心点。
2.5 响应面实验结果
2.5.1 响应面实验设计与结果(表1)
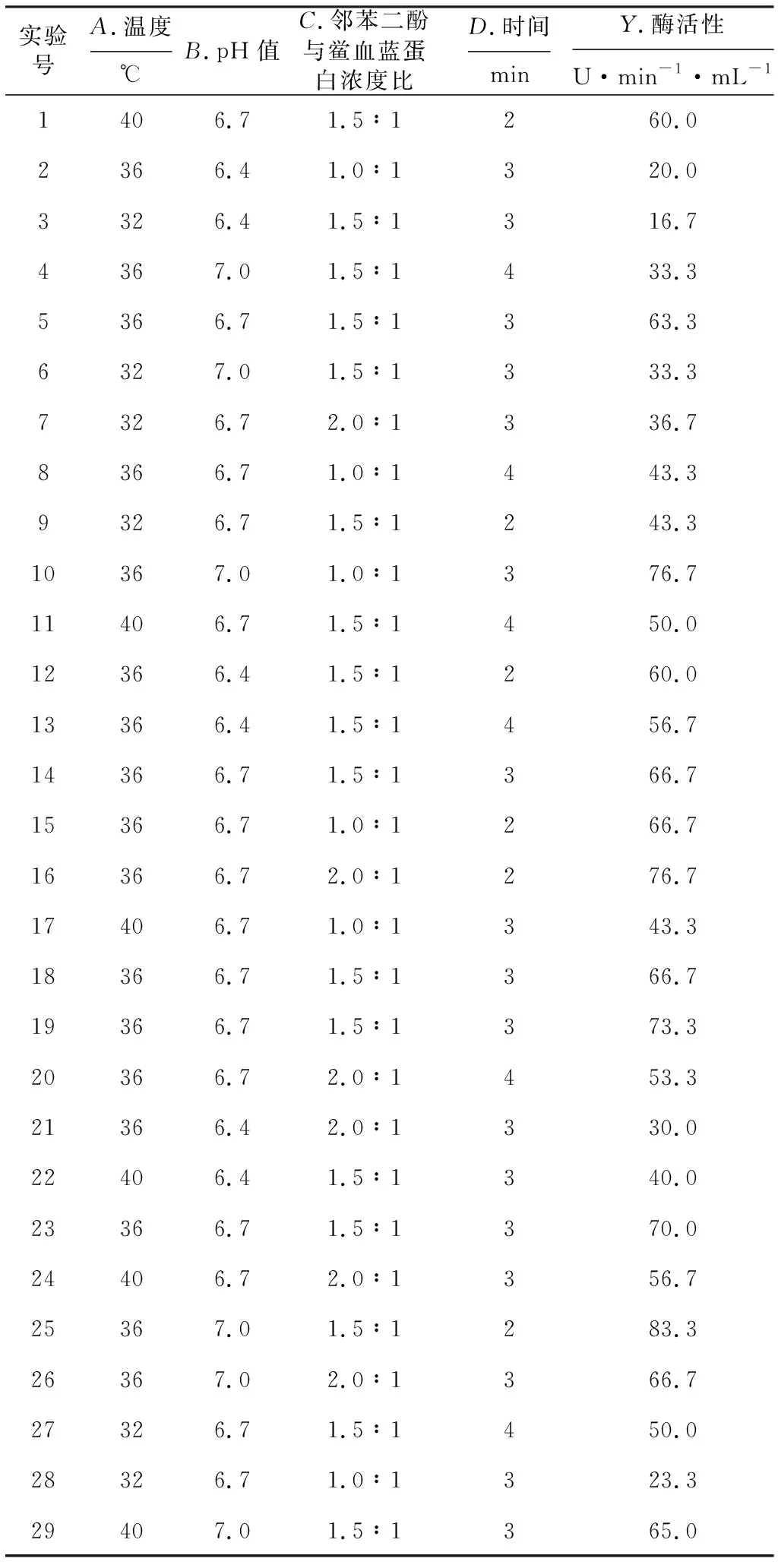
表1 响应面实验设计与结果Tab.1 Design and results of response surface methodologies
2.5.2 回归模型的建立与方差分析
运用Design-Expert软件对响应面实验结果进行多元回归拟合,得到多元二次回归模型方程为:Y=68.00+4.18A-0.0250B+5.00C-11.70D+2.10AB-4.17AD-5.00BC-11.68BD-18.59A2-10.66B2-9.20C2+1.20D2。
对上述回归模型进行方差分析,结果见表2。

表2 回归模型的方差分析Tab.2 Variance analysis of regression model
由表2可知,该模型极显著(P<0.01),失拟项不显著,回归模型方程R2=0.9937,说明该模型与实际实验的误差小,回归模型的拟合度较好,采用此模型探究鲎血蓝蛋白酚氧化酶活性最佳表达条件是合理可行的。时间对酶活性的影响极显著(P<0.01);温度、邻苯二酚与鲎血蓝蛋白浓度比对酶活性的影响显著(P<0.05);pH值对酶活性的影响不显著。各因素对鲎血蓝蛋白酚氧化酶活性的影响大小为:时间>邻苯二酚与鲎血蓝蛋白浓度比>温度>pH值。
2.5.3 响应面分析
响应面图和等高线图能直观地反映各因素交互作用与鲎血蓝蛋白酚氧化酶活性之间的关系,响应面越陡,表示影响越显著;等高线趋于圆形表示两因素交互作用不显著,椭圆形或马鞍形则表示交互作用显著[18]。各因素交互作用对鲎血蓝蛋白酚氧化酶活性影响的响应面图如图8所示。

图8 各因素交互作用对鲎血蓝蛋白酚氧化酶活性影响的响应面图Fig.8 Response surface plot for effect of interaction between various factors on phenoloxidase activity of hemocyanin from Limulus
2.5.4 验证实验
由优化后的模型可知,鲎血蓝蛋白酚氧化酶活性最佳的表达条件为:温度36.7 ℃、pH值6.8、邻苯二酚与鲎血蓝蛋白浓度比1.7∶1、时间2.1 min,在此条件下,测得鲎血蓝蛋白酚氧化酶活性为83.3 U·min-1·mL-1,与预测值83.7 U·min-1·mL-1基本吻合,说明回归模型与实际情况拟合较好。
3 结论
采用饱和硫酸铵盐析法、透析除盐和丙烯葡聚糖凝胶柱层析分离纯化鲎血蓝蛋白,纯化后的鲎血蓝蛋白在280 nm 、340 nm处有特征吸收峰,有2个蛋白亚基,分子量约为66 kDa,为典型的节肢动物血蓝蛋白。在温度为36.7 ℃、pH值为6.8、邻苯二酚与鲎血蓝蛋白浓度比为1.7∶1、时间为2.1 min的条件下,鲎血蓝蛋白酚氧化酶活性最高,为83.3 U·min-1·mL-1。本研究得到的鲎血蓝蛋白酚氧化酶活性的最佳表达条件,可应用于鲎的养殖,通过改变养殖条件人工诱导鲎血表达酚氧化酶活性,从而提高鲎的自身免疫力;也可以用于检测器的设计,检测环境中酚类物质的含量。

