慢病毒介导的BMP-BMP-2 基因转染大鼠BMSCsBMSCs及对BMSCsBMSCs 增殖的影响
严 丹 红 ,姚 骅 珊 ,方 月 琴 ,王 远 鹏 ,马 文 慧 ,李 保 根
(苏州健雄职业技术学院医药科技学院,太仓 215411)
骨缺损在临床上发病率高,如何修复大段骨缺损是骨科面临的挑战。目前临床上骨缺损修复的方法主要有自体骨移植与异体骨移植。[1]由于自体骨移植材料有限,且存在供骨部损伤及塑形困难等一系列问题,而异体骨移植又存在疾病传播的潜在危险以及排斥反应的严重后果,因此两种方法均无法满足患者需求。近年来,组织工程技术的迅速发展为骨缺损修复治疗带来新的选择。[2]现有的骨替代材料采用有机或无机材料支架,不能兼具微观多孔隙结构、良好的生物相容性、可降解性、可控性和力学性能。因此,开发具有生物特性且与正常骨相似的复合支架材料是现在骨组织工程领域研究的重点方向。[3]
BMSCs 因取材方便,具有多向分化潜能、低免疫原性等优势,是组织工程中比较理想的种子细胞。生长因子是骨组织工程中三大要素之一,可调节成骨细胞的增殖和成骨能力,而BMP-2 是骨生长启动因子,是已知BMP 家族中具有最强成骨能力的骨生长因子之一。[4]其基因重组产品rhBMP-2(人重组骨形态发生蛋白Ⅱ)于2007 年被美国食品药品监督管理局正式批准应用于临床,但rhBMP-2 是小分子物质,单纯植入后易被血液或组织液稀释,且很快被蛋白酶降解,半衰期短,不能持续发挥其骨诱导作用。[5]此外,作为外源性蛋白植入体内,用量大时可能会产生毒性反应,还可能引起免疫排斥。研究人员开发了多种包裹rhBMP-2 的缓释载体,以用于基础与临床治疗研究,但或多或少存在一些不足之处。例如聚乳酸、聚乳酸和聚羟基乙酸的共聚物[6-7]等具有骨传导性及可降解性,作为载体时,大部分rhBMP-2 在植入早期就弥散到组织中,初期降解较快,而且合成的高分子降解物呈酸性,会引起局部酸碱度下降,导致局部组织的无菌性炎症和异物反应,对新骨形成具有抑制作用。I 型胶原的分子结构可以阻止rhBMP-2 迅速弥散流失,但是天然有机物有不同程度的免疫原性。[8]BMP-2 转基因诱导成骨可实现一定时间内BMP-2 的持续表达,能克服上述载体材料的种种不足。已有动物实验研究表明,BMP-2 基因修饰的犬BMSCs 复合磷酸钙骨水泥材料,植入骨缺损模型中能修复节段性骨缺损。[9]因此,转基因BMSCs 的应用具有广阔前景。但是BMSCs 的转染时限、过程及效率,转基因BMSCs 的生物学效应,转基因BMSCs 的监控手段等,有待于进一步研究。本实验基于基因治疗原理,构建基因整合慢病毒表达载体,介导BMP-2 基因诱导入大鼠BMSCs,使BMP-2 在细胞体内连续稳定表达。之所以选择慢病毒作为表达载体,是因为慢病毒对BMSCs 的转染效力较高,且不会发生非特异性细胞排斥反应。此外,慢病毒载体中携带绿色荧光蛋白GFP,转染后用倒置荧光显微镜观察GFP 绿色荧光,便于跟踪、选择和富集转染的细胞。
1 实验材料
1.1 实验动物
无特定病原体SPF级大鼠10只,体重250 g~280 g,6周~9周龄,由昭衍(苏州)新药研究中心提供。实验过程中对动物的处置符合中华人民共和国科学技术部2006 年颁布的《关于善待实验动物的指导性意见》标准。
1.2 试剂耗材
DMEM(Dulbecco′s Modified Eagle Medium,简称DMEM)培养基、质量分数0.25%的胰酶、双抗、磷酸盐缓冲液PBS、胎牛血清、总核酸RNA 提取试剂盒、Taq 聚合酶、逆转录试剂盒、噻唑蓝MTT(Invitrogen 公司);反转录PCR 试剂盒(Takara公司);兔抗人BMP-2、生物素HRP 标记的山羊抗兔IgG 抗体、辣根过氧化物酶GAPDH标记链霉亲和素HRP 抗体、DAB 辣根过氧化物酶显色试剂(上海宝生物公司);细胞培养瓶、96 孔板(康宁公司);LV重组载体系列(大鼠BMP-2慢病毒表达载体)和绿色荧光蛋白GFP(上海吉凯基因化学有限公司)。
1.3 仪器设备
生物安全柜(型号BHC-1300IIA-B3,苏州净化设备有限公司);荧光定量PCR 仪(型号TP800,Takara公司);CO2细胞培养箱(型号 HERAcell 240i,Thermo 公司);台式高速离心机(型号 5810R,Eppendorf 公司);荧光倒置显微镜(型号YDF-70,Olympus 公司);酶标仪(型号Varioskan LUX,Thermo 公司)。
2 方法和步骤
2.1 大鼠BMSCs 的分离培养
取6 周~9 周龄的体质量为250 g~280 g 的大鼠,采用Percoll 细胞分离液,使用密度梯度离心法和差速贴壁传代筛选法分离培养大鼠的BMSCs。将大鼠安死术后,无菌条件下解剖大鼠,分离软组织,取股端,用培养液冲刷大鼠骨髓,使细胞分离,制备细胞悬液。使用离心机以1 500 r/min速度离心15 min。用3 mL培养液重新悬浮,慢慢加入含有等量Percoll细胞分离液的离心管中,以2 000 r/min的速度离心30 min。收集界面层细胞,用DMEM 培养基洗涤2 次,离心后弃上清液,然后加入含胎牛血清(体积分数为10%)的DMEM 培养基,按照4×105个/cm2接种在细胞培养瓶中,放入CO2体积浓度为5%、温度为37℃、湿度饱和的细胞培养箱中培养。每7天换1次细胞液,待细胞贴壁达到90%时,使用胰酶消化细胞,再进行细胞传代。
2.2 慢病毒介导的BMP-2 基因转染
选择pHBLV-U6-GFP-PGK-Puro 作为质粒的克隆载体。BMP-2 慢病毒表达载体的克隆切入点是XhoI/BamHI。目的基因慢病毒质粒构建、测序、包装、浓缩及病毒滴度测定委托上海吉凯基因医学科技股份有限公司进行。在转染的前1 d,用胰酶消化细胞,加入含胎牛血清(体积分数为10%)的DMEM 培养基培养,细胞密度为 6×106个/mL~ 8×106个/mL。[10]将状态良好的第三代 BMSCs 铺于 6 孔板,细胞量为每孔 5×105个细胞,37℃培养过夜。第二天待细胞贴壁后,将慢病毒原液解冻,测定病毒滴度为5×108TU/mL,MoI(Multiplicity of Infection,感染复数)为20,将含有20 μL 病毒液的培养液轻轻滴加在细胞上并混匀。将培养皿置于培养箱中继续培育。第二天用新鲜的完全培养液取代含有病毒的旧液,再将培养皿置于培养箱中继续进行培育。待到第五天取出培养皿,用荧光倒置显微镜观察细胞荧光表达情况。
2.3 细胞BMP-2 mRNA 表达水平
用总RNA 提取试剂盒Trizol 提取相对稳定并已经转染的大鼠BMSCs 总RNA,以总RNA 为模板进行反转录,具体操作参照说明书。反转录后以BMP-2 引物对其进行扩增。取无菌PCR 管,管内依次加入反转录产物 2 μL、上游引物 2 μL、下游引物 2 μL、PCR 缓冲液 5 μL、Taq 聚合酶 1 μL,补足去离子水使总体积为50 μL。反应条件为 95°C 下 30 s,54°C 下 40 s,72°C 下 30 s,进行 30 个循环。以 1.2% 琼脂糖凝胶进行电泳。反应中以肌动蛋白β-actin 为内参照物,与未经转染的大鼠BMSCs 作为阴性对照[11],检测样品中mRNA相对表达量。BMP-2(F):5’-AATTCTGGGAGGGCTTGGTT-3’,(R)5’-CTGTTTCAGGCCGAACATGC-3;β-actin(F):5’-GTTGACATCCGTAAAGAC-3’(R)5’-GGACAGTGAGGCCAGGATA-3’。
2.4 蛋白质印迹分析BMP-2 的胞内表达
将稳定已转染和未转染的BMSCs 以1×105个/cm2密度接种在细胞培养瓶中,等细胞生长至90%融合度时,用胰酶消化细胞,在收集的细胞中加入细胞裂解液,于4℃裂解细胞,以12 000 r/min 的速度离心15 min,上清液即为蛋白提取液。用质量浓度为15%的SDS-PAGE(蛋白质变性剂聚丙烯酰胺凝胶电泳)分离蛋白质,使用80 V 电压、120 min 转印至PVDF(聚偏二氟乙烯)膜,依次以兔抗人BMP-2、HRP 标记的羊抗兔IgG进行杂交,然后用DAB 显色并进行数据分析。
2.5 ELISA 检测细胞培养上清液中目的蛋白含量
将持续转染的BMSCs 和未转染的BMSCs 培养上清液,采取双抗体夹心法检测其中目标蛋白的表达。以兔抗人BMP-2 抗体包被96 孔板,依次加入细胞培养上清液、兔抗人BMP-2 抗体、HRP 标记的羊抗兔IgG、GAPDH 标记的HRP,DAB 显色。用酶标仪读取460 nm 处的吸光度。
配制 500 ng/mL 标准 BMP-2 蛋白稀释液,倍比稀释成 250 ng/mL、125 ng/mL、62.5 ng/mL、31.25 ng/mL、15.63 ng/mL、7.813 ng/mL、3.906 ng/mL,测定各稀释样品在460 nm 处的吸光度,绘制出标准曲线。
2.6 MTT 法 检 测 BMSCs 增 殖 能 力
以空载体BMSCs 和未转染BMSCs 作为实验对照,检测转染后第三代BMSCs 的增殖能力。将细胞以2×103个/mL 的密度接种于5块96孔板中。细胞贴壁后,采用MTT 法检测BMSCs 增殖能力。培养至预定天数,检测时每孔加入5 mg/mL 的MTT 染液20 μL,在培养箱继续培养4 h,吸去孔内的培养液,每孔加入二甲基亚砜150 μL 溶解结晶。振荡器振荡10 min,摇匀,用酶标仪读取每孔490 nm 处的吸光度。
2.7 数据的统计学处理
数据用均数±标准差表示,结果采用单因素方差分析(当P<0.05 时,判定分析结果具有显著的统计学差异)。所有检验在SPSS 13.0 统计软件上完成。
3 结果与分析
3.1 大鼠BMSCs 的形态观察
原代培养的BMSCs 接种24 h 后开始贴壁,贴壁细胞有伪足伸出,呈现多个细胞聚集样。培养至第三代时,细胞为长梭形成纤维细胞,完全融合后呈漩涡状或者辐射状生长,细胞增殖迅速,如图1 所示。

图1 BMSCs 培养的细胞形态照片(×200)
3.2 慢病毒介导的BMP-2 基因转染结果
细胞转染前后荧光显微镜照片见图2,细胞转染前无绿色荧光,慢病毒介导的BMP-2基因转染BMSCs后在荧光显微镜下显示绿色荧光,表明BMSCs 被成功转染。诱导转染后细胞形态变化与预期相符。

图2 细胞转染前后荧光显微镜照片
3.3 BMP-2 mRNA 表达水平
BMP-2 mRNA 表达水平检测结果见图3。RT-PCR 结果显示,转染细胞的BMP-2 mRNA 表达水平明显高于未转染的细胞。BMP-2 mRNA 的相对表达量两组比较差异具有统计学意义(P<0.05)。

图3 BMP-2 mRNA 相对表达量
3.4 蛋白质印迹分析BMP-2 的胞内表达
蛋白印迹结果如图4 所示,转染后细胞以兔抗人BMP-2 抗体、GAPDH 标记的羊抗兔IgG 抗体进行杂交。在转染细胞裂解液中检测出带状物,与预期的效果一致。反观在未转染细胞裂解液中只有GAPDH 条带,没有检测出目的基因BMP-2 条带。
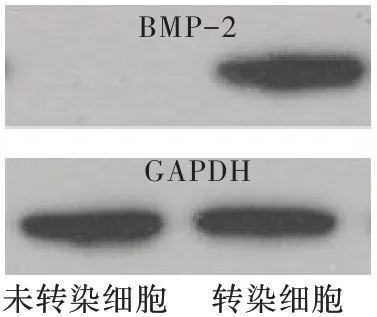
图4 BMP-2 蛋白表达
3.5 ELISA 检测细胞培养上清液中目的蛋白的质量浓度
用酶标仪读取每孔的吸光度,根据标准曲线(见图5)计算细胞培养上清液中BMP-2 目的蛋白的质量浓度,结果如图6 所示,转染细胞的培养上清液中BMP-2 的质量浓度明显高于未转染细胞的(P<0.05)。

图5 标准曲线

图6 细胞培养上清液中BMP-2目的蛋白的质量浓度
3.6 MTT 法 测 定 BMSCs 增 殖 能 力
活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT 还原为水不溶性的蓝紫色结晶甲臜并沉积在细胞中,而死细胞无此功能。二甲基亚砜能溶解细胞中的甲臜,用酶标仪测定490 nm 处的吸光度,可间接反映活细胞数量。在一定细胞数范围内,MTT 结晶形成量与细胞数成正比。由图7 可见,与未转染的BMSCs、空载体BMSCs相比,转染BMSCs 增殖速度显著高(P<0.05)。
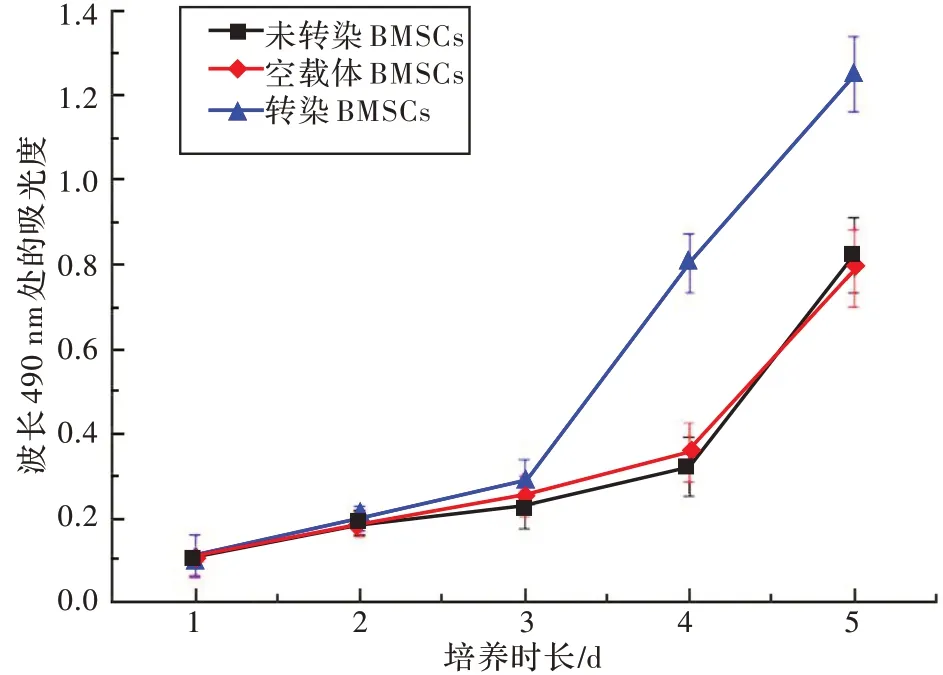
图7 MTT 法测定的BMSCs 增殖结果
4 讨论
虽然BMSCs 易获得,但它在骨髓中含量较低,因此科研人员往往需要对BMSCs 在体外进行分离、纯化和大规模扩增以获得大量高纯度的BMSCs 来满足实际应用需要。目前,国内外常用的分离方法有贴壁筛选分离法、密度梯度离心法、细胞表面分子标记分选法。本实验中先用密度梯度离心法分离BMSCs,再采用贴壁筛选分离法对细胞进行纯化,此方法操作简便,可获得大量性能稳定的BMSCs。
通过基因工程技术治疗骨缺损相比传统手段具有较大的优势。慢病毒载体介导的基因治疗技术不仅可以高效、持续、可控地于局部释放高生物活性的成骨类生长因子,还可以从根本上解决外源性生物蛋白成骨作用弱、价格高、降解速度快等问题。BMP-2 是骨缺损修复领域研究最多、最深入的成骨生长因子。本实验成功构建了含BMP-2 基因的重组慢病毒表达载体,倒置荧光显微镜下观察到转染BMSCs 显示绿色荧光,转染BMSCs 的BMP-2 mRNA 表达水平明显高于未转染BMSCs 的,转染细胞裂解液中检测出BMP-2 条带,转染细胞培养上清液中BMP-2蛋白质量浓度明显高于未转染细胞培养上清液中的BMP-2蛋白质量浓度。MTT 法的测定结果显示,BMP-2基因转染的BMSCs 增殖速度显著高于空载体细胞和未转染细胞(P<0.05)。

