FeGd纳米复合物作为新型T1-T2双模态纳米磁共振造影剂的合成与性能
李庆东 张彩云 綦翔宇 姜文国 田 梗 张桂龙
1 滨州医学院药学院 山东 烟台 264003;2 滨州医学院医学影像探针研究所 山东 烟台 264003
成像技术是临床诊断疾病的重要手段。磁共振成像(magnetic resonance imaging, MRI)技术具有软组织成像效果好、无电离辐射、空间分辨率高等特点,受到患者和临床工作者的青睐,已经成为临床中最重要的影像学诊断工具之一[1]。目前,虽然临床磁共振成像仪在实际诊断过程中对软组织具有较高分辨率,但在正常组织和疾病组织之间的成像信号差异不明显,难以精确定位出病灶组织[2]。注射造影剂是临床中提高正常组织和疾病组织之间对比度的最常用方法。造影剂主要分为T1型造影剂和T2型造影剂两类[3]。T1造影剂主要衰减氢质子的自旋晶格(T1)弛豫时间,而T2造影剂则衰减氢质子的自旋-自旋(T2)弛豫时间[4]。直观上,T1造影剂主要使病灶组织的加权图像变得更亮,亦称为阳性造影剂,其以钆螯合物为典型代表,如马根微显(Gd-DTPA)、钆特酸葡胺(Gd-DOTA)等[5-6]。相对于T1造影剂,T2造影剂主要使病灶组织的加权图像更暗,也称阴性造影剂,以磁性氧化铁纳米颗粒为典型代表,如菲立磁[7-8]。然而,T1造影剂的信号容易受到脂肪组织和顺磁性离子的影响,造成对疾病的误诊。T2造影剂的信号也会遭受出血、钙化点等因素影响,产生局部伪影,导致诊断的不准确[9-10]。为了弥补T1和T2单模态磁共振造影剂的缺陷,研究人员通过开发T1-T2双模态磁共振造影剂,为疾病的临床精准诊断提供了有效途径[11-13]。本研究使用一锅高温溶剂热合成法制备了一种新型的FeGd纳米复合物作为高性能的T1-T2双模态磁共振造影剂,并在体外验证了其造影性能以及生物安全性,为双模态磁共振造影剂的开发和临床应用提供了重要信息。
1 材料与方法
1.1 试剂与材料 乙酰丙酮铁【Fe(acac)3】、乙酰丙酮钆【Gd(acac)3】、乙二醇(EG)、聚乙烯吡咯烷酮(PVP)、十六烷基三甲基溴化胺(CTAB)、三乙醇胺(TEA)购自上海阿拉丁公司。细胞技术试剂盒(MTT)购自上海碧云天生物技术有限公司。
1.2 主要仪器 透射电子显微镜(TEM,JEM-2100F,日本JEOL公司),动态光散射粒度分析仪(DLS,Nanotrac Wave Ⅱ,美国Microtrac公司),电感耦合等离子体光学发射光谱仪(ICP-OES,AvioTM220 Max,美国PerkinElmer公司),热重分析仪,红外光谱仪,7.0 T磁共振成像仪等。
1.3 实验方法
1.3.1 FeGd纳米材料的合成 取100 mL锥形瓶,分别加入Fe(acac)30.5 g和Gd(acac)30.15 g和EG 50 mL,在磁力搅拌下升温至80 ℃,维持30 min,溶液呈亮橙色透明溶液后,加入1.5 g 的PVP,继续磁力搅拌至PVP完全溶解后,加入5 mL的TEA,继续搅拌10 min。随后将上述反应溶液转入100 mL反应釜,烘箱加热至200 ℃,反应24 h。反应结束后,高速离心反应液20 min(25 000 r/min),收集固体产物,并用去离子水和乙醇洗涤三遍后重新分散在水中,得到FeGd纳米材料。
1.3.2 FeGd纳米材料胶体稳定性的测定 将FeGd纳米材料均匀分散在去离子水,RPMI-1640培养基和10%的胎牛血清溶液中,并在静置不同时间(6、12、24、48 h)后,使用纳米粒度仪测定FeGd纳米材料在不同溶液中的水合粒径变化。
1.3.3 FeGd的驰豫率测定 将FeGd纳米材料均匀分散在去离子水中,配成母液,随后利用1%的琼脂糖高温溶液稀释母液至不同的Gd浓度梯度(0、0.025、0.05、0.1、0.2 mM)和Fe浓度梯度(0、0.023、0.045、0.09、0.18 mM),并封装于200 μL离心管中,冷却至室温,琼脂糖溶液凝固后,利用7.0 T小动物磁共振成像仪测试。T1弛豫时间测定的序列参数为:TR 为6 000 ms,TE为5.6 ms,BW为25 kHz,层厚为0.8 mm,矩阵为128 × 128,平均1次。T2弛豫时间测定的序列参数为:TR=2 500 ms,回波次数为20,回波时间为10~20 ms。随后将驰豫时间的倒数/Gd离子浓度(Fe离子浓度)的线性拟合,计算纵向T1弛豫率(r1)和横向T2弛豫率(r2)。
1.3.4 细胞培养和细胞毒性测定 将C166细胞培养在含10 %胎牛血清(FBS)、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中。培养温度为37 ℃,CO2浓度为5%。随后,将C166细胞接种在96孔板中,并调节其细胞密度为2×105/孔,将不同浓度的FeGd纳米材料分别加入培养基内,继续培养24 h和48 h后,除去培养基,并用 PBS洗涤3次。去除纳米材料后,加入含有MTT的培养基(500 μg/mL),孵育4 h后,加入DMSO溶解蓝色结晶,利用酶标仪测定细胞活性。
1.3.5 溶血性实验 取大鼠血液500 μL,1 000~1 500 r/min,离心15 min后弃去上清。加入1 mL PBS轻轻混匀红细胞,1 000~1 500 r/min,离心5 min,重复3次,最后用1.2 mL PBS混匀红细胞。随后取6个1.5 mL的离心管,每管加入200 μL的红细胞分散液,再分别加入1 mL的PBS、去离子水以及不同浓度的FeGd溶液(15、25、50、100 μg/mL)。以PBS为阴性对照,水为阳性对照。在反应1、3、5 h后离心,拍照记录,并测定上清溶液在570 nm处的吸光度。
2 结果
2.1 FeGd纳米材料的形貌观察 本研究通过透射电子显微镜(TEM)观察发现,制备的FeGd纳米材料具有均一的结构,并且呈现明显的球形结构。本研究在高倍的TEM观察发现,合成的FeGd纳米材料球形结构表面呈现大量的突起,这可能是由于超小磁性氧化铁沉积导致的。此外,本研究测量纳米颗粒的尺寸发现,其尺寸大约在220 nm,这个尺寸可以保证纳米颗粒在体内具有更长的代谢时间,延长其在体内的血液循环时间,可以明显促进其在病灶组织的累积,改善对病灶组织的诊断(图1)。

a. 低倍电子显微镜图片;b. 高倍电子显微镜图片。
2.2 FeGd纳米材料的胶体稳定性 FeGd纳米材料的水合粒径分析结果显示,纳米颗粒的水合粒径主要分布在200~300 nm之间,平均粒径在220 nm左右,这与TEM观察的结果一致。这表明,FeGd纳米材料具有良好的胶体性质(图2a)。本研究进一步观察FeGd纳米材料在不同溶液中的胶体稳定性,结果显示,随着静置时间的增加,FeGd纳米颗粒的水合粒径在三种溶液(去离子水、RPMI-1640培养基、10%的胎牛血清)中没有明显变化(图2b)。这说明,FeGd纳米颗粒在上述三种溶液中不会发生团聚或降解等反应,展现出良好的胶体稳定性。良好的胶体稳定性为FeGd纳米颗粒在体内的安全应用提供了重要的数据支撑。
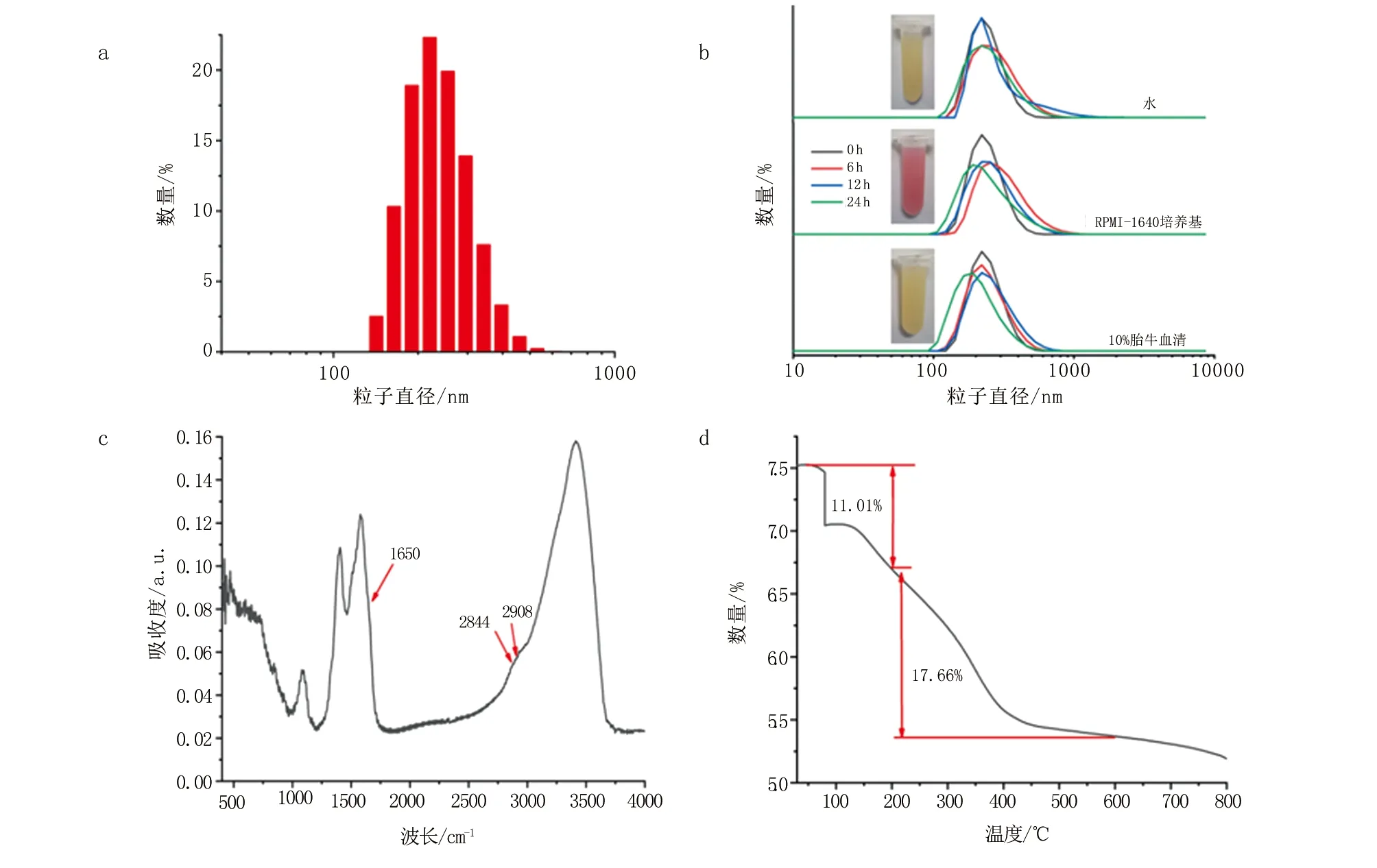
a. FeGd纳米材料的水合粒径分布图;b. FeGd纳米材料在不同溶液中的粒径变化图;c. FeGd纳米材料的红外光谱图;d. FeGd纳米材料热重分析图。
2.3 FeGd纳米材料的组分测定 傅里叶红外光谱图结果显示,FeGd纳米材料在580~650 cm-1展现了一个宽峰,这主要归因于Fe-O和Gd-O键的伸缩振动。这说明,FeGd纳米复合物主要有铁氧化物和钆氧化物组成,在1 020 cm-1出现的峰主要为-C-O键的伸缩振动,在2 844 cm-1和2 908 cm-1处出现C-H伸缩振动峰,以及在1 650 cm-1处出现C=O的吸收峰(图2c)。这些吸收峰的出现说明,FeGd纳米材料中存在大量的PVP聚合物。因此,本研究认为,这些聚合物大量的亲水基团赋予FeGd纳米颗粒良好的胶体稳定性。为了进一步确定FeGd纳米材料中PVP聚合物的含量,本研究通过热重分析测定发现,纳米材料在室温到200 ℃的升温过程中有11.01%的重量损失,这主要归因于吸附水和结合水的蒸发。随后,温度在200~600 ℃之间的重量损失达到17.66%,这主要归因于FeGd纳米颗粒中有机物的脱氢脱氧和燃烧过程造成的重量损失(图2d)。基于以上分析,本研究认为,FeGd纳米材料中PVP聚合物的重量比达到17.66%。
2.4 FeGd纳米材料的表面电位 本研究通过分析zeta电位进一步测定了纳米颗粒的表面电位。在中性条件下,纳米材料展现出较高的正电位,这主要是因为材料表面大量的羰基发生质子化和氧化钆和氧化铁表面氧的质子化导致表面电位为正电荷。较高的表面电位会增加纳米颗粒之间的静电斥力,使纳米颗粒在溶液中具有更稳定的胶体性能。为了确认质子化过程,本研究通过降低溶液pH值,增加溶液质子含量,进一步测定了纳米材料的表面电位。结果显示,随着溶液质子含量的增加,FeGd纳米颗粒表面电位逐渐增加,这进一步验证了上述结论(图3)。

图3 FeGd纳米颗粒在不同pH值条件下的表面电位
2.5 FeGd 纳米材料的T1和T2弛豫率测定 本研究利用7.0 T小动物磁共振成像仪测定FeGd纳米颗粒的T1和T2弛豫率,结果显示,FeGd纳米颗粒的T1弛豫率为6.765 mM-1s-1,T2弛豫率为213.81 mM-1s-1。T1弛豫率和T2弛豫率均高于临床中使用Gd-DTPA和菲立磁磁共振造影剂。这表明,FeGd纳米颗粒具有良好的T1和T2双模态磁共振造影性能。FeGd纳米材料溶液样品的T1加权图像显示,随着溶液浓度的增加,样品的T1磁共振加权图像逐渐变亮,展现出超强的T1造影能力。样品的T2磁共振加权图像逐渐变暗,具有强烈的T2造影能力(图4)。基于以上分析,本研究认为,FeGd纳米材料具有良好的T1-T2双模态磁共振造影性能。

a. FeGd纳米材料的T1弛豫率和T1加权图像;b. FeGd纳米材料的T2弛豫率和T2加权图像。
2.5 FeGd纳米材料的生物安全性评价 生物安全性是评估新型纳米造影剂能否应用于临床的重要考虑因素。本研究使用不同浓度的FeGd纳米材料分别培养正常C166细胞24 h和48 h,测定相应的细胞活性。结果显示,FeGd纳米材料对正常细胞几乎没有损伤,即使增加培养浓度和培养时间,C166细胞仍然保持很好的活性(图5a)。这表明,FeGd纳米材料具有良好的细胞生物相容性。溶血实验也被用来进一步评价FeGd纳米材料的血液生物相容性。结果显示,尽管随着FeGd纳米材料浓度增加和处理时间增加,溶血率逐渐增加,但是溶血率均很低,即使在100 μg/mL的高浓度条件下处理血红细胞24 h,红细胞的溶血率仅有约6%,大多数的红细胞仍然保持完整(图5b)。这表明,FeGd纳米材料几乎不会对红细胞造成损伤,具有良好的血液生物安全性。
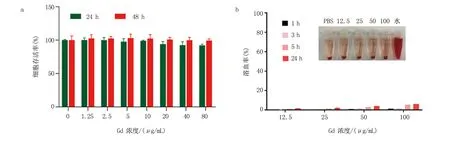
a. 不同浓度FeGd培养正常细胞C166的细胞活性;b. 溶血实验:不同FeGd纳米材料处理血红细胞。
3 讨论
MRI技术已经成为最广泛使用的疾病诊断工具之一。相对于其它影像学诊断技术,MRI具有无电离辐射、无侵入性、软组织高分辨率、可对组织进行3D重构成像等优点[14-15]。磁共振临床诊断常借助造影剂增强正常组织和疾病组织之间的对比度来获取更精准的诊断结果。临床造影剂主要有小分子钆螯合物的T1型造影剂和超小氧化铁纳米晶的T2型造影剂。T1造影剂和T2造影剂在成像过程中均会受到体内一些物质的干扰,导致一些伪影的出现,干扰对疾病的精准诊断造影。因此,迫切需要开发多模态的磁共振造影试剂。单一纳米纯相体系一般仅能够实现单模态的磁共振造影成像。为了实现多模态磁共振造影成像,研究人员常需要将多种化合物整合在一个纳米体系中。如何合理、简单、高效地构建多模态磁共振纳米复合体系尤为关键。目前,一些研究已经报道了一些T1-T2双模态的磁共振造影试剂,构建模式主要有钆螯合物接枝磁性氧化铁纳米颗粒,钆氧化物包裹磁性氧化铁,以及顺磁性金属离子掺杂磁性氧化铁纳米颗粒[1,16-18]。这些双模态磁共振造影剂展现出良好的T1和T2弛豫率,并在活体双模态成像中展现出良好的造影效果。然而,以上的双模态磁共振造影剂构建过程复杂,产率较低,花费较高,制约了规模化的制备双模态磁共振造影剂。
本研究利用溶剂热一锅法制备出FeGd纳米复合材料,其尺寸均一,化学性质稳定,溶液胶体性能极好,具有良好的活体应用前景。同时,该制备方法解决了传统双模态磁共振造影剂制备繁琐、产率较低等问题,具有更好的应用潜力。磁共振成像结果显示,FeGd纳米材料具有优异的T1和T2弛豫率,在体外具有强烈水质子信号衰减能力,展现出明显的T1和T2造影性能。在细胞水平上验证的生物安全性结果展现出FeGd纳米造影剂具有良好的细胞生物相容性和血液生物安全性。因此,本研究制备的FeGd纳米复合材料作为T1-T2双模态磁共振造影剂具有潜在的临床应用前景。

