青年型非小细胞肺癌的预后影响因素及列线图构建
梁东敏 洪嘉源 谢 宁 李艳梅 谢书阳
1 滨州医学院基础医学院山东省高校肿瘤分子生物学重点实验室 山东 烟台 264003;2 滨州医学院附属烟台山医院 山东 烟台 264003
肺癌是一种常见的恶性肿瘤,严重危害人类健康和生命。据美国癌症学会的最新研究显示2021年肺癌发病率和死亡率分别居美国肿瘤发病率第二位和肿瘤死亡率第一位,5年总生存率(overall survival,OS)约为21%[1]。流行病学研究显示肺癌主要发生于中老年人群,年轻肺癌患者虽占比低但已逐渐成为一个不可忽视的群体,其对社会发展和经济影响很大[2],且年轻肺癌患者表现出独特的临床病理特征。青年型肺癌为年龄≤40岁且≥18岁的肺癌患者[3],目前有关青年型肺癌的报道较少,非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要病理类型,尚无青年型肺癌中NSCLC预后影响因素的统一认识。本研究从美国国立癌症研究所“监测、流行病学和结果” (SEER)数据库筛选青年型NSCLC患者,构建可视化预后列线图,研究其预后影响因素,以期改善青年型NSCLC患者的预后,为个体化预后干预提供科学依据。
1 资料与方法
1.1 数据来源 本研究数据来源于SEER数据库。从数据库筛选青年型NSCLC患者,收集患者人口学资料、肿瘤病理特征、治疗信息、家庭情况及随访资料等研究变量。
1.2 纳入和排除标准 纳入标准:病理诊断为NSCLC;年龄为18~40岁;诊断时间为2010—2015年。排除标准:临床病理信息不完整;多原发癌患者;随访资料不全。
1.3 统计学方法 采用R4.1.0软件及相应R包(caret,foreign,survival,tableone,rms,nomogramEx,ggplot2,timeROC,ggDCA)。按照8∶2的比例随机划分训练集和验证集进行均衡性检验,生存曲线的差异采用时序检验(log-rank rest),逐步回归选择变量,多因素Cox比例风险模型分析影响因素,将研究结果用森林图可视化,并构建列线图模型,采用受试者工作特征曲线(receiver operating characteristic,ROC)下面积(AUC)评估列线图模型的区分度,校准曲线评估模型校准度,决策曲线分析(DCA)评估其临床应用价值。
2 结果
2.1 青年型NSCLC患者的基本情况 本研究从SEER数据库中共纳入887例青年型NSCLC患者,按8∶2比例随机分为训练集(709例)和验证集(178例)两组。两组患者在种族、性别、肿瘤部位、双侧性、美国癌症联合委员会(American Joint Committe on Cancer, AJCC)分期、手术、淋巴结清扫、放疗、化疗、骨、脑、肝、肺转移、肿瘤大小、收入、保险以及婚姻情况方面的差异均无统计学意义,见图1、表1。对训练集和验证集两组进行生存曲线分析(图2),经log-rank检验差异无统计学意义(P=0.86)。
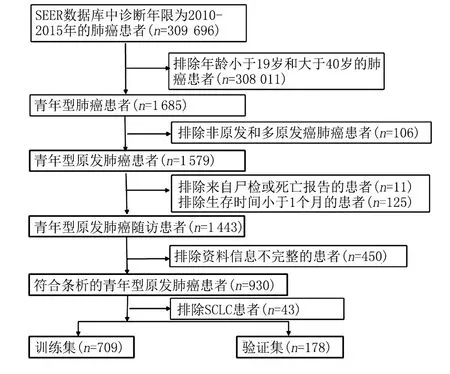
图1 青年型NSCLC患者筛选流程图
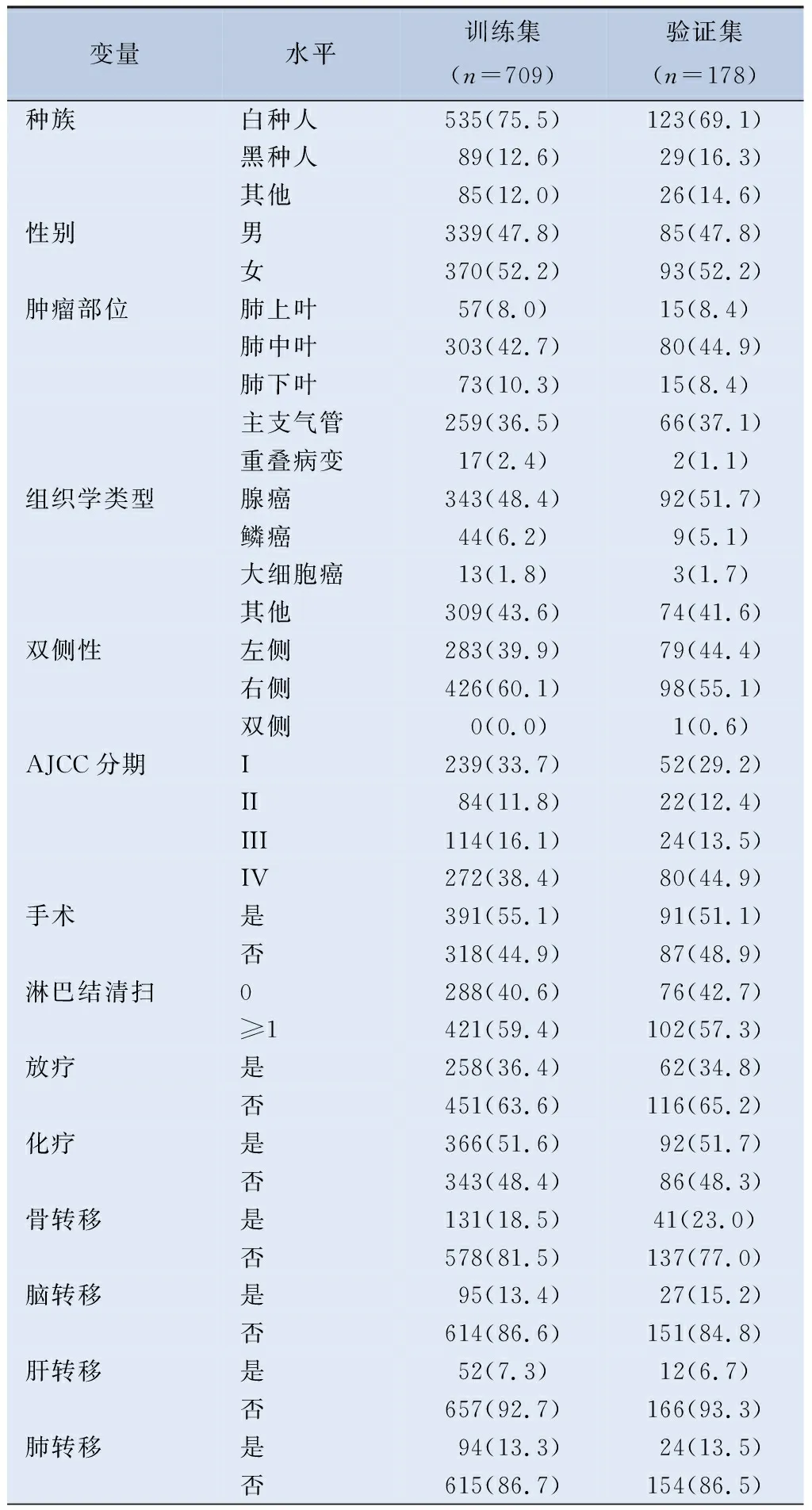
表1 青年型NSCLC患者训练集和验证集两组特征比较/[例(%)]
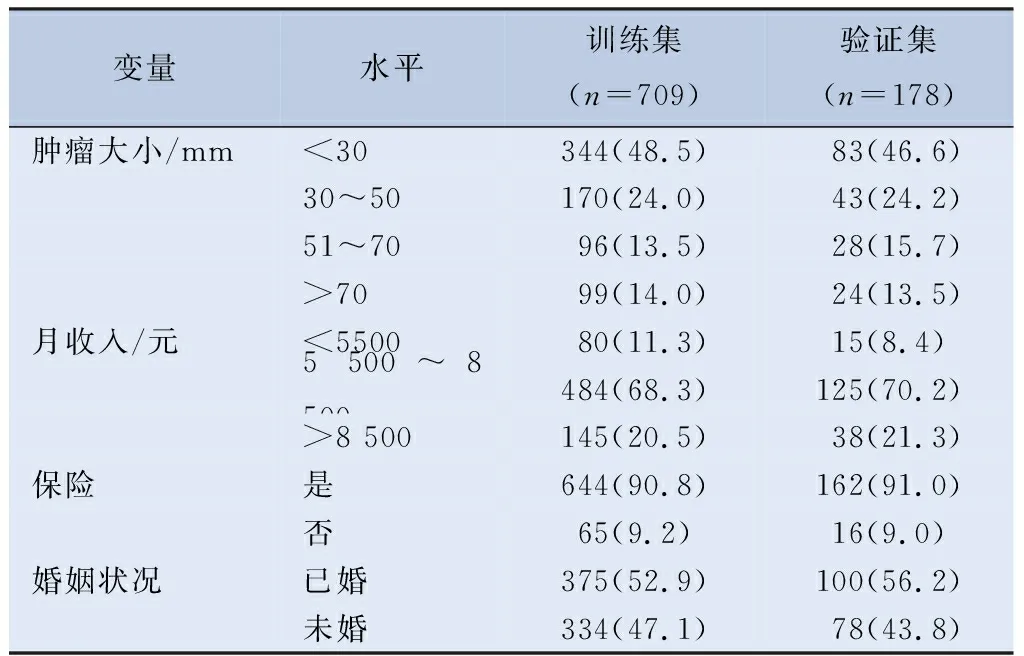
表1 (续)
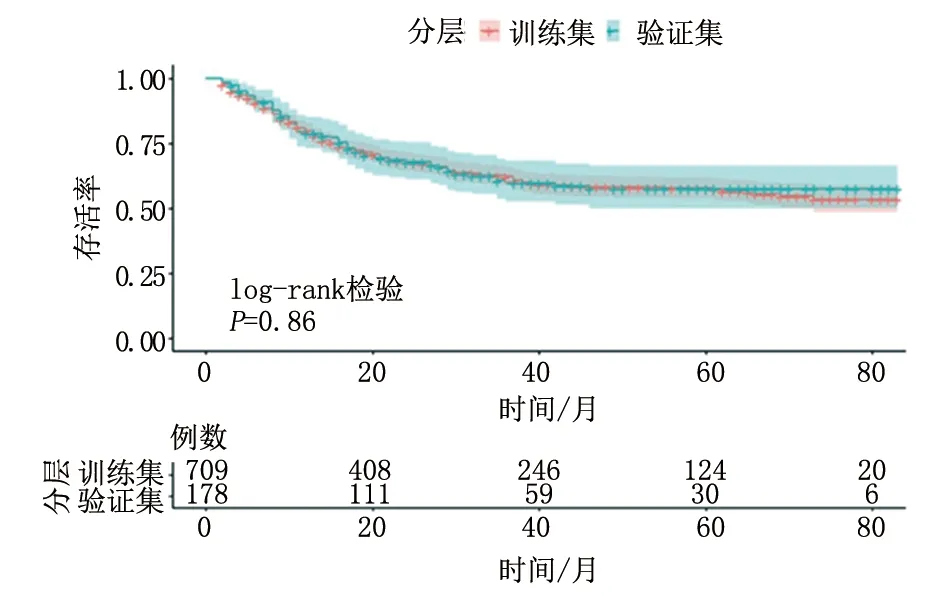
图2 青年型NSCLC患者训练集和验证集生存曲线
2.2 青年型NSCLC患者预后影响因素分析 多因素Cox比例风险模型分析结果显示,病理类型、AJCC分期、是否手术、是否放疗、肿瘤大小、骨转移以及婚姻状态是青年型NSCLC患者预后的影响因素(P<0.05)。与肺腺癌相比,肺鳞癌的风险比HR(95%CI)为3.02(1.93,4.73),肺大细胞癌HR(95%CI)为2.19(1.13,4.25);与AJCC分期I期相比,II期HR(95%CI)为3.42(1.32,8.84),III期HR(95%CI)为6.14(2.54,14.88),IV期HR(95%CI)为13.86(5.75,33.45);与手术治疗相比,未手术治疗HR(95%CI)为3.31(2.16,5.09);与放疗相比,未放疗HR(95%CI)为0.70(0.53,0.93);与肿瘤大小<30 mm相比,30~50 mm其HR(95%CI)为1.28(0.93,1.77),51~70 mm 其HR(95%CI)为1.31(0.92,1.86),70 mm 以上HR(95%CI)为1.68(1.18,2.39);与有骨转移相比,无骨转移HR(95%CI)为0.62(0.46,0.82);与已婚相比,非已婚HR(95%CI)为1.41(1.10,1.81),Cox比例风险模型结果用森林图可视化,结果见图3。

图3 青年型NSCLC患者预后COX模型多因素分析结果的可视化森林图
2.3 青年型NSCLC患者预后列线图构建及验证 根据上述因素构建青年型NSCLC患者预后列线图,AJCC分期对患者预后影响最大,其次是病理类型和手术治疗。根据每一特征向上投射至标尺得出分值,将各项分值相加得出总分值,分值越高,说明预后越差。这一模型可用于预测患者的3年以及5年总OS。见图4。

图4 青年型NSCLC患者3年和5年OS列线图
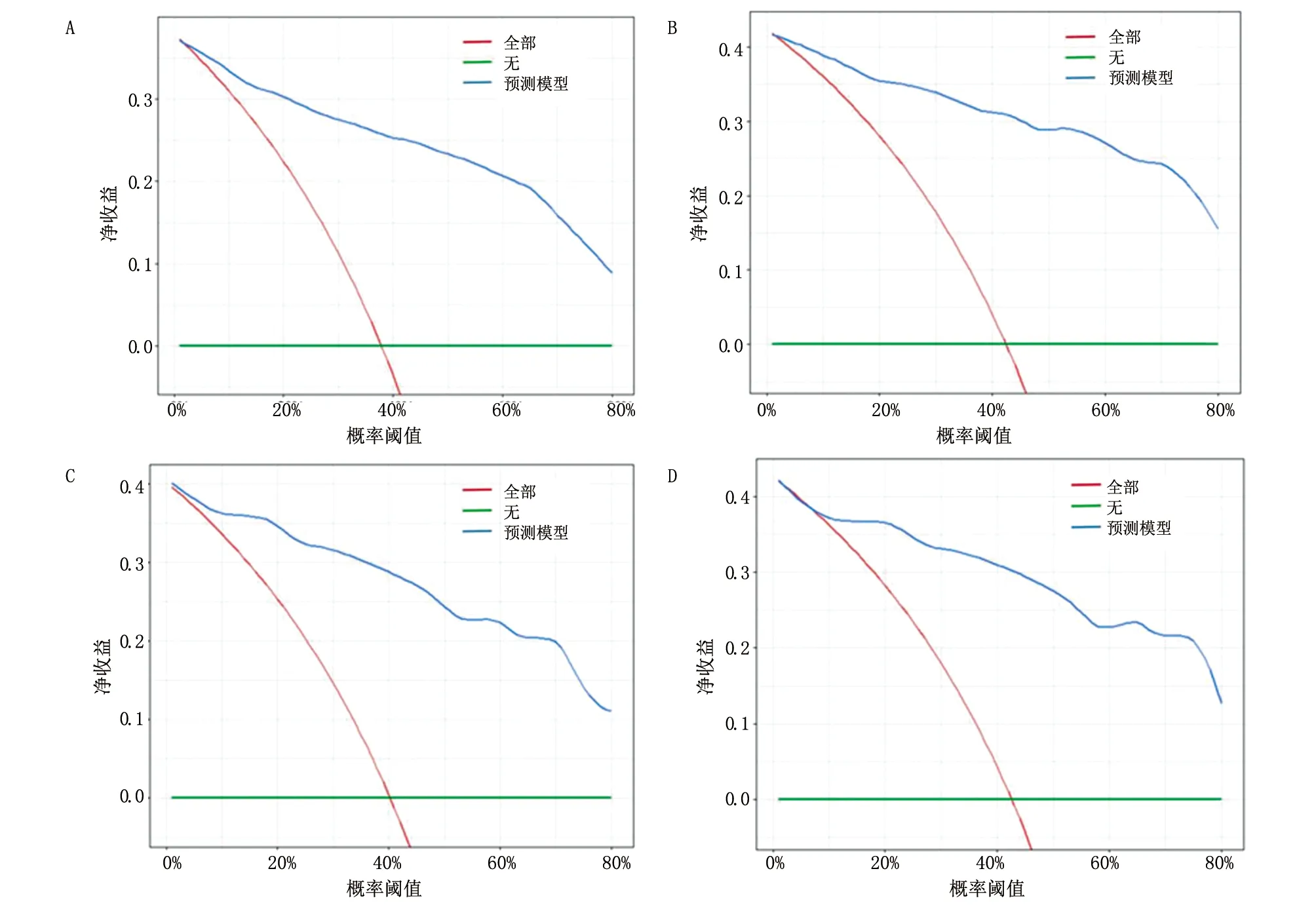
AUC可用于评价模型的区分度,越接近1表示模型的区分度越好,训练集3年和5年OS的AUC分别为0.911和0.926,验证集分别为0.882和0.856,说明青年型NSCLC患者列线图模型区分度较高(图5)。接下来在训练集和验证集中分别绘制3年和5年OS的校准图,结果表明模型预测的OS(3年和5年)与实际OS(3年和5年)均具有较高的一致性,模型校准度较好(图6)。此外对列线图模型的临床获益进行分析,针对训练集和验证集的3年和5年OS分别绘制DCA曲线,结果表明训练集和验证集的临床净获益均较高,提示该列线图模型具有较好的临床应用价值(图7)。

A.训练集;B.验证集。

A.训练集3年OS;B.训练集5年OS;C.验证集3年OS;D.验证集5年OS。
A.训练集3年OS;B.训练集5年OS;C.验证集3年OS;D.验证集5年OS。
3 讨论
目前对青少年NSCLC患者的预后报道很少,为改善青年型NSCLC患者的预后,本研究构建可视化预后列线图,较为全面地分析了影响其预后因素,发现AJCC、手术、病理类型、肿瘤大小、骨转移、放疗等是青年型NSCLC患者预后的影响因素。构建的列线图模型区分度较高,模型预测的OS与实际OS均具有较高的一致性,训练集和验证集的临床净获益均较高,为个体化预后干预提供科学依据。
根据多因素Cox比例风险模型分析的结果发现,NSCLC的不同病理类型如肺鳞癌、肺大细胞癌等都能够影响青年NSCLC的预后,而肺鳞癌及其他病理分型的肺癌患者相对于肺腺癌患者的死亡风险较高。肺癌患者基因组中存在许多基因异常改变,在青年型肺癌患者中,基因突变率较高[4],所以在患者的诊断治疗及预后存在一定难度。肺癌的临床分期是相对重要的生存预测指标[5],青年型NSCLC患者发病时临床分期较晚,大多数初诊时即可达到Ⅲ-Ⅳ期[3-4]。
对于Ⅰ期NSCLC患者来说,手术治疗仍是最佳治疗方案[6],不适合手术治疗的患者,通常采取放射治疗。实际上,每一种治疗方式都会产生副作用,对于Ⅲ期NSCLC患者来说,有良好的完全切除机会时,手术治疗是最佳选择。本研究用模型分析时又发现,与经过手术治疗的NSCLC青年型患者相比,未经手术治疗的风险比较高。
近年来,放射治疗技术已经得到长足进步,该技术能直接靶向肿瘤并减少对周围正常组织的辐射,在一定程度上提高了患者的治疗率[7],但是治疗期间肿瘤位置的不确定性以及肿瘤产生的耐受性仍然是不利因素。有文献报道[8-9],NSCLC患者在经过放射治疗后,近期治疗效果不错,但整体生存率仍有待证实。本研究结果提示青年型肺癌者未放疗患者风险低于放疗患者,可能原因是青年型肺癌患者III、IV比例大,影响了患者的预后。
肿瘤体积大小是影响患者预后的关键因素之一,在大多数情况下,肿瘤体积越大,预后越差[10-11]。本研究发现肿瘤直径小于30 mm的肺癌患者要比肿瘤直径大于30 mm的患者生存期较长,而肿瘤直径大于70 mm的肺癌患者预后最差。大约90%的癌症患者的死亡都是由原发性肿瘤的迁移与扩散引起,约有20%~40%的NSCLC患者会发生脑转移,预后很差[12]。青年型NSCLC患者易发生转移[4],集中表现为淋巴结转移、脑转移、骨转移等[13-14],骨转移的患者1年生存率低于脑转移、肺转移、淋巴结转移患者。因此,骨转移的早期诊断和预防尤为重要,在一定程度上可以提高NSCLC患者的生存率[15]。
婚姻对于早期诊断各种类型的癌症以及预后都有一定的积极作用[16],Chen等[17]也指出,已婚人士在各种疾病的预期寿命上较长,且生活质量水平相对较高,NSCLC已婚患者的生存率以及预后相对于未婚患者表现出更好的趋势,这与本研究的数据分析结果一致。
总之,本研究利用大数据库来构建了列线图模型,根据模型能估算青年型NSCLC患者3年或5年的生存率,为临床医生提供了合适的治疗策略以及预后评估手段。由于SEER数据库的限制,本研究不能获取更为全面的信息,如缺乏患者基因相关数据资料,也缺少我国青年型NSCLC患者临床信息,在后期研究中需要进一步补充完善。

