Fscn2基因过表达对顺铂诱导的耳蜗细胞凋亡的抑制作用
王 岩 商文静 韩锋产
滨州医学院基础医学院生物化学与分子生物学教研室,山东省医药卫生耳科遗传病重点实验室 山东 烟台 264003
Fscn2是Fascin家族的一员,Fscn2可与F-actin交联成刚性平行的纤毛束[1]。Perrin等[2]研究DBA/2J增龄性聋小鼠发现,Fscn2与β-actin相互作用维持了小鼠的静纤毛长度和听觉功能。Yang等[3]研究发现,DBA/2J小鼠耳蜗细胞凋亡导致其早期听力减退,通过抗凋亡治疗可减轻耳蜗细胞的凋亡。敲低Fscn2基因增加了肾小管上皮细胞对顺铂诱导细胞凋亡的易感性。Fscn2在C2细胞【敲低α(E-Catenin的NRK-52E细胞)】中的过表达降低C2细胞对顺铂诱导细胞凋亡的敏感性[4]。这些研究表明,Fscn2不仅是一种结构蛋白,还具有调节细胞命运的功能。
顺铂是一种高效的抗肿瘤药物,广泛应用于各种癌症的治疗,包括头颈部癌、胃癌等[5]。但在接受顺铂化疗后,约40%~80%的成人和至少50%的儿童出现永久性的听力损失[6]。顺铂的耳毒性在临床上主要表现为双侧、渐近性和不可逆的感音性神经听力损失[7]。本研究旨在探讨Fscn2基因的过表达对顺铂诱导耳蜗细胞凋亡的作用。
1 材料与方法
1.1 材料 HEI-OC1(house ear institute-organ of corti 1)耳蜗细胞来自豪斯耳科学研究所(House Ear Institute)。血清购自Gibco公司(货号为16140-071);高糖购自Hyclone公司(货号为SH30023.01);嘌呤霉素购自Meilunbio公司(货号为MA0318);Rabbit Anti Bcl-2 antibody购自Proteintech公司(货号为26593-1-AP);FITC-Annexin V试剂盒购自BD公司(货号为556547);Anti C-caspase3 antibody购自CST公司(货号为9505)。
1.2 实验方法
1.2.1 慢病毒感染耳蜗细胞 构建表达Fscn2病毒载体(主要原件见表1)包装慢病毒颗粒。培养HEI-OC1细胞(33℃,10% CO2),当贴壁率达到30%~40%时可进行慢病毒感染。将细胞培养液、慢病毒、慢病毒感染增强液按照989∶10∶1的比例混匀,配制成慢病毒感染培养液。以换液形式加入六孔板,培养箱培养24 h后取出,弃除慢病毒感染培养液,1×PBS清洗2次,加入细胞培养液(2 mL/孔)。培养48 h后,加入含6 μg/mL嘌呤霉素的培养液筛选得到Fscn2稳定表达株。

表1 Fscn2病毒载体结构
1.2.2 CCK-8法检测细胞增殖率 构建外源性Fscn2过表达载体,包装病毒颗粒,感染耳蜗细胞,获得Fscn2过表达的耳蜗细胞模型(以下简称为Fscn2-o/e细胞)。同样方法获得对照组细胞,即E.V.细胞。收集E.V.细胞和Fscn2-o/e细胞并计数,按5 000细胞/孔加入96孔板中,补培养液至100 μL,混匀,放入培养箱中培养24 h后,吸掉96孔板中的培养液并用PBS洗2次。以换液的方式加入含有顺铂的培养液,顺铂浓度为30 μM。培养24 h后,配置含10%WST-8【化学名为2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐】的培养液,以换液的形式加入96孔板(100 μL/孔)。设置空白孔,只含10% WST-8的培养基,放入培养箱2 h后,96孔板放入酶标仪中,测定顺铂干预的E.V.细胞和Fscn2-o/e细胞在450 nm处吸光度并计算细胞存活率。细胞存活率=顺铂干预细胞的OD值/顺铂未干预的细胞的OD值。
1.2.3 流式细胞术检测细胞凋亡率 进行E.V.细胞和Fscn2-o/e细胞培养,收集细胞,离心去上清,加入1 mL培养液重悬细胞。六孔板每孔加300 μL细胞悬液,再加700 μL培养液混匀细胞,放入培养箱。待E.V.细胞和Fscn2-o/e细胞长满,以换液的方式加入含有顺铂的培养液,顺铂浓度为30 μM。培养24 h后,收集细胞(包括悬液中的细胞),按 1∶9 稀释结合缓冲液得到1×结合缓冲液。用1×结合缓冲液悬浮E.V.细胞和Fscn2-o/e细胞,调节其浓度约为1×106/mL。分别取100 μL的E.V.细胞和Fscn2-o/e细胞悬液于2 mL EP管中,加入5 μL FITC Annexin V和5 μL PI混匀,室温避光孵育15 min。加入400 μL PBS,转移至5 μL 流式管中立刻放入流式细胞仪(Bekmancoulter EPICS-XL,美国)进行流式细胞检测。
1.2.4 Western Blot 将E.V.细胞和Fscn2-o/e细胞接种到6孔板。待E.V.细胞和Fscn2-o/e细胞长满后(约24 h),以换液的方式加入含有30 μM顺铂的培养液。培养24 h后,收集E.V.细胞和Fscn2-o/e细胞加入裂解液(PMSF∶RIPA=1∶100)80 μL,静置10 min,震荡15 s。在4 ℃下,12 000 r/min离心15 min,收集上清。BCA法测定蛋白浓度,计算上样量。配制10%的SDS-PAGE凝胶,分别将顺铂干预的E.V.细胞蛋白样品和Fscn2-o/e细胞蛋白样品加入梳孔中,电压设置为110 V进行电泳120 min。将蛋白样品转到PVDF膜上,电流为200 mA,时间为110 min。将PVDF膜放入封闭液中,封闭2 h。一抗(抗Fscn2、Bcl-2、Cleaved caspase-3的抗体)用TBST稀释。将一抗稀释液加入密封袋中,放入PVDF膜,封口,4℃摇床上孵育过夜。第二天将膜取出,用TBST快速洗10 min,重复3次,用TBST将按照1∶5 000的比例稀释二抗,室温摇床慢速孵育2 h,用ECL化学发光检测系统检测结果。
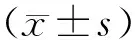
2 结果
2.1Fscn2过表达耳蜗细胞模型的鉴定 Western blot对构建的Fscn2过表达耳蜗细胞进行验证,结果显示,Fscn2-o/e细胞的Fscn2蛋白的表达量高于E.V.细胞(图1)。
两组比较,**P<0.01。
2.2Fscn2过表达耳蜗细胞增殖能力的检测 构建细胞模型后,用顺铂进行干预。结果显示,在30 μM的顺铂干预24 h之后,与E.V.细胞比较,Fscn2-o/e细胞的增殖能力显著增强,P<0.01(图2)。

两组比较,**P<0.01。
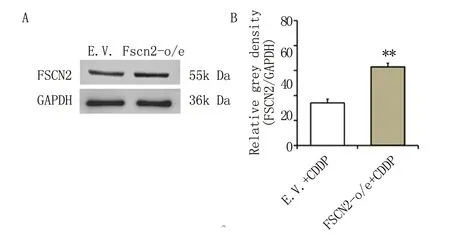
2.3Fscn2过表达耳蜗细胞凋亡率的检测 用30 μM顺铂处理Fscn2-o/e细胞与E.V.细胞24 h,再用流式细胞术检测细胞凋亡。结果显示,在顺铂干预下,E.V.细胞的Q2(早中期凋亡细胞)区域细胞占比为12.8 %,Q4(晚期凋亡细胞)区域细胞占比为12 %,而Fscn2-o/e细胞Q2区域细胞占比为7.4%,Q4区域细胞占比为9.3 %(图3A)。统计分析显示,在顺铂干预后,E.V.细胞与Fscn2-o/e细胞的凋亡率比较,P<0.01(图3B)。本研究提示,Fscn2的过表达能显著抑制顺铂所致的耳蜗细胞凋亡。
A为流式细胞术检测细胞凋亡率;
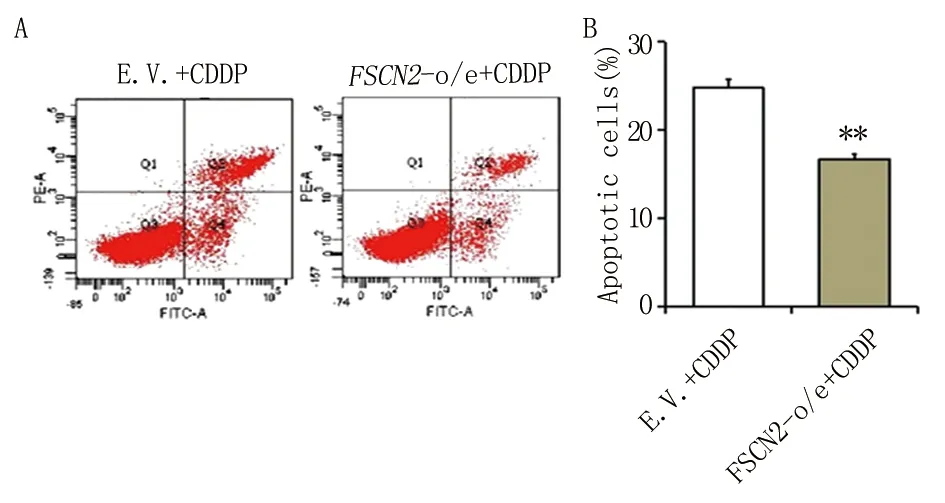
2.4 Western blot检测Fscn2过表达耳蜗细胞凋亡相关蛋白的表达 为进一步研究在顺铂干预下Fscn2过表达耳蜗细胞凋亡率降低的机制,本研究通过Western blot对凋亡相关蛋白进行检测。结果显示,30 μM顺铂干预24 h后,与E.V.细胞相比,Fscn2-o/e细胞抗凋亡相关蛋白Bcl-2的表达较高,而凋亡相关蛋白Cleaved caspase3水平较低(图4)。本研究提示,Fscn2-o/e细胞可能通过调节Bcl-2和Cleaved-caspase3的水平以对抗顺铂诱导的细胞凋亡。
两组比较,*P<0.05。
3 讨论
顺铂诱导耳毒性的详细机制尚不完全清楚,目前认为包括DNA损伤、活性氧(reactive oxygen species,ROS)过量生成和细胞凋亡在内的多种机制与此有关[8-9]。顺铂进入细胞后,造成DNA损伤[10],引起毛细血管扩张性共济失调症突变(ataxia-telangiectasia mutated,ATM)。ATM可以激活肿瘤抑制基因p53,增加促凋亡相关蛋白Bax的表达,后者增加线粒体膜的通透性,使细胞色素C从线粒体释放,导致caspase 3的活化[11]。用30 μM的顺铂干预24 h后,HEI-OC1细胞的存活率下降约50%,Nrf2(nuclear factor erythroid 2-related factor 2)的表达降低。用Nrf2激活剂—叔丁基氢醌(tertiary butylhydroquinone,TBHQ)对细胞进行处理,细胞中非线粒体ROS的积累减少,抑制了细胞的凋亡[12]。此外,α-硫辛酸(alpha lipoic acid,ALA)、海藻糖、小檗碱或黄连素等小分子药物可抑制顺铂诱导的耳蜗细胞凋亡[13-15]。
顺铂可通过诱导细胞凋亡通路发挥其耳毒性[16]。蛋白质精氨酸甲基转移酶(protein arginine methyltransferase,PRMT3)和大麻素系统的相互作用与顺铂诱导的耳毒性有关,PRMT3和大麻素系统的相关蛋白脂肪酰胺水解酶(fatty acid amide hydrolase,FAAH1)的过表达调控顺铂诱导的HEI-OC1细胞凋亡相关蛋白的水平(如Cleaved-caspase3的表达升高)[17]。顺铂还可通过使脂质过氧化物、铁元素的堆积以及线粒体膜电位(mitochondrial membrane potential,MMP)的下降以诱导HEI-OC1细胞的铁死亡,最后引起细胞凋亡[18]。铁死亡的抑制剂ferrostatin-1能够改善顺铂诱导的HEI-OC1细胞凋亡以及耳蜗外植体中线粒体的功能[19]。在顺铂干预下,注射了AAV2-Pou4f3 shRNA的小鼠耳蜗中凋亡相关蛋白Bax水平升高,而抗凋亡相关蛋白Bcl-2水平降低。这提示,在顺铂处理后,Pou4f3的低表达可能增加耳蜗细胞的凋亡[20]。使用氯喹阻断自噬可以改善顺铂诱导的HEI-OC1细胞的铁死亡,这表明,通过铁死亡诱导的细胞死亡与细胞的过度自噬有关[21]。Fscn2还能改善顺铂所致的肾小管上皮细胞的凋亡[22]。
综上所述,为进一步研究Fscn2的过表达是否抑制顺铂诱导的耳蜗细胞凋亡,本研究构建了Fscn2过表达的耳蜗细胞模型。本研究发现,在顺铂的干预下,Fscn2-o/e细胞的增殖能力较高,而细胞凋亡的水平较低,凋亡相关蛋白表达水平较低。这表明,Fscn2基因的过表达抑制了顺铂诱导的耳蜗细胞凋亡,Fscn2可能是对抗顺铂诱导耳蜗细胞凋亡的重要因素之一,但详细机制有待进一步研究。本研究利用Fscn2基因过表达的细胞模型探讨Fscn2对顺铂诱导耳蜗细胞凋亡的影响,为揭示Fscn2基因的功能提供实验依据。

