细胞周期蛋白依赖性激酶抑制剂2B反义RNA1靶向微小RNA-339-5p对乳腺癌细胞增殖、迁移、侵袭的影响
陈倩倩,张英丽,李阳,唐音
作者单位:南阳市中心医院肿瘤科,河南 南阳 473000
乳腺癌的发生、发展与体内基因的异常表达密切相关,针对这些基因的分子靶向治疗已成为乳腺癌治疗研究的热点[1-2]。研究发现长链非编码RNA(ln‑cRNA)虽不编码蛋白质,但其在生物体内起重要调节作用,与肿瘤的发生发展密切相关[3]。细胞周期蛋白依赖性激酶抑制剂2B 反义RNA1(CDKN2B-AS1)作为一种lncRNA,研究发现CDKN2B-AS表达水平在特发性肺纤维化病人外周血中显著降低,且可通过调节蛋白p53信号通路预测肺癌[4]。研究报道喉鳞状细胞癌组织中CDKN2B-AS高表达,与淋巴结转移和晚期临床阶段密切相关,抑制CDKN2B-AS1可抑制喉鳞状细胞癌细胞增殖、迁移和侵袭,诱导细胞凋亡[5]。且发现CDKN2B-AS1 在乳腺癌组织中显著过表达[6]。然而CDKN2B-AS1 对乳腺癌细胞机制研究尚未可知。研究发现肿瘤的发生发展与miRNA的异常表达也密切关联,为了更好地理解乳腺癌发生发展的分子机制,进一步研究miRNA 在乳腺癌中的作用功能十分重要[7]。研究报道微小RNA-339-5p(miR-339-5p)可降低小鼠体内乳腺癌细胞的生长繁殖能力,有望成为乳腺癌治疗的潜在新靶点[8]。miR-339-5p通过靶向鼠双微体基因(MDM2)调节乳腺癌MCF-7细胞p53肿瘤抑制通路[9]。因此,本研究主要观察研究CDKN2BAS1可能通过靶向miR-339-5p有关对乳腺癌细胞增殖、迁移、侵袭的影响。
1 资料与方法
1.1 一般资料收集南阳市中心医院2017 年1 月2019 年1 月收治的37 例乳腺癌病人手术切除的保存于保存超低温冰箱内的癌组织及癌旁组织(癌组织边缘2~5 cm),病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
乳腺癌细胞MDA-MB-453 由上海沪震提供;胎牛血清、RPMI-1640 培养基由上海联硕生物提供;MTT试剂盒、BCA试剂盒、蛋白裂解液由碧云天生物提供;增殖标记蛋白细胞增殖核抗原-67(Ki67)、细胞周期依赖性蛋白激酶抑制因子1A(P21)、上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、甘油醛-3-磷酸脱氢酶(GAPDH)单抗、羊抗兔免疫球蛋白(IgG)均由武汉维诺赛生物提供;荧光定量试剂盒、Trizol试剂、反转录试剂盒均由美国Progema公司提供;Transwell小室、Matrigel胶均由美国BD公司提供;双荧光素酶报告基因检测试剂盒由北京Solarbio公司提供;ELISA试剂盒由上海继锦公司提供。二氧化碳孵育箱、Thermo FC酶标仪由美国Thermo公司提供;荧光显微镜由日本Olympus公司提供;FACSCan‑to Ⅱ流式细胞仪由美国Bio-Rad公司提供。
1.2 细胞培养与分组10%胎牛血清的RPMI-1640 培养液培养乳腺癌细胞MDA-MB-453,在恒温培养箱内培养,取对数期MDA-MB-453 细胞,将CD‑KN2B-AS1 小分子干扰RNA(si-CDKN2B-AS1)、CD‑KN2B-AS1 阴性对照(si-NC)分别转染至MDA-MB-453 细胞,记为si-CDKN2B-AS1 组及si-NC 组;另将si-CDKN2B-AS1 分别与miR-339-5p 阴性对照(antimiR-NC)和miR-339-5p 特异性寡核苷酸抑制剂(an‑ti-miR-339-5p)共同转染至MDA-MB-453 细胞,记为si-CDKN2B-AS1+anti-miR-NC 组及si-CDKN2B-AS1+anti-miR-339-5p组。
1.3 RT-qPCR 法检 测CDKN2B-AS1 及miR-339-5p 的表达水平各组细胞均进行24 h 培养,常规提取总RNA,并逆转录为cDNA,反应条件为16 ℃、30 min,42 ℃、30 min,85 ℃、5 min,4 ℃、5 min;然后按照荧光定量试剂盒使用说明进行PCR。2-ΔΔCt法计算相对表达量。
1.4 流式细胞仪检测细胞周期各组细胞均进行24 h 培养,在制备的单细胞悬液中加70%乙醇3 mL固定,PBS 洗涤,加RNase A 于37 ℃水浴30 min,加碘化丙啶(PI)避光30 min。应用流式细胞仪及相关软件检测并分析细胞周期。
1.5 MTT 检测细胞存活率各组细胞均进行24 h培养,每孔加MTT 溶液20µL,孵育4 h时弃除上清,每孔加150µL 二甲基亚砜(DMSO),应用酶标仪对490 nm处检测吸光度(OD)值进行测定,并计算细胞存活率(%)。
1.6 Western blotting 法检测Ki67、P21、E-cad⁃herin、N-cadherin 蛋白表达常规加入RIPA 细胞裂解液对细胞蛋白进行提取,BCA 蛋白试剂盒对蛋白含量进行检测。取蛋白溶液50µg 进行蛋白变性后,进行SDS-PAGE,将分离的蛋白凝胶转移至PVDF膜,常规室温封闭90 min,分别加相应的一抗,4 ℃进行24 h 孵育。TBST 洗膜。再加入二抗,室温下孵育2 h,TBST 洗膜。加入ELC,暗室显影、拍照,用Quantity One 凝胶分析软件处理,对各蛋白条带灰度值进行分析,并计算各蛋白相对表达水平。
1.7 Transwell检测细胞迁移和侵袭收集各组细胞进行无血清培养,取200µL 在Transwell 小室上层接种,并进行24 h培养,吸去培养液并后棉签去除上层细胞,用多聚甲醛进行30 min的固定,然后用结晶紫染色10 min,显镜拍照并记录迁移的细胞数量。细胞侵袭实验:将100µL基质胶Matrigel加于Transwell小室上层,待凝固后接种细胞,之后操作与细胞迁移相同。
1.8 荧光素酶报告实验检测CDKN2B-AS1 与miR-339-5p 靶向调控Starbase 数据库证实CD‑KN2B-AS1 与miR-339-5p 有结合位点。构建野生型及突变型基因靶点CDKN2B-AS1 的荧光素酶表达载体,即WT-CDKN2B-AS1及MUT-CDKN2B-AS1,并将其分别与miR-NC 及miR-339-5p 共同转染至MDA-MB-453 细胞,最后严格按说明书完成荧光素酶活性的检测。
1.9 统计学方法应用SPSS 20.0 统计软件对相关数据进行分析,计量资料均符合正态分布,用xˉ±s表示,两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 在乳腺癌组织中CDKN2B-AS1 的表达乳腺癌组织中CDKN2B-AS1 表达水平为2.23±0.08,显著高于癌旁组织的1.00±0.06,差异有统计学意义(t=74.82,P<0.001)。
2.2 抑制CDKN2B-AS1 对MDA-MB-453 增殖的影响si-CDKN2B-AS1 组MDA-MB-453 细胞中G0期细胞比例、P21表达水平高于si-NC组,S期细胞比例、细胞存活率及Ki67 表达水平低于si-NC 组(P<0.05),见图1,表1。
表1 抑制细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(CDKN2B-AS1)对MDA-MB-453细胞增殖的影响/±s

表1 抑制细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(CDKN2B-AS1)对MDA-MB-453细胞增殖的影响/±s
注:si-NC 为CDKN2B-AS1 阴性对照,si-CDKN2B-AS1 为CDKN2B-AS1 小分子干扰RNA,Ki67 为增殖标记蛋白细胞增殖核抗原-67,P21 为细胞周期依赖性蛋白激酶抑制因子1A。
?

图1 Ki67、P21蛋白的表达
2.3 抑制CDKN2B-AS1 对MDA-MB-453 迁移、侵袭的影响与si-NC组相比,si-CDKN2B-AS1组MDAMB-453细胞中CDKN2B-AS1表达水平、细胞迁移、侵袭数及N-cadherin表达水平显著降低,E-cadherin表达水平升高(P<0.05),见图2,表2。
表2 抑制细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(CDKN2B-AS1)对MDA-MB-453细胞迁移、侵袭的影响/±s
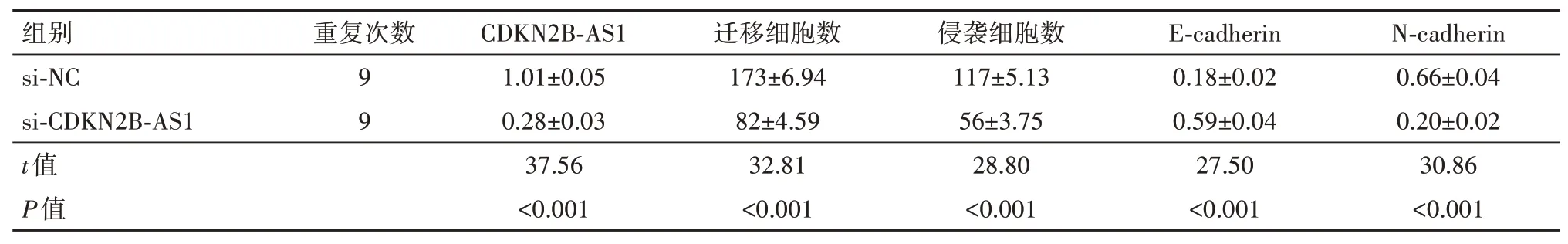
表2 抑制细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(CDKN2B-AS1)对MDA-MB-453细胞迁移、侵袭的影响/±s
注:si-NC 为CDKN2B-AS1 阴性对照,si-CDKN2B-AS1 为CDKN2B-AS1 小分子干扰RNA,N-cadherin 为神经型钙黏蛋白,E-cadherin 为上皮型钙黏蛋白。
?

图2 抑制CDKN2B-AS1对E-cadherin、N-cadherin表达的影响
2.4 CDKN2B-AS1靶向miR-339-5p数据库预测显示CDKN2B-AS1与miR-339-5p存在结合位点。与miR-NC 组0.99±0.05 相 比,miR-339-5p 组WT-CD‑KN2B-AS1细胞荧光素酶活性0.20±0.03显著降低(t=40.65,P<0.001);而MUT-CDKN2B-AS1的细胞荧光素酶活性差异无统计学意义(t=0.38,P=0.706)。与si-NC组的0.95±0.05相比,si-CDKN2B-AS1组miR-339-5p表达水平2.83±0.07显著升高(t=65.56,<0.001)。见图3。

图3 CDKN2B-AS1靶向miR-339-5p
2.5 抑制miR-339-5p 可逆转抑制CDKN2B-AS1对MDA-MB-453 增殖、迁移、侵袭的影响si-CD‑KN2B-AS1+anti-miR-339-5p 组MDA-MB-453 细 胞 中miR-339-5p 表达水平、G0 期细胞比例及P21、E-cad‑herin 表达水平显著降低,S 期细胞比例、细胞存活率、细胞迁移、侵袭数及Ki67、N-cadherin 表达水平显著升高(P<0.05),见表3,4。
表3 抑制miR-339-5p可逆转抑制细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(CDKN2B-AS1)对MDA-MB-453细胞增殖、迁移、侵袭的影响/±s

表3 抑制miR-339-5p可逆转抑制细胞周期蛋白依赖性激酶抑制剂2B反义RNA1(CDKN2B-AS1)对MDA-MB-453细胞增殖、迁移、侵袭的影响/±s
?
表4 Ki67、PCNA、E-cadherin、N-cadherin蛋白的表达/±s

表4 Ki67、PCNA、E-cadherin、N-cadherin蛋白的表达/±s
注:Ki67 为增殖标记蛋白细胞增殖核抗原-67,P21 为细胞周期依赖性蛋白激酶抑制因子1A,N-cadherin 为神经型钙黏蛋白,E-cadherin 为上皮型钙黏蛋白。
?
3 讨论
越来越多研究表明,lncRNA 与乳腺癌发生发展过 程 有 关,如MALAT1 可 抑 制 乳 腺 癌 转 移[10]。LINC00673 可 并 通 过miR-515-5p/MARK4/Hippo 信号通路促进乳腺癌细胞增殖[11]。LncRNA HEIH通过miR-4458/SOCS1轴抑制三阴性乳腺癌细胞增殖和诱导凋亡[12]。研究发现CDKN2B-AS1在结肠癌中异常表达,其可能是结肠癌发展的诊断生物标志物[13]。CDKN2B-AS1 又名ANRIL,胃癌病人中CDKN2BAS1高表达,与TNM分期和肿瘤大小显著相关,敲低CDKN2B-AS1显著抑制胃癌细胞系的增殖[14]。干扰CDKN2B-AS1 可通过miR-181a-5p/TGFβ1 轴抑制宫颈癌细胞增殖、侵袭、迁移,并促进细胞凋亡[15]。说明CDKN2B-AS1 可参与癌症等发生发展,但CD‑KN2B-AS1 对乳腺癌机制研究不清楚。本研究结果发现,与癌旁组织相比,乳腺癌组织中CDKN2B-AS1表达水平显著升高。说明CDKN2B-AS1可能在乳腺癌中起促癌作用。而进一步转染抑制CDKN2B-AS1表达后发现,G0期细胞比例明显升高,而S期细胞比例明显降低,说明抑制CDKN2B-AS1 可阻滞细胞周期;而细胞存活率、细胞迁移、侵袭数以及Ki67、Ncadherin 表达水平的显著降低,P21、E-cadherin 表达水平的显著升高,则说明可通过抑制CDKN2B-AS1而抑制细胞的增殖、迁移及侵袭。
研究报道在侵袭性细胞系MDA-MB-468 和MDA-MB-231以及乳腺癌组织中miR-339-5p表达下调,miR-339-5p 过表达在体外可对乳腺癌细胞的迁移和侵袭起到抑制作用,可能是乳腺癌预后的潜在生物标志物[16]。miR-339-5p 可减弱lncRNA MAFGAS1 诱导的乳腺癌的侵袭性[17]。miR-339-5p 可通过调节EMT 抑制非小细胞肺癌的转移[18]。lncRNA MALAT1 通过与miR-339-5p 结合来调节BLCAP 的表达,并促进乳腺癌预后不良[19]。本研究显示CD‑KN2B-AS1 可靶向调控miR-339-5p,而抑制miR-339-5p逆转抑制CDKN2B-AS1对MDA-MB-453细胞增殖、迁移、侵袭的作用。提示CDKN2B-AS1 可通过对miR-339-5p 的调控而影响MDA-MB-453 细胞的增殖、迁移及侵袭。
综上所述,抑制CDKN2B-AS1 表达可抑制乳腺癌MDA-MB-453 细胞增殖、迁移、侵袭,可能与miR-339-5p表达有关。

