茶黄素通过上调环状RNA叉头框蛋白3表达调控结肠癌细胞增殖及凋亡
田春阳,张萌,夏永欣,张向东
作者单位:南阳市中心医院消化科二病区,河南 南阳 473000
结肠癌是临床常见的一种消化道恶性肿瘤,其常发生于大肠底部与直肠内,环境、遗传因素及基因改变均可能影响结肠癌发生及发展,目前临床主要采用手术与化疗等方式进行治疗,但术后病人易出现转移及复发等情况,近年来,结肠癌发病率逐年上升,已严重威胁人类生命安全,因而寻找有效的治疗方法成为研究重点[1-2]。中药具有毒副作用小等特点,近年来,中药提取物在结肠癌等肿瘤治疗过程中发挥重要作用,但关于其作用机制仍未完全阐明[3-4]。茶叶具有抗癌等作用,其中茶黄素(TF)是其主要成分,并可抑制肿瘤细胞增殖及转移[5]。但TF对结肠癌的治疗效果及其作用机制尚未阐明。环状RNA-叉头框蛋白3(circ-Foxo3)在食管癌细胞中表达水平降低,可抑制细胞增殖及促进细胞凋亡[6]。但circ-Foxo3 是否可介导TF 抗结肠癌的过程尚未可知。因此,2018年10月至2019年12月,本研究主要探讨TF是否可调控circ-Foxo3影响结肠癌细胞增殖及凋亡。
1 资料与方法
1.1 一般资料TF 购自成都格纯生物医药有限公司;人结肠癌细胞HCT-8购自美国ATCC 细胞库;Li‑pofectamine2000 购自美国Invitrogen 公司;抑制物(si-NC)、抑制circ-Foxo3(si-circ-Foxo3)购自广州锐博生物科技有限公司;空载体(pcDNA)、过表达circ-Foxo3(pcDNA-circ-Foxo3)购自武汉淼灵生物科技有限公司;MTT、膜联蛋白V-FITC/碘化丙啶(Annexin V-FITC/PI)法凋亡检测试剂盒购自美国Sigma公司;Trizol试剂购自北京全式金生物技术有限公司;反转录与荧光定量检测试剂盒购自美国Thermo Fisher公司;兔抗人细胞核增殖抗原-67(Ki-67)、增殖细胞核抗原(PCNA)、B 细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)、活化胱天蛋白酶3(cleaved caspase-3)抗体购自美国Santa Cruz 公司;HRP 标记的山羊抗兔二抗购自武汉艾美捷科技有限公司。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1实验分组 HCT-8 细胞常规培养,取对数生长期HCT-8 细胞接种于96 孔板(5×103个/孔),分别加入不同浓度(15µmol/L、25µmol/L、50µmol/L)的TF 处理24 h[7],分别记作TF-L 组、TF-M 组、TF-H 组。同时将正常培养的细胞作为Con 组。按照Lipo‑fectamine2000 转染试剂说明书分别将pcDNA、pcD‑NA-circ-Foxo3 转染至HCT-8 细胞,分别记作pcDNA组、pcDNA-circ-Foxo3 组。分 别 将si-NC、si-circ-Foxo3 转染至HCT-8 细胞,加入含有浓度为50µmol/L TF 的培养基处理24 h,分别记作TF-H+si-NC 组、TF-H+si-circ-Foxo3组。
1.2.2MTT 法检测细胞增殖 收集各组HCT-8 细胞(1×105个/毫升)接种于96 孔板(每孔100µL),每孔加入MTT 溶液20 µL,置于培养箱继续培养4 h,弃上清,加入DMSO(每孔150µL),室温震荡孵育5 min,应用酶标仪检测各孔在波长为490 nm 处的吸光度值。
1.2.3流式细胞术检测细胞凋亡率 HCT-8细胞加入预冷PBS 洗涤后弃上清,加入500 µL 结合缓冲液,参照凋亡检测试剂盒检测各组细胞凋亡率。
1.2.4qRT-PCR 检测细胞中circ-Foxo3 的表达水平 采用Trizol 法提取HCT-8 细胞总RNA,参照反转录试剂盒合成互补DNA(cDNA)。qRT-PCR 反应与反应体系均按照试剂盒说明书操作并检测circ-Foxo3相对表达量。
1.2.5蛋白质印迹法检测Ki-67、PCNA、Bcl-2、Bax、Cleaved Caspase-3 蛋白表达 各组HCT-8 细胞加入400 µL RIPA 裂解液提取细胞总蛋白,SDSPAGE 分离蛋白,转膜,封闭,分别加入一抗稀释液(1∶1 000)与二抗稀释液(1∶2 000),室温孵育1 h,TBST洗涤,应用ImageJ软件分析各条带灰度值。
1.3 统计学方法采用SPSS 21.0 统计学软件分析数据。计量资料以±s表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,总体有差异进一步采用SNK-q检验进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 TF 对结肠癌细胞HCT-8 增殖的影响与Con组比较,TF-L 组、TF-M 组、TF-H 组细胞存活率及Ki-67、PCNA 蛋白水平降低(P<0.05),且TF-L 组、TF-M组、TF-H 组各指标比较均差异有统计学意义(P<0.05),见表1,图1。
表1 茶黄素对结肠癌细胞HCT-8增殖的影响/±s
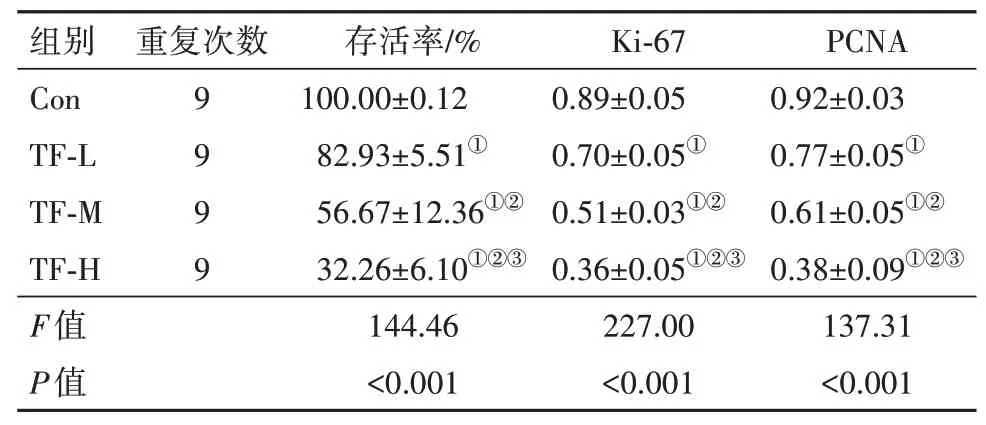
表1 茶黄素对结肠癌细胞HCT-8增殖的影响/±s
注:Ki-67为细胞核增殖抗原-67,PCNA为增殖细胞核抗原。①与Con组比较,P<0.05。②与TF-L组比较,P<0.05。③与TF-M组比较,P<0.05。
?

图1 Western blotting检测Ki-67、PCNA蛋白表达
2.2 TF 对结肠癌细胞HCT-8 凋亡及circ-Foxo3 表达量的影响与Con组比较,TF-L组、TF-M组、TF-H组凋亡率及Bax、Cleaved Caspase-3蛋白水平升高(P<0.05),Bcl-2 蛋白水平降低(P<0.05),且TF-L 组、TF-M 组、TF-H 组各指标比较均差异有统计学意义(P<0.05)。与Con 组比较,TF-L 组、TF-M 组、TF-H组circ-Foxo3 的表达水平升高(P<0.05),且TF-L 组、TF-M 组、TF-H 组间circ-Foxo3 的表达水平比较差异有统计学意义(P<0.05)。见表2,图2。
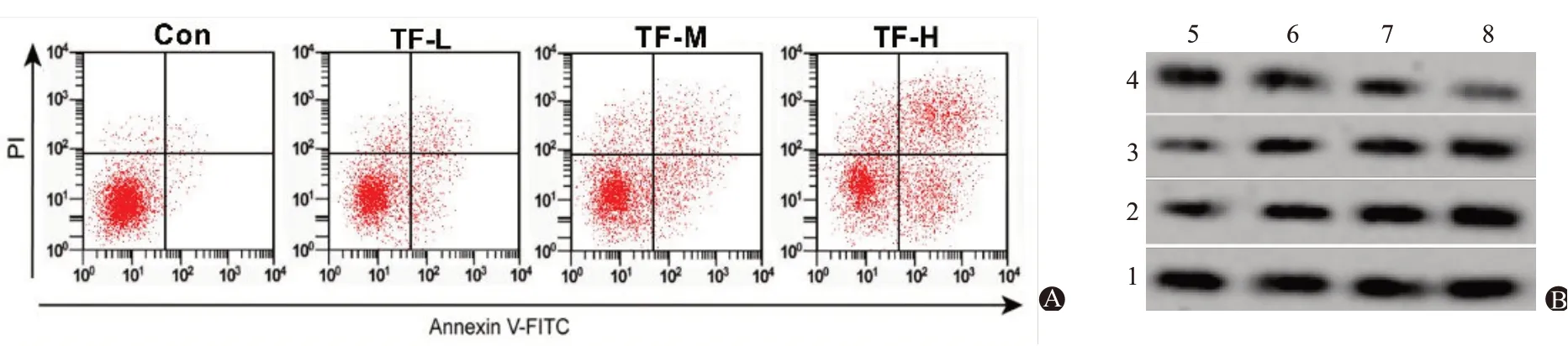
图2 茶黄素对结肠癌细胞HCT-8凋亡的影响:A为流式细胞术检测细胞凋亡率;B为Western blotting检测Bcl-2、Bax、Cleaved Caspase-3蛋白表达
表2 茶黄素对结肠癌细胞HCT-8凋亡及circ-Foxo3表达量的影响/±s
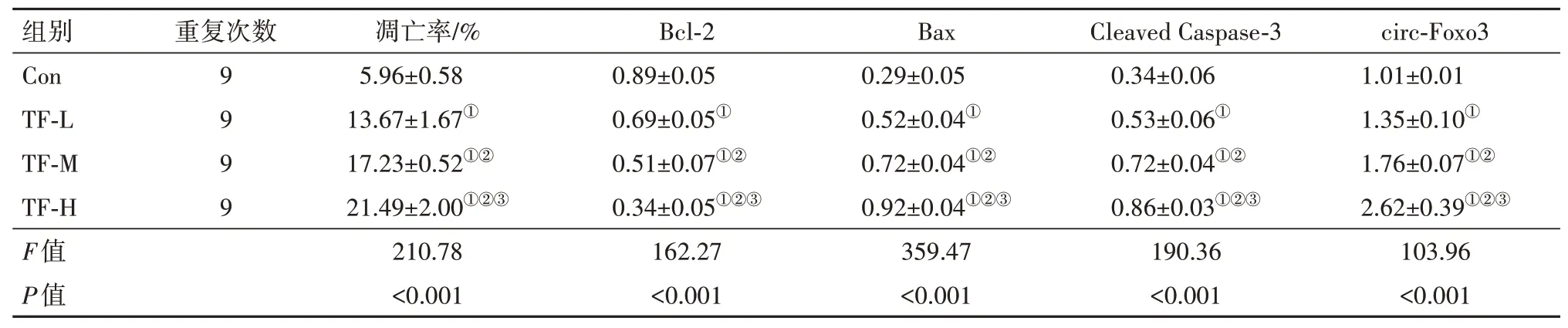
表2 茶黄素对结肠癌细胞HCT-8凋亡及circ-Foxo3表达量的影响/±s
注:Bcl-2 为B 细胞淋巴瘤/白血病-2,Bax 为Bcl-2 相关X 蛋白,Cleaved Caspase-3 为剪切的含半胱氨酸的天冬氨酸蛋白水解酶3,circ-Foxo3为环状RNA-叉头框蛋白3。①与Con组比较,P<0.05。②与TF-L组比较,P<0.05。③与TF-M组比较,P<0.05。
?
2.3 circ-Foxo3 过表达对HCT-8 细胞增殖及凋亡的影响与pcDNA 组比较,pcDNA-circ-Foxo3 组细胞存活率及Ki-67、PCNA、Bcl-2 蛋白水平降低(P<0.05),凋亡率及Bax、Cleaved Caspase-3 蛋白水平升高(P<0.05),见表3,图3。
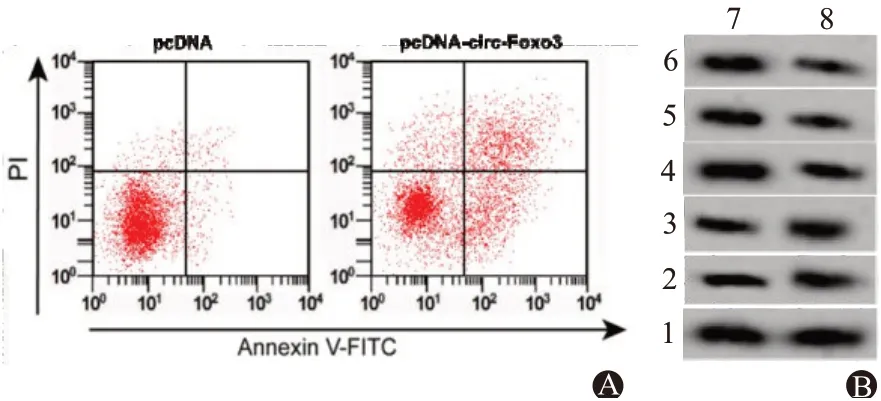
图3 circ-Foxo3过表达对HCT-8细胞增殖及凋亡的影响:A为流式细胞术检测细胞凋亡率;B为Western blotting检测Ki-67、PCNA、Bcl-2、Bax、Cleaved Caspase-3蛋白表达
表3 circ-Foxo3过表达对HCT-8细胞增殖及凋亡的影响/±s
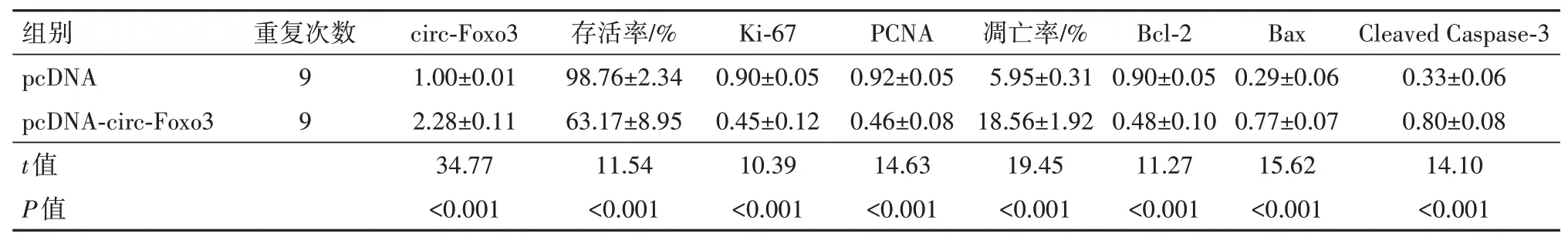
表3 circ-Foxo3过表达对HCT-8细胞增殖及凋亡的影响/±s
注:pcDNA 为空载体,pcDNA-circ-Foxo3 为过表达circ-Foxo3,circ-Foxo3 为环状RNA-叉头框蛋白3,Ki-67 为细胞核增殖抗原-67,PCNA 为增殖细胞核抗原,Bcl-2为B细胞淋巴瘤/白血病-2,Bax为Bcl-2相关X蛋白,Cleaved Caspase-3为剪切的含半胱氨酸的天冬氨酸蛋白水解酶3。
?
2.4 干扰circ-Foxo3表达可降低TF 对HCT-8细胞增殖的作用与TF-H+si-NC 组比较,TF-H+si-circ-Foxo3 组细胞存活率及Ki-67、PCNA 蛋白水平升高(P<0.05),见表4。
表4 干扰circ-Foxo3表达可降低茶黄素对HCT-8细胞增殖的作用/±s
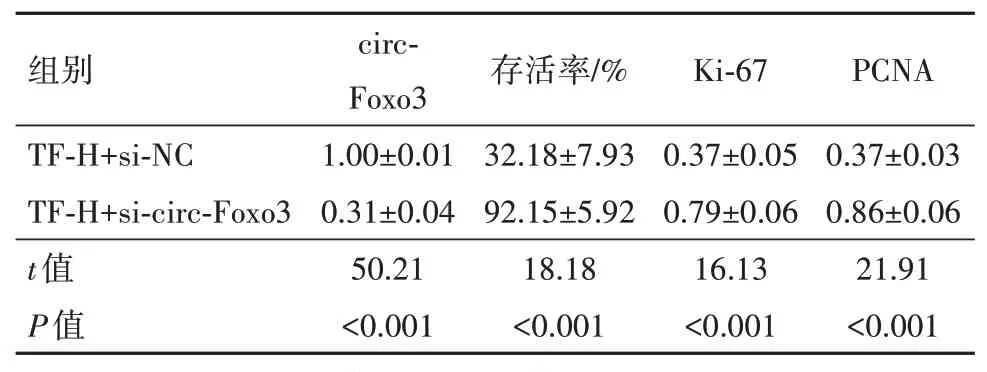
表4 干扰circ-Foxo3表达可降低茶黄素对HCT-8细胞增殖的作用/±s
注:TF-H+si-NC 为高浓度茶黄素+抑制物si-NC,TF-H+si-circ-Foxo3为高浓度茶黄素+抑制物circ-Foxo3,circ-Foxo3为环状RNA-叉头框蛋白3,Ki-67为细胞核增殖抗原-67,PCNA为增殖细胞核抗原。
?
2.5 干扰circ-Foxo3表达可降低TF 对HCT-8细胞凋亡的作用与TF-H+si-NC 组比较,TF-H+si-circ-Foxo3组凋亡率及Bax、Cleaved Caspase-3蛋白水平降低(P<0.05),Bcl-2蛋白水平升高(P<0.05),见表5。
表5 干扰circ-Foxo3表达可降低茶黄素对HCT-8细胞凋亡的作用/±s
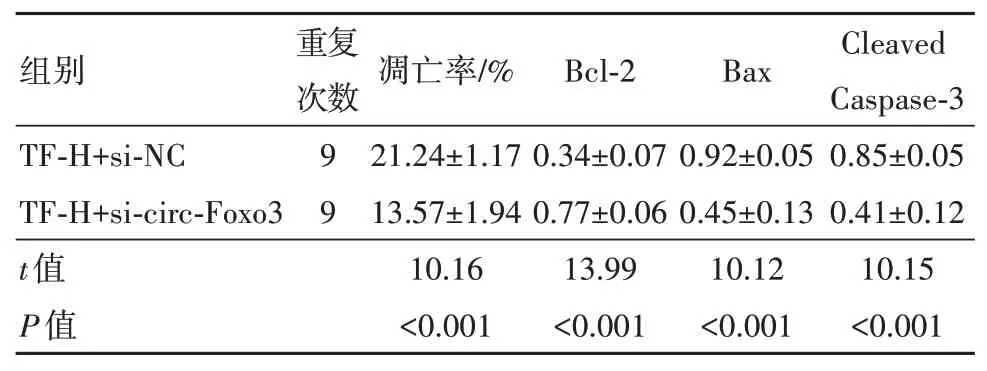
表5 干扰circ-Foxo3表达可降低茶黄素对HCT-8细胞凋亡的作用/±s
注:TF-H+si-NC 为高浓度茶黄素+抑制物si-NC,TF-H+si-circ-Foxo3 为高浓度茶黄素+抑制物circ-Foxo3,Bcl-2 为B 细胞淋巴瘤/白血病-2,Bax 为Bcl-2 相关X 蛋白,Cleaved Caspase-3 为剪切的含半胱氨酸的天冬氨酸蛋白水解酶3。
?
3 讨论
中药提取物可通过抑制结肠癌细胞增殖及转移从而发挥抗癌作用,但关于其作用机制尚未完全阐明,circRNA 在结肠癌发生过程中表达异常并可能通过调控细胞增殖、迁移及侵袭等生物学过程从而发挥作用,同时circRNA 还可能作为结肠癌靶向治疗的潜在靶点[8-11]。
TF 可抑制卵巢癌、卵巢癌干细胞增殖及转移[12-14]。红茶TF 与茶红素还可抑制结肠癌、肺癌细胞增殖、迁移及侵袭[15]。与上述研究结果相似,本研究结果显示不同剂量的TF处理后结肠癌细胞存活率降低,凋亡率明显升高,且呈剂量依赖性,提示TF可抑制结肠癌细胞增殖及促进细胞凋亡。研究表明Ki-67、PCNA在肿瘤中表达水平升高,并可参与细胞周期过程从而促进细胞增殖[16]。Bcl-2表达上调可抑制细胞凋亡,Bax表达上调可促进线粒体释放细胞色素C 而促进Caspase-3 磷酸化形成Cleaved Caspase-3从而诱导细胞凋亡[17]。本研究结果显示不同剂量的TF 处理后结肠癌细胞中Ki-67、PCNA、Bcl-2 的表达水平降低,Bax、Cleaved Caspase-3 的表达水平升高,且呈剂量依赖性,进一步证实TF可抑制结肠癌细胞增殖及诱导细胞凋亡从而发挥抗癌作用。
circ-Foxo3 在急性髓细胞性白血病中表达水平降低,并可能作用判断病人预后的辅助指标[18]。circ-Foxo3在食管鳞状细胞癌中表达水平降低,并可能通过调控miR-23a/PTEN 分子轴从而抑制食管鳞状细胞癌的进展[19]。circ-Foxo3 在尿路上皮癌中表达下调,并可能通过与miR-191-5p 相互作用而诱导尿路上皮癌细胞凋亡[20]。本研究结果显示不同剂量的TF处理后结肠癌细胞中circ-Foxo3的表达水平升高,且随着药物剂量的增加而显著升高,提示TF可能通过上调circ-Foxo3 的表达从而发挥抗结肠癌作用。本研究进一步分析显示circ-Foxo3 过表达后结肠癌细胞存活率降低,凋亡率升高,并可抑制Ki-67、PCNA、Bcl-2的表达及促进Bax、Cleaved Caspase-3 的表达,提示circ-Foxo3 过表达可抑制结肠癌细胞增殖及促进细胞凋亡。为探究TF 是否可通过调控circ-Foxo3的表达从而影响结肠癌细胞增殖及凋亡,本研究将si-circ-Foxo3 转染至结肠癌细胞,使用TF处理细胞,结果显示细胞增殖能力明显增强,凋亡率明显降低,提示干扰circ-Foxo3 表达可降低TF 对结肠癌细胞增殖及凋亡的作用。
综上所述,TF 可抑制结肠癌细胞增殖及促进细胞凋亡,其作用机制可能与上调circ-Foxo3 的表达有关,circ-Foxo3可能作为结肠癌靶向治疗的潜在靶点,还可进一步揭示TF抗结肠癌的分子机制。

