高效液相色谱法测定肾移植病人泼尼松龙、伏立康唑及其氮氧化物浓度
苏涌,张蕊,刘加涛,宋帅,葛朝亮,冯丽娟,许杜娟
作者单位:安徽医科大学第一附属医院,a药剂科,b中医药管理局中药化学三级实验室,安徽 合肥 230022
侵袭性真菌感染是肾移植术后常见的感染类型,肾移植术后5 年侵袭性真菌感染发生率高达35.3%,且其中近30%的真菌感染高危病人曾使用抗真菌药物预防性治疗[1-2]。真菌感染死亡率高达22.3%,侵袭性肺真菌病的死亡率甚至达到40%~100%,是导致肾移植病人死亡的主要原因之一[1-4]。如何提高肾移植病人抗真菌预防及治疗效果是临床急需解决的问题。
伏立康唑(VRCZ)是肾移植术后首选的抗真菌药物之一,血药浓度决定了其疗效及毒副作用的产生[5-6],最新的指南[7]建议VRCZ 血浆谷浓度下限应>0.5 mg/L,上限应<5.0 mg/L。VRCZ 的代谢为非线性药代动力学,主要经细胞色素氧化酶P450 2C19(CYP2C19)在肝脏代谢生成无活性的伏立康唑氮氧化物(VRCZ N-oxide),随后经肾脏排泄。肾移植病人需长期服用糖皮质激素类药物泼尼松,其同类药物地塞米松等可显著加速伏立康唑的代谢,降低后者的血药浓度[8-9]。泼尼松为前体药物,在体内代谢为活性形式泼尼松龙发挥作用[10]。泼尼松龙是否同样影响肾移植病人VRCZ的代谢?基于此假设,我们拟建立一种快速准确的高效液相色谱法(HPLC)同时检测泼尼松龙、VRCZ 及其主要代谢产物VRCZ N-oxide 的浓度,用以评估泼尼松联用对VRCZ代谢的影响。
1 仪器与试药
1.1 仪器Waters2695 高效液相色谱仪(配备Wa‑ters2489紫外检测器,美国);FA2104电子天平(上海天平仪器厂);25BTS电子天平(德国塞多利斯公司);5430R冷冻高速离心机(德国艾本德公司);涡旋振荡器(江苏其林贝尔仪器公司);氮吹仪(EYELA,日本)。
1.2 试药VRCZ 对照品(中国药品生物制品检定所,批号201402,纯度99.7%);泼尼松龙对照品(上海源叶生物,批号B25645,纯度>98%);VRCZ N-ox‑ide 对照品(加拿大TRC,批号4-FB1-47-4,纯度>99%);乙酸乙酯(上海润捷,分析纯);正己烷(无锡展望化工试剂,分析纯);甲醇、乙腈(Tedia,色谱纯);灭菌注射用水(四川科伦)。空白血浆来源于安徽医科大学第一附属医院体检中心。
2 方法
2.1 色谱条件安捷伦ZORBAX Eclipse XDB C18(4.6×250 mm,5µm),流动相为乙腈∶水(27∶73~60∶40),梯度洗脱;流速为1.0 mL/min;检测波长为244 nm;柱温为30 ℃;进样量20µL。
2.2 溶液配制精密称取泼尼松龙、VRCZ及VRCZ N-oxide对照品,甲醇稀释,分别配制成浓度为10 mg/L、1 mg/mL 及1 mg/mL 的贮备液,置于-80 ℃超低温冰箱内保存备用,使用前甲醇稀释至所需浓度。
2.3 样品处理取空白血浆360µL(EDTA抗凝),分别加入泼尼松龙对照溶液20µL、VRCZ 及VRCZ Noxide对照溶液各10µL,涡旋混匀30 s,加入萃取液乙酸乙酯800µL、正己烷200µL,涡旋2 min,5 000g离心5 min,取上层有机相。下层血浆再次加入萃取液,重复上述萃取步骤,合并两次有机相于50 ℃氮气下吹干,加100µL 流动相涡旋2 min 复溶,12 000g离心10 min,取上清液20µL进样。
2.4 方法学验证
2.4.1方法专属性 6 个不同个体的空白血浆,按“2.3”项下处理(不加入对照液),考察方法专属性。
2.4.2标准曲线 分别于空白血浆中加入不同浓度对照品工作液,使泼尼松龙终浓度为100µg/L、75µg/L、25µg/L、12.5µg/L、6.25µg/L、3.13µg/L,VRCZ终浓度为20 mg/L、15 mg/L、5 mg/L、2.5 mg/L、0.625 mg/L、0.16 mg/L,VRCZ N-oxide终浓度为10 mg/L、7.5 mg/L、2.5 mg/L、1.25 mg/L、0.625 mg/L、0.16 mg/L。检测样品,分别以对应样品峰面积(X)对泼尼松龙浓度(C1)、VRCZ浓度(C2)及VRCZ N-oxide(C3)作线性方程。
2.4.3精密度、回收率及稳定性考察 分别配制泼尼松龙浓度为75 µg/L、12.5 µg/L、6.25 µg/L、3.13µg/L(定量限),VRCZ 浓度为15 mg/L、2.5 mg/L、0.625 mg/L、0.16 mg/L(定量限),VRCZ N-oxide 浓度为7.5 mg/L、1.25 mg/L、0.625 mg/L、0.16 mg/L(定量限)的甲醇溶液及含药血浆。甲醇溶液直接进样,含药血浆处理后进样。以含药血浆峰面积与甲醇溶液相应峰面积的比值表示绝对回收率,含药血浆计算浓度与加入浓度的比值为相对回收率。含药血浆处理后于同一天内平行测定5 次,计算得日内RSD;连续3 d 测定5 次,计算得日间RSD。进样器内放置24 h或-80 ℃下反复冻融3次再进行处理,平行测定5次,考察稳定性。
2.5 病人血药浓度检测收集2019 年9 月至2020年3 月在安徽医科大学第一附属医院住院,接受VRCZ治疗的肾移植病人24例,男14例、女10例,年龄范围为23~64 岁,体质量范围为38~85 kg。泼尼松剂量为每日1次10 mg口服,VRCZ 剂量为每12小时1 次,每次200 mg,静脉滴注或口服。病人接受VRCZ 治疗时间均大于5 d,血浆VRCZ 已达稳态,测定病人血浆谷浓度。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
2.6 统计学方法计量资料用±s表示,单因素方差分析或χ2检验用于组间差异分析,Spearman相关性分析用于评估数据间的相关性,线性回归用于评估数据间的线性关系,检验显著性水平P<0.05。
3 结果
3.1 专属性实验上述色谱条件下泼尼松龙、VR‑CZ 及VRCZ N-oxide 分离良好,无内源性物质干扰。VRCZ N-oxide 保留时间为10.05 min,泼尼松龙为11.76 min,VRCZ为17.43 min,见图1。
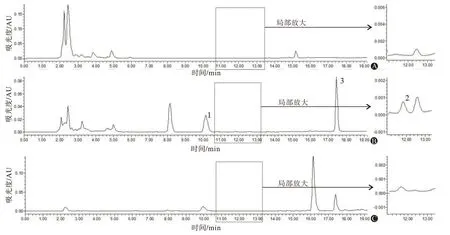
注:1—伏立康唑氮氧化物;2—泼尼松龙;3—伏立康唑。
3.2 线性关系考察以各对照品峰面积(X)对血浆浓度(C)进行线性回归,分别得到线性方程为:C1=0.007 1X-1.844 6(r=0.993 1)、C2=1E-05X-0.073 1(r=0.999 8)、C3=8E-06X-0.352 2(r=0.997 3)。结果表明,泼尼松龙、VRCZ及VRCZ N-oxide分别在100~3.13µg/L、20~0.16 mg/L和10~0.16 mg/L浓度范围内线性良好。
3.3 精密度及回收率实验泼尼松龙、VRCZ 及VRCZ N-oxide 日内和日间精密度RSD 在1.93%~6.74%,绝对回收率在65.48%~86.86%,表明该方法重复性较好,见表1。
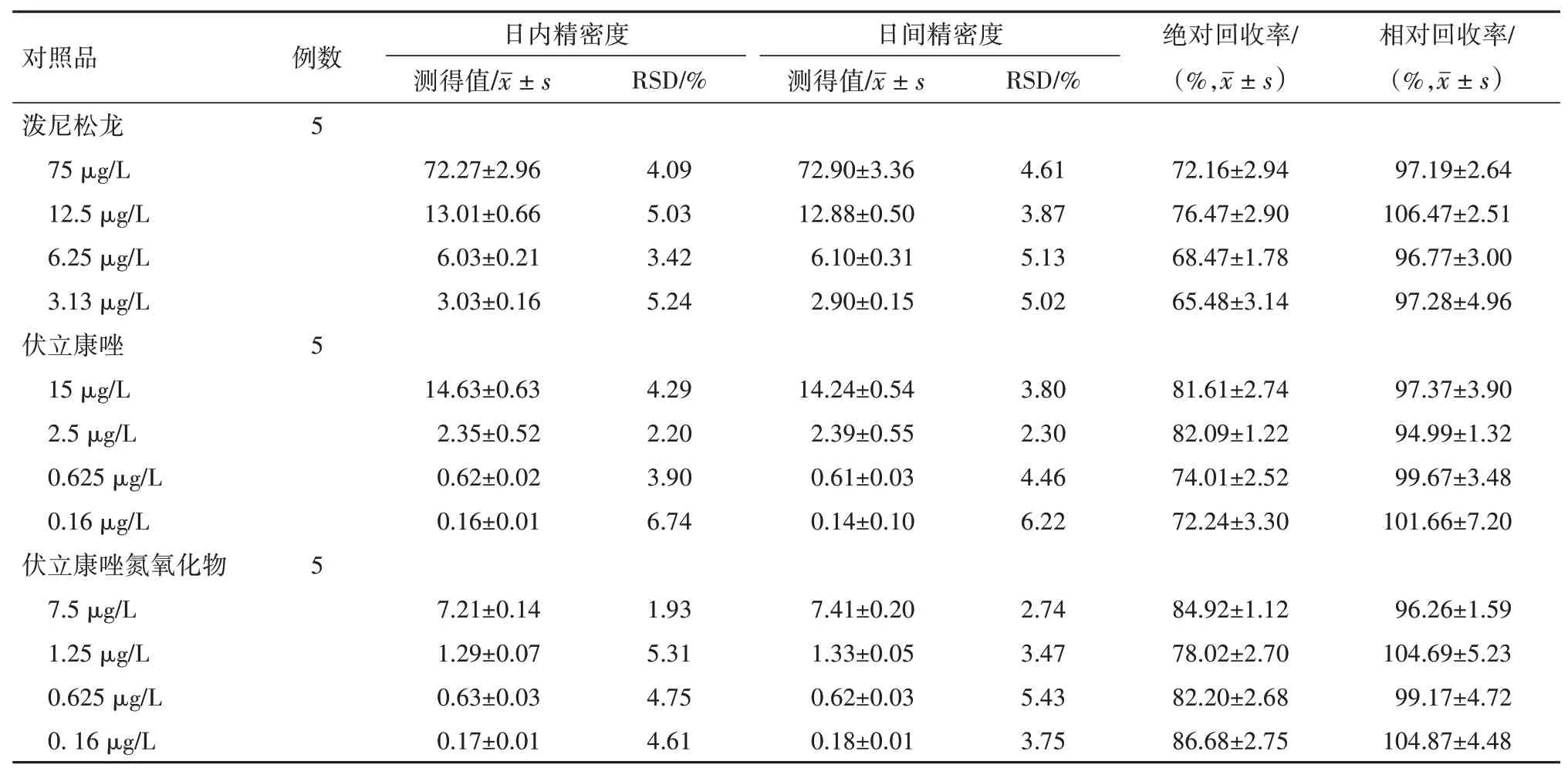
表1 精密度及回收率实验结果
3.4 稳定性考察VRCZ 血浆按“2.3”项下处理后进样器放置24 h 或-80 ℃下反复冻融3 次再进行处理,结果显示泼尼松龙、VRCZ 及VRCZ N-oxide 稳定性较好,见表2。
表2 稳定性实验结果/±s
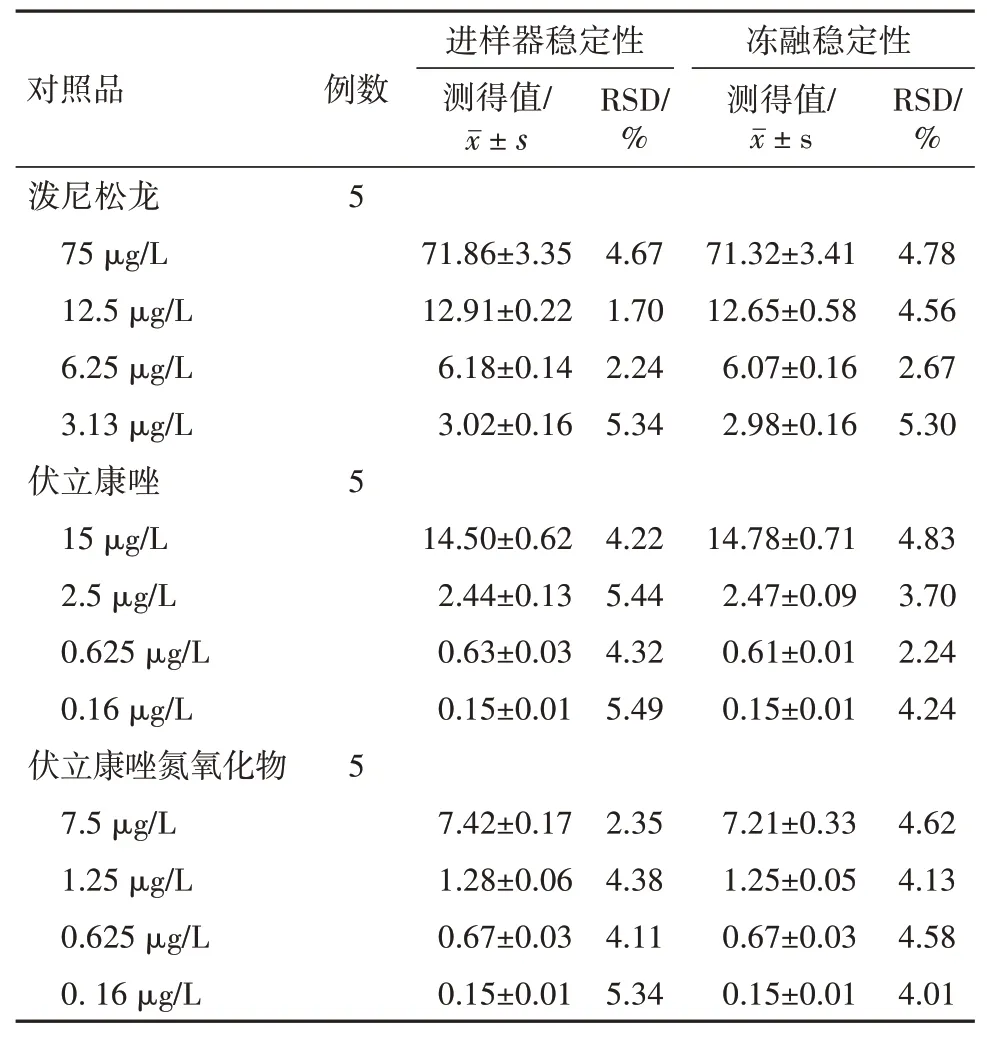
表2 稳定性实验结果/±s
?
3.5 病人血药浓度测定24例肾移植病人血药浓度检测结果显示病人血浆VRCZ浓度范围在0.17~5.44 mg/L,个体差异较大。泼尼松龙、VRCZ N-oxide浓度范围分别在7.75~72.75 µg/L 及0.66~3.06 mg/L,见表3。
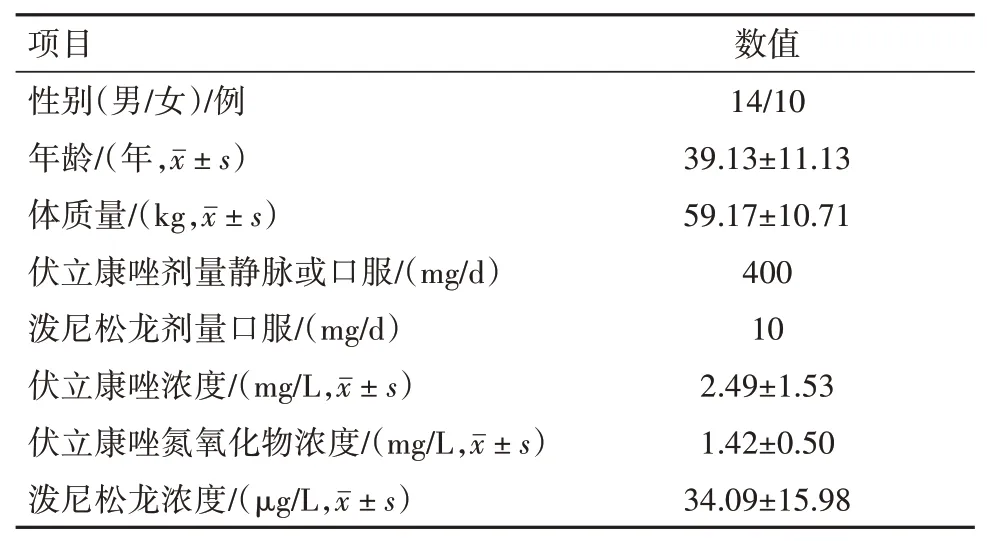
表3 肾移植24例基本信息
3.6 病人血药浓度影响因素分析探讨VRCZ 及其代谢产物之间的关系,以VRCZ 及VRCZ N-oxide浓度做散点图,未发现两者存在明显的关联性。进一步以VRCZ、VRCZ/VRCZ N-oxide 浓度的比值(以下简称比值)做线性回归,结果发现VRCZ 与该比值之间存在较强的线性关系,提示该比值可用于VRCZ代谢速度的评估。Spearman检验结果显示泼尼松龙浓度与VRCZ 浓度、比值之间未见相关性,但与VR‑CZ N-oxide 浓度之间存在相关性,P=0.023。根据泼尼松龙的百分位数间距,将其分为低浓度组(<27µg/L)、中浓度组(27~42 µg/L)、高浓度组(>42 µg/L),评估不同组间VRCZ 代谢的情况,结果显示不同组间性别、年龄、体质量无差异,见表4。随着泼尼松龙浓度升高,VRCZ 及其代谢产物浓度均有升高的趋势,但差异无统计学意义,比值未见明显变化,提示泼尼松龙不同浓度对VRCZ代谢无明显影响。
表4 不同泼尼松龙浓度组间性别、年龄、体质量的比较
4 讨论
VRCZ 在 肝 脏 主 要 经CYP2C19、CYP3A4 及CYP2C9代谢,CYP2C19是其最主要的代谢酶。VR‑CZ 经CYP2C19代谢后,主要生成无抗菌活性的VR‑CZ N-oxide,约占其代谢产物的72%[11]。根据代谢活力的不同,可将CYP2C19 分为快代谢型(UM)、正常代谢型(EM)、中间代谢型(IM)以及慢代谢型(PM)[12]。CPIC 指南提示EM 及IM 病人建议VRCZ的剂量为每12 小时1 次,每次为200 mg,而UM 及PM 则可以考虑更换其他抗真菌药物[13]。我们前期临床工作中发现肾移植病人VRCZ 血药浓度偏低,约19%的病人浓度低于0.5 mg/L。同时肾移植病人群体药动学研究发现,对于CYP2C19 为EM 型的肾移植病人,建议其VRCZ剂量为每12小时1次,每次为300 mg,高于正常推荐剂量[14],与我们临床观察的结果相似,提示肾移植病人VRCZ代谢较快。
移植术后由于抗排斥反应的需要,病人需长期使用他克莫司+霉酚酸+泼尼松三联免疫抑制方案。文献报道指出CYP2C19 启动子-1 750/-1 736 bp 区域含有糖皮质激素反应元件(GRE)。糖皮质激素受体(GR)与配体结合后,可与GRE 相互作用,调节靶基因的转录。在肝HepG2 细胞中,地塞米松可通过激活GR 上调CYP2C19 的表达[15],其与VRCZ 联用后,VRCZ 清除率上升41%[8-9]。我们推测肾移植病人VRCZ代谢加快可能与联用泼尼松有关。
本研究中通过HPLC 法,以乙腈和水为流动相,梯度洗脱,基线稳定,色谱峰分离良好,目标物质保留时间处无内源性干扰。预实验中曾尝试使用Kro‑masil C18、Dimaonsil C18 及Hypersil ODS 色谱柱,结果显示泼尼松龙保留时间处有明显内源性物质干扰峰,调整流动相比例无法将两者分离。肾移植病人泼尼松服用量较小,泼尼松龙浓度较低,需要大量样本浓缩以满足检测需要。在预实验过程中曾选择固相萃取小柱进行样本的浓缩和纯化,但由于样本量较大,血浆中物质成分复杂,导致目标物质回收率较低,部分样本甚至出现无法保留的现象,目标物质回收不稳定。改用萃取法后,可获得较稳定的回收率。
VRCZ 为非线性药代动力学,其原型药物浓度与其代谢产物间未见直接的相关性,但VRCZ 与VRCZ/VRCZ N-oxide 的比值具有较强的线性关系,与文献报道一致[11,16],提示该比值可用于VRCZ 代谢强度的评估。本次研究发现随着泼尼松龙浓度升高,VRCZ 与VRCZ N-oxide 的比值未见明显变化,提示泼尼松龙对VRCZ 的代谢并没有显著影响。但VRCZ 及其氮氧化浓度均有升高趋势,差异无统计学意义,同时相关性检验结果提示泼尼松龙浓度与伏立康唑氮氧化物浓度存在相关性,提示泼尼松龙与VRCZ 的代谢存在着相似的变化趋势,这可能是病人肝脏整体代谢能力的个体差异,从而导致数据上的趋势性,并不能证实泼尼松龙浓度对VRCZ 代谢存在影响。
VRCZ 的代谢受到病人年龄、肝功能以及CYP2C19 基因型等多种因素的影响[17-18]。本研究纳入病人的老年病人较少,因此未观察年龄对VRCZ代谢的影响,同时未纳入病人肝功能等指标,是本课题的不足之处。
《伏立康唑个体化治疗指南》已明确指出糖皮质激素与VRCZ 联用时,应密切监测疗效及安全性,地塞米松、甲泼尼龙等对VRCZ 代谢的诱导作用已有明确报道,目前认为泼尼松龙对VRCZ 代谢的影响小于地塞米松,但具体作用尚不明确[8-9,19]。本研究中未发现肾移植病人泼尼松龙浓度对VRCZ 代谢的影响,与之前的报道相近。但泼尼松龙浓度与伏立康唑氮氧化物之间存在相关性,仍提示泼尼松龙浓度对VRCZ 的代谢具有一定指示性作用,在群体药动学研究中将其纳入到群体模型中,可能会提高群体模型的准确性。同时本研究的样本数量较少,仍需要大样本的病人数据,在明确病人CYP2C19 基因型的情况下,探讨VRCZ与泼尼松之间相互作用。

