基于厌氧条件下转录组分析的单增李斯特氏菌强启动子的鉴定
汪舒颖, 马俊飞, 季倩玉, 刘 箐
上海理工大学健康科学与工程学院,上海 200093
单增李斯特氏菌(L.monocytogenes)是一种革兰氏阳性菌,兼性厌氧,具有胞内寄生、胞间逃逸的生存特质。它与大肠杆菌、沙门氏菌等是常见于肿瘤疫苗研究的细菌活载体[1,2]。利用减毒L.monocytogenes作为细菌活载体的优势在于不仅能通过MHCⅡ类途径将抗原短肽递呈给CD4+T淋巴细胞,更重要的是由于其胞内寄生的特质,可以在宿主细胞内将抗原通过MHCⅠ类分子递呈给CD8+T淋巴细胞[3,4]。CD4+和CD8+T淋巴细胞共同参与体内的适应性免疫应答过程,其中表达CD8的细胞毒性T淋巴细胞(Cytotoxic T lymphocyte,CTL)在肿瘤免疫治疗中起到重要的作用[5,6]。在之前的研究中我们发现,重组减毒L.monocytogenes外源抗原表达水平较低,这可能是重组疫苗株未能表现出更好的免疫保护效果的原因[7,8]。因此提高在特定环境下外源蛋白在重组减毒L.monocytogenes中的表达量是推进工程单增李斯特氏菌研究发展中亟待解决的问题。
启动子是在DNA链上通过与RNA聚合酶结合,从而启动mRNA合成的一段序列,是基因表达调控中重要的组件之一[9]。在大肠杆菌和沙门氏菌活载体的研究中,为了稳定细菌在肿瘤病灶的外源蛋白表达水平,已有报道通过挖掘在厌氧培养条件下稳定的天然启动子,或通过改造天然启动子来优化细菌的外源蛋白表达系统[10,11]。目前有关优化启动子的策略在微调代谢工程和合成生物学中的应用已有广泛的研究[12,13]。其中,利用转录组测序技术获得不同转录强度的天然启动子已是一种较为成熟的启动子建库策略[14-16]。
在之前的研究中,已有通过转录组测序的方式,挖掘了在酸性条件下或28℃温度中的L.monocytogenes组成型启动子,但有关厌氧环境中L.monocytogenes强启动子的挖掘鲜有报道[17,18]。因此,本研究通过对在厌氧和有氧条件下L.monocytogenes转录组数据的系统分析,确定了一组天然启动子。利用绿色荧光蛋白报告基因对这些启动子进行表征,筛选出活性最好的启动子。为了探究筛选出的启动子在不同外源蛋白转录过程中的适用性,我们选择了用于肿瘤治疗研究的天青蛋白和产气荚膜梭菌θ毒素进行表达量的评估。L.monocytogenes厌氧启动子的筛选丰富了L.monocytogenes的天然启动子文库,对其未来在肿瘤治疗细菌活载体应用研究方面具有一定的价值。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
菌株L.monocytogenes EGD-e由作者所在课题组前期保藏。EGD-eΔactA/inlB由课题组前期工作中构建。质粒pERL3由华中师范大学罗勤教授赠与。
1.1.2 实验试剂
Bam HⅠ限制性内切酶,大连宝生物工程有限公司;质粒提取试剂盒、DNA胶回收试剂盒,杭州博日科技股份有限公司;ClonExpress MultiS One-step Cloning kit多片段一步克隆试剂盒,南京诺唯赞生物科技有限公司;其他试剂均为分析纯级。
1.1.3 仪器和设备
PCR仪,美国Applied Biosystems;电转仪,电泳仪,美国Bio-Rad;凝胶成像仪,美国Gene;Nano-Drop200C,美国Thermo Fisher;振荡培养箱,天津莱玻特瑞;厌氧培养箱,英国Baker Ruskinn;离心机,德国Eppendorf公司;酶标仪,美国Molecular Devices。
1.1.4 培养基
LB培养基和BHI培养基购买自北京陆桥技术股份有限公司。
1.2 实验方法
1.2.1 转录组测序样品制备
将L.monocytogenes EGD-e以1×104CFU涂布在BHI固体平板上,分别放在厌氧培养箱和普通恒温培养箱中,在37℃环境下培养24 h。用细胞刮刀将菌落刮下,用BHI培养基重悬,调菌液浓度到OD600=1.0。取5 mL菌液,加入1 mL苯酚乙醇混合溶液(苯酚∶乙醇=1∶9)后,在冰上放置30 min。将混合物在4℃下以6 000 r/min离心5 min,弃掉上清,收集菌体。将菌体重悬于50μL变容菌素和50μL溶菌酶溶液中,并转移到1.5 mL离心管中,在37℃条件下孵育30 min。在离心管中加入1 mL Trizol破碎细菌细胞,离心后取样品上清,并在其中加入200μL三氯甲烷进行抽提。接着用异丙醇沉淀离心后样品水相层中的总RNA,并用75%乙醇清洗沉淀。随后待离心管中多余的乙醇晾干后,加入30μL DEPC水,并用NanoDrop 200C检测RNA浓度。最后将提取的RNA样本用液氮冻存后寄送至上海生工生物工程有限公司进行转录组测序及分析。其中厌氧条件处理的样本命名为EGDeAN组,有氧条件下处理的样本命名为EGDe组。
1.2.2 厌氧启动子的筛选及克隆
根据转录组测序结果,将featureCounts[19]计算得到的FPKM(每千个碱基的转录每百万映射读取的片段数)作为评估样本转录水平的依据,筛选厌氧培养条件下转录水平较高的基因。设定的筛选条件为EGDeAN组的FPKM值需显著高于EGDe组,且EGDeAN组的FPKM值需大于1 000,EGDe组的FPKM值需小于3 000。通过与NCBI数据库中EGDe全基因组进行比对,将筛选出的基因(见表1)上游非编码区作为其启动子序列。以提取的EGDe全基因组为模板,设计引物获取启动子片段。
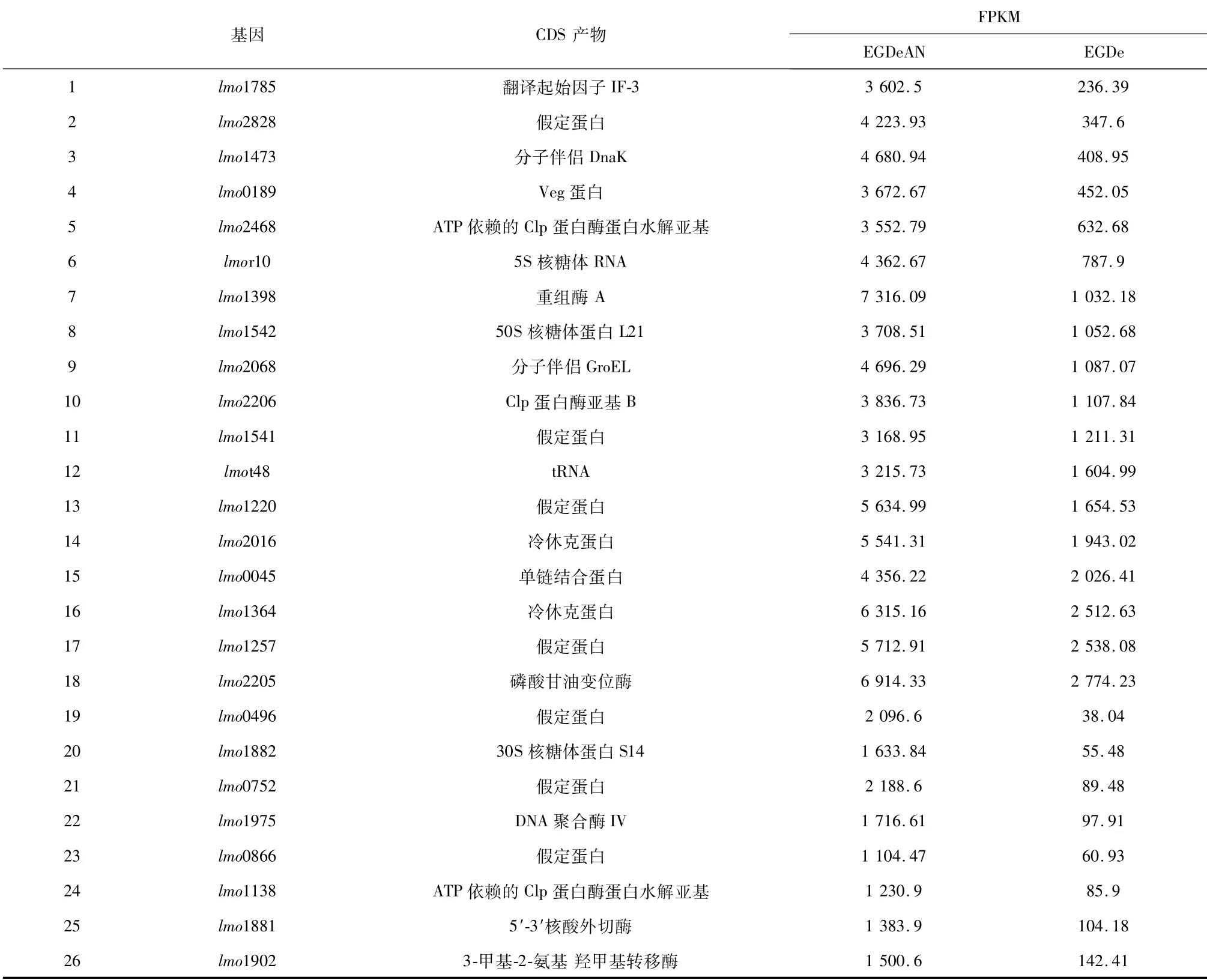
表1 基于转录组测序结果选取的启动子信息统计
1.2.3 重组菌株的构建方法及鉴定
绿色荧光蛋白EGFP基因序列经密码子优化后,由上海生工生物工程有限公司合成后,设计相应的引物egfp F/R获得egfp基因片段。用Bam HⅠ限制性内切酶对单增李斯特氏菌穿梭质粒pERL3进行单酶切后,用胶回收试剂盒获得纯化的线性化载体。使用多片段一步克隆试剂盒分别将不同的启动子片段、egfp基因片段和线性化载体片段利用同源重组原理进行连接,获得不同的pERL3-Promoteregfp重组质粒后,转化大肠杆菌DH5α菌株,并在含有卡那霉素的LB琼脂培养基上筛选阳性克隆。用引物pERL3 F/R对阳性克隆进行PCR鉴定,将目标序列长度正确的质粒送至华大基因公司测序。将测序正确的含有不同启动子的绿色荧光蛋白基因报告质粒转化EGD-eΔactA/inlB感受态细胞,并在含有红霉素的BHI琼脂培养基上筛选,用引物pERL3 F/R对阳性克隆进行PCR鉴定,序列长度正确的为表达绿色荧光蛋白的重组单增李斯特氏菌。成功构建的启动子、egfp基因以及鉴定重组质粒的引物均展示在表2中。

表2 重组菌株所用启动子、pERL3质粒以及egfp基因的引物列表
1.2.4 重组菌株荧光强度的测定
将表达绿色荧光蛋白的重组L.monocytogenes在含有红霉素的BHI平板上进行活化,挑取平板上的单菌落接种到20 mL含有红霉素的BHI培养液中,放置在厌氧培养箱中过夜培养。次日,5 000 r/min离心5 min收集菌体,并用无菌PBS溶液洗涤菌体一次,调整菌液浓度为OD600=1.0后,取200 μL菌液至黑色96孔板,用酶标仪检测在激发光485 nm和发射光525 nm处的荧光强度。每株菌设置3个生物学重复,结果均采用GraphPad Prism软件进行分析,通过单因素方差分析比较组间差异。p<0.05被认为具有统计学意义(*p<0.05,**p<0.01,****p<0.000 1)。
1.2.5 外源蛋白表达菌株的构建及表达水平的鉴定
外源蛋白天青蛋白和产气荚膜梭菌θ毒素蛋白的氨基酸序列从Uniprot网站获得并倒推出cDNA序列,经密码子优化,并在3’端连上了6×His标签基因序列后,交由上海生工生物工程有限公司合成。将在厌氧培养条件下启动绿色荧光蛋白表达水平最高的启动子序列Pan4、天青蛋白的基因序列azu或产气荚膜梭菌θ毒素蛋白的基因序列pfo以及Bam HⅠ单酶切后的pERL3线性化载体片段利用同源重组原理进行连接,获得pERL3-Pan4-azu和pERL3-Pan4-pfo重组质粒。将测序正确的两种质粒分别转化至EGD-eΔactA/inlB中。
将重组菌株EGD-eΔactA/inlB-pERL3-Pan4-azu和EGD-eΔactA/inlB-pERL3-Pan4-pfo以1×104CFU涂布在含有红霉素的BHI平板上,在厌氧培养箱中培养24 h。用细胞刮刀刮取全部菌落,接种到200 mL含有红霉素的BHI培养基中,在37℃的厌氧培养箱中培养15 h。离心收集菌体,将菌体重悬在含有10 mmol/L Tris-HCl(pH7.5)、10 mmol/L PMSF、5 mmol/L Na2-EDTA的裂解缓冲液中。将菌体以60%功率超声破碎,超声2 s,间隔3 s,总时长为30 min。将超声后的混合物在4℃条件下以12 000 r/min离心20 min,收集上清。将上清蛋白用孔径为3 kDa的超滤管浓缩后,通过Western-blot检测样本中天青蛋白(~16.83 kD)和θ毒素蛋白(~55.88 kD)的表达。检测一抗为抗His标签的鼠单抗(Absin,上海,中国),二抗为Alexa Fluor Plus 800修饰的羊抗鼠IgG(Invitrogen,美国)。
2 结果与讨论
2.1 厌氧水平下EGD-e高转录水平启动子筛选
通过转录组测序技术对厌氧条件下(EGDeAN)和有氧条件下(EGDe)培养的EGDe基因组中2 825个基因的转录图谱进行分析。如图1所示,共表达韦恩图显示EGDeAN组和EGDe组共表达基因共有2 580个,EGDeAN组特有表达基因数为186个,EGDe组特有表达基因数为59个。

图1 EGDeAN组和EGDe组基因共表达韦恩图
对EGDeAN组和EGDe组的基因表达进行显著性差异分析,如图2所示,EGDeAN组的基因相对于EGDe组共有546个基因显著上调,共有621个基因显著下调。因为FPKM值的计算考虑了测序深度和基因长度对读数计数的影响,是评估基因表达水平的常用方法[20]。因此从显著上调的546个基因中,根据EGDeAN组的FPKM值大于1 000,EGDe组的FPKM值小于3 000的筛选条件,从高到低排列进行筛选,最终筛选出26个基因,如表1所示。根据NCBI数据库中EGD-e全基因组找到每个基因的对应上游非编码序列,以此作为该基因的启动子区域。

图2 EGDeAN组和EGDe组基因表达差异火山图
2.2 荧光报告菌株的构建
为了直观地表征筛选出的启动子在厌氧培养条件下启动下游基因转录表达的水平,如图3所示,将筛选出的启动子连接绿色荧光蛋白报告基因egfp构建重组荧光报告菌株EGD-eΔactA/inlB-pERL3-Promoter-egfp。虽然根据转录组数据共筛选出了26个基因,但其中8个启动子未能成功构建,最终成功构建了18个携带不同的pERL3-Promoter-egfp质粒的重组菌株,PCR鉴定结果如图4所示。

图3 荧光蛋白表达质粒构建图
图4 荧光表达菌株PCR鉴定图
2.3 重组菌株荧光强度的测定
为了比较不同重组荧光报告菌株的荧光强度,并以此作为评估启动子强度的标准,将菌液浓度统一调整到OD600=1.0,并对数据进行归一化处理,即将测得的荧光值除以OD600作为结果。如图5所示,以EGD-eΔactA/inlB为对照组,比较了基于转录组测序分析结果筛选后成功构建的18个候选强启动子和EGD-e hly基因的启动子调控下荧光蛋白的表达水平。hly基因的启动子是减毒L.monocytogenes活载体应用中常用的启动子[21,22]。结果显示,含有Pan4,Pan10,Pan12,Pan14启动子的荧光报告菌株的荧光强度不仅均显著高于对照组,也均高于含有Phly启动子的重组菌株,它们的荧光值分别为Phly组的7.8倍,1.9倍,2.0倍和1.8倍。其中Pan4启动子调控下的荧光蛋白表达水平最高,因此选择Pan4启动子进一步评估其应用潜力。
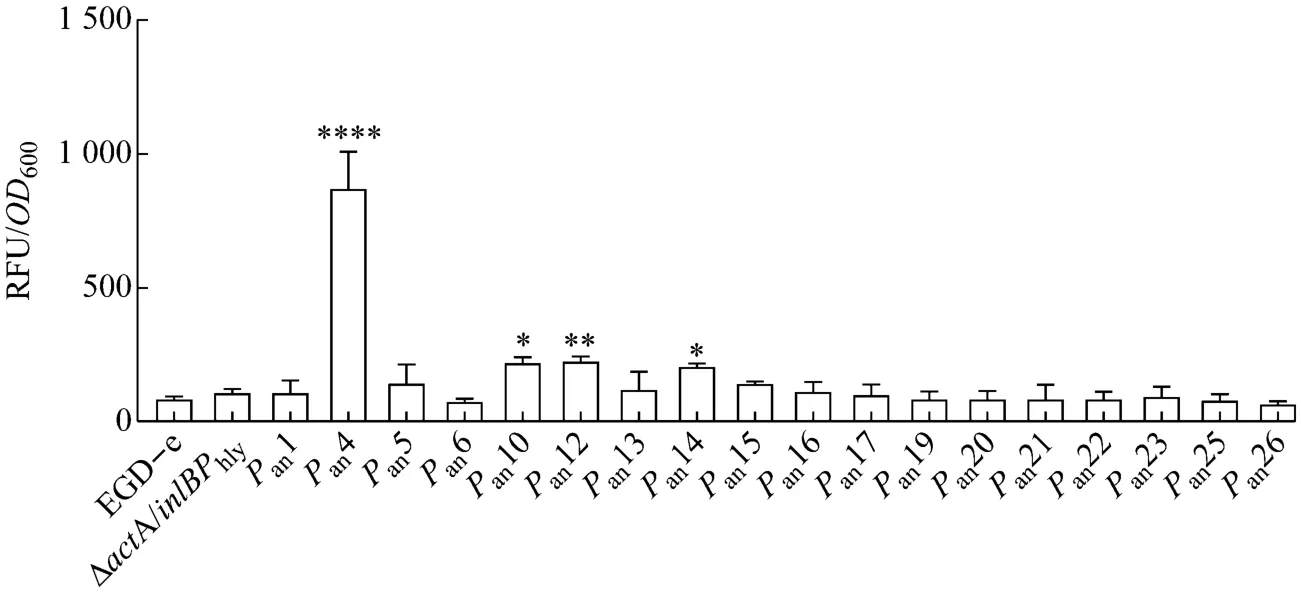
图5 重组菌株EGD-eΔactA/inlB-pERL3-Promoter-egfp荧光强度测定结果
2.4 Pan4启动外源蛋白表达能力的评估
减毒L.monocytogenes可作为疫苗或药物活载体应用于肿瘤治疗中,因此在肿瘤微环境的缺氧条件下表达外源蛋白的能力十分重要。为了评估厌氧启动子Pan4的应用潜力,利用天青蛋白和产气荚膜梭菌θ毒素作为外源蛋白,以不表达外源蛋白的EGD-eΔactA/inlB为对照,检测两种蛋白在Pan4启动子控制下的表达水平。天青蛋白和θ毒素均为两种细菌毒素蛋白,且已在之前的研究中证明具有一定的抗肿瘤作用,是两种可用于减毒L.monocytogenes活载体递送的候选靶向治疗蛋白[23,24]。如图6所示,EGD-eΔactA/inlB-pERL3-Pan4-pfo胞内蛋白样本在55 kD左右有明显的条带,说明在Pan4启动子调控下θ蛋白可在胞内表达。EGD-eΔactA/inlBpERL3-Pan4-azu胞内蛋白样本在靠近17 kD左右有明显的条带,说明Pan4启动子可调控天青蛋白在EGD-eΔactA/inlB中表达。由此可见,筛选出的厌氧启动子Pan4调控外源蛋白表达的能力不仅局限于一种蛋白,具有一定的广泛适用性。

图6 重组菌株EGD-eΔactA/inlB-pERL3-Pan4-pfo和EGD-eΔactA/inlB-pERL3-Pan4-azu外源蛋白表达鉴定图
3 结论
本文通过对在厌氧和有氧环境下培养的L.monocytogenes总RNA进行转录组测序分析,利用绿色荧光蛋白作为报告系统,从中筛选出在厌氧条件下表达水平有显著性增加的启动子Pan4、Pan10、Pan12和Pan14。其中Pan4启动子调控下的绿色荧光蛋白表达水平最高。之后以天青蛋白和产气荚膜梭菌θ毒素为外源蛋白,评估了该启动子在不同外源蛋白表达调控中的作用。我们发现Pan4启动子可以成功启动天青蛋白和产气荚膜梭菌θ毒素在EGD-e ΔactA/inlB中表达,这说明在厌氧环境下Pan4启动子可调控EGD-eΔactA/inlB表达不同的外源蛋白,具有一定的广泛适用性,可促进减毒L.monocytogenes活载体在肿瘤药物或疫苗载体方面的应用研发。虽然Pan4启动子是个有潜力的L.monocytogenes厌氧启动子,但仅有一个启动子还不足以完善减毒L.monocytogenes肿瘤药物或疫苗活载体的外源蛋白表达系统,因此基于Pan4启动子进行进一步人工改造是未来丰富L.monocytogenes厌氧启动子库的发展方向。
——一道江苏高考题的奥秘解读和拓展

