基于PSD-95/nNOS通路探讨7-NI改善青春期大鼠焦虑样行为
曹广文,张燕伟,陶梦超,魏鹏晟,郎文萱,李兴怡,金 戈,朱启文
0 引言
焦虑症是最常见的精神疾病,其发病率逐年上升[1]。焦虑症的发病年龄通常在儿童或青少年时期,病程通常是慢性复发[2]。动物研究表明,暴露于母婴分离(Maternal separation,MS)的后代大脑和行为发生了改变,包括引起焦虑症、抑郁症、社交攻击性增加[3-5]等。在断奶后和青春期前后的社会隔离会引发动物的行为改变和情感障碍,导致成年后动物出现焦虑样行为、攻击性增加和认知缺陷[6]。因此,研究治疗焦虑症的药物具有重要意义,尽管药物研发取得了显著进展,但许多焦虑症患者仍无法对现有的药物治疗产生足够的反应[7]。
一氧化氮合酶(Nitric oxide synthase,NOS)是一类含血红素的同工酶,在体内有3种类型的NOS同工酶,即神经元型一氧化氮合酶(Nerve nitric oxide synthase,nNOS)、诱导型一氧化氮合酶和内皮型一氧化氮合酶。在中枢神经系统中,nNOS位于突触后细胞膜内,并通过突触后密度95蛋白(Postsynaptic density-95,PSD-95)与N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)物理连接。在生理条件下,“突触” NMDAR的轻度激活使Ca2+大量涌入,Ca2+与钙调蛋白结合,导致nNOS催化激活,产生的一氧化氮发挥不同的细胞作用。NMDAR的过度激活可能导致异常的Ca2+流入突触后神经元,并通过三元NMDAR/PSD-95/nNOS复合物的形成而导致nNOS的过度激活,nNOS过量是诱发神经系统疾病的主要因素[8]。
本实验应用选择性nNOS抑制剂7-硝基吲哚(7-Nitroindazole,7-NI)干预青春期大鼠类焦虑样行为,并通过地佐环平(Dizocilpine,MK801)阻滞NMDARs,探讨7-NI治疗青春期大鼠类焦虑样行为的作用机制。
1 材料
1.1 实验动物 采用SPF级成年Sprague-Dawley大鼠雌雄各10只,体重(250±20)g,购自辽宁省沈阳市长生生物有限公司,生产许可证号:SCXK(辽)2015-0001,按照中华动物伦理学要求饲养和处理动物,购买后雌雄分笼饲养1周适应环境,之后按照随机原则一雌一雄合笼饲养,动物房温度:18~22 ℃,湿度:50%~60%,灯光照射时间为8∶00~20∶00,自由进食饮水,每日检查雌鼠情况,孕鼠单独饲养。
1.2 试剂 PSD-95抗体(Cell Signaling Technology公司,编号:sc32290);nNOS抗体(Affinity Biosciences公司,批号:1560366);一抗稀释液(上海雅酶生物医药科技有限公司,批号:20201115);BCA蛋白浓度测定试剂盒(增强型)(上海碧云天生物技术有限公司,批号:010719190418)
1.3 仪器及装置 多功能闭合式迷宫装置(沈阳医学院);旷场箱;悬尾架;酶标定量测试仪;-80 ℃低温冰箱;低温超速离心机(美国BECKMAN 公司);高通量匀浆机;垂直电泳仪(上海天能科技有限公司)。
2 方法
2.1 动物建模 将10只母鼠在同一时期产下的90只仔鼠按照雌雄各半、同窝对照的原则随机分为MS组和对照组,分娩当天命名为PND0(Postnatal day 0),MS组:从PND1至PND21,每天与母鼠连续分离6 h,分离前更换分离组子代大鼠笼垫料,检查子代大鼠身体状况[9-10]。PND21仔鼠断奶后,MS组大鼠在PND21~PND39[11]期间单独一个笼子孤养,对照组:正常饲养至实验前。
2.2 动物分组及给药 实验前将造模后健存的(因母鼠弃养而死亡4只)子代MS组大鼠进行再次筛选分组,共分为5组,每组12只:分别为模型组、7-NI 25 mg组、7-NI 50 mg组,MK801+7-NI 25 mg/kg组。同样,对照组仔鼠按照相同原则只保留12只作为实验对象。剩余仔鼠不参与本次实验。对照组和模型组均腹腔注射溶剂即1%的DMSO 25 mg/kg;7-NI 25 mg组和7-NI 50 mg组分别按照25 mg/kg和50 mg/kg注射7-NI;MK801+7-NI 25 mg/kg组先按照0.075 mg/kg注射MK801,15 min后注射25 mg的7-NI。注射时间均为每天行为学进行前1 h[12-14],实验流程如图1所示。
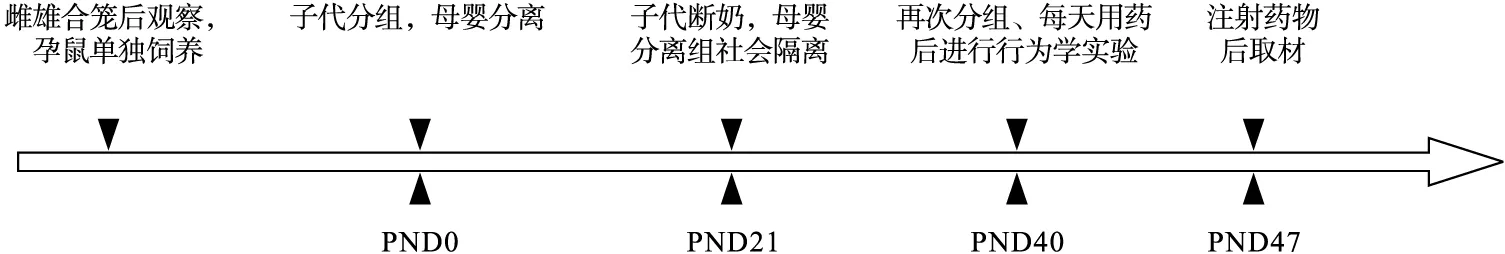
图1 实验流程
2.3 实验方法
2.3.1 旷场实验 将单只大鼠放入自发活动观察箱内(长50 cm,宽50 cm,高40 cm),箱体底部被分割成中央区和外周区。箱体正中央上方配备一个白炽灯。将单只大鼠从固定的一角面壁放入箱内,由两名观察者同时观察并记录大鼠在5 min内中央区所待的累计时间以及在中央区累计站立次数,评价大鼠的焦虑样行为[15]。
2.3.2 社会交往实验 社会交往场实验装置(长90 cm,宽90 cm,高50 cm),房间灯光设置为昏暗。每只大鼠前2天适应环境,第3天测试开始前,按性别分别将大鼠与另一陌生的伙伴随机配对。每对互不熟悉的大鼠被同时放入该实验装置内,连续5 min记录该测试大鼠在主动社会交往行为中所花费的总时间。
2.3.3 多功能闭合式迷宫实验 多功能闭合式迷宫(Multi-function closed maze,MCM)由直径200 cm、高80 cm的圆柱体和一个同等直径的圆形底盘组成。圆柱体被6个扇臂分为6个扇区,每个扇臂下方分别等间距分布1~4号4个门洞(高9 cm,宽11 cm,洞间距为10 cm),正上方安装有摄像装置记录数据[16-17]。
实验设计如图2,路径设计为A4-B1-C4-D1-E4(A4表示A臂的4号门),F臂所有门均为关闭状态。实验时将大鼠面壁放入底盘,每只大鼠在迷宫内自由探索10 min;软件定义起始扇区的中央区并分析大鼠在该中央区累计停留时间、探索频率,分析大鼠类焦虑样行为。Noldus EthoVision11.5X软件记录数据。
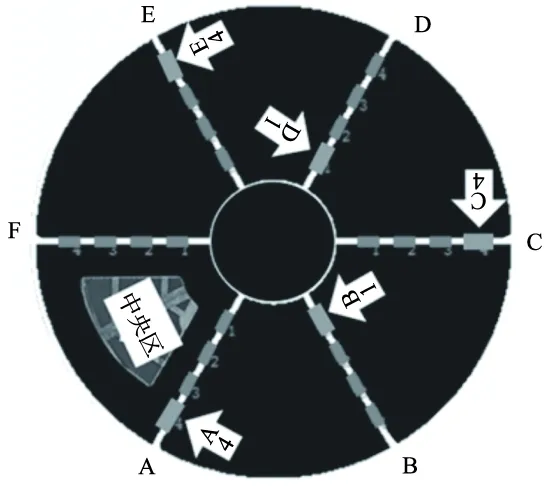
图2 MCM路径起始扇区的中央区
2.3.4 取材 给药1 h后按照30 mg/kg的剂量对大鼠腹腔注射3%戊巴比妥钠,麻醉后冰上取脑。
2.3.5 Western blot检测nNOS、PSD-95表达 海马组织经蛋白裂解液处理,取上清液,BSA法测定蛋白浓度。选用10% SDS-PAGE电泳分离蛋白,转膜及封闭后加入nNOS (1∶500)、PSD-95 (1∶500)、β-actin (1∶1 000) 4 ℃孵育过夜,二抗孵育2 h。加入ECL超敏发光液显色,以β-actin作为内参,用ImageJ图像分析软件进行分析。

3 结果
3.1 旷场实验结果 由图3A可见,与对照组相比,模型组和MK801+7-NI 25 mg/kg组大鼠在旷场中央区探索累计时间显著减少(P<0.05,P<0.01)。与模型组相比,7-NI 25 mg和7-NI 50 mg组探索累计时间显著增加(P<0.05)。
3.2 社会交往实验结果 由图3B可见,模型组和MK801+7-NI 25 mg/kg组大鼠社交攻击性显著增加(P<0.001),与模型组相比,7-NI 25 mg和7-NI 50 mg组大鼠社交攻击性显著减少(P<0.001)。
3.3 多功能闭合式迷宫实验测试结果 由图4可见,与对照组相比,模型组和MK801+7-NI 25 mg/kg组大鼠在MCM中起始扇区自定义的旷场中央区访问频数显著减少(P<0.05)、访问累计时间显著减少(P<0.05)。与模型组相比,7-NI 25 mg组和7-NI 50 mg组旷场中央区访问频数显著增加(P<0.05)、访问累计时间显著增加(P<0.05)。
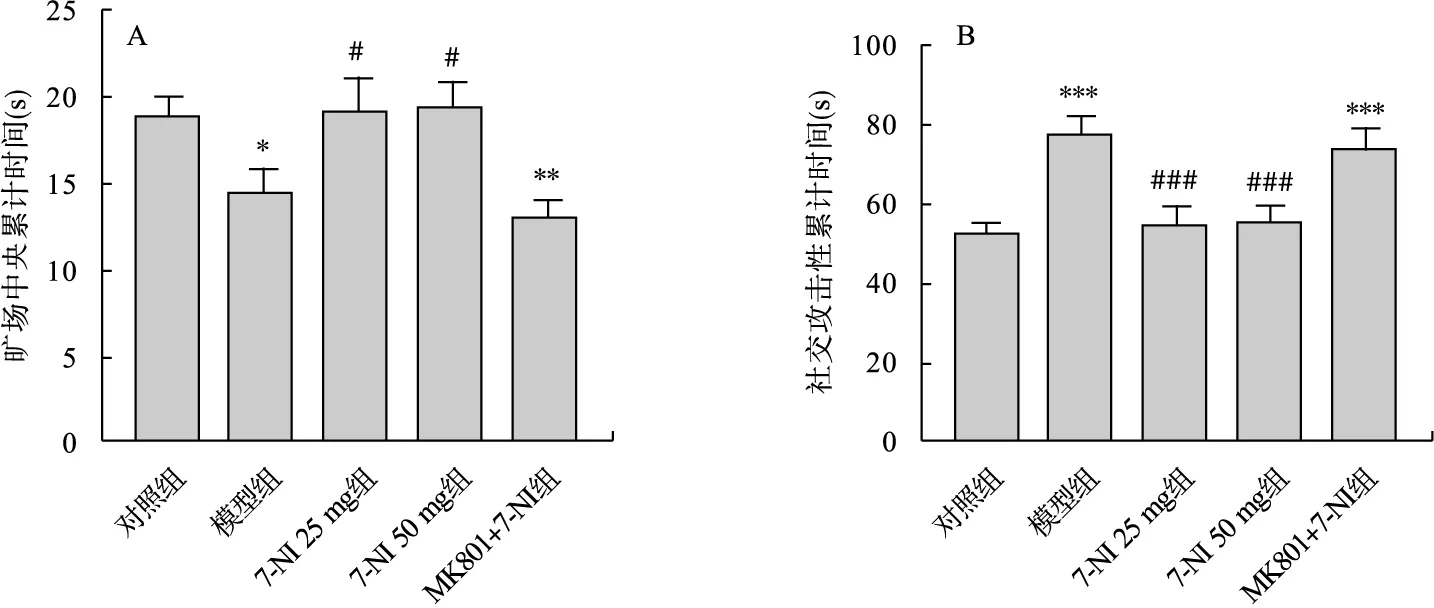
图3 旷场实验、社交实验结果
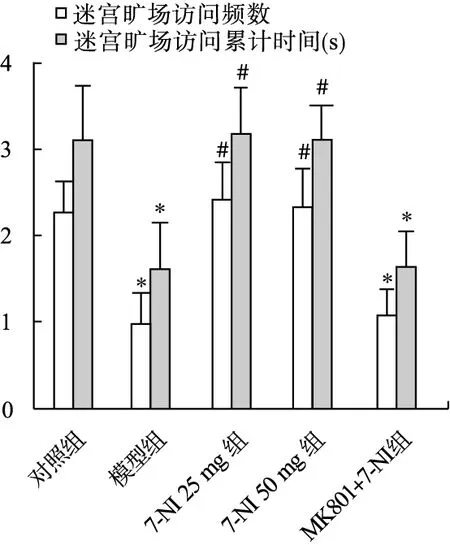
图4 多功能闭合式迷宫实验测试结果
3.4 Western blot结果 由图5可见,与对照组相比,模型组和MK801+7-NI 25 mg/kg组的PSD-95(P<0.01)及nNOS(P<0.05,P<0.01)表达均明显升高,与模型组相比,7-NI 25 mg组、7-NI 50 mg组大鼠海马区PSD-95(P<0.05)及nNOS蛋白(P<0.01,P<0.001)明显表达减少。
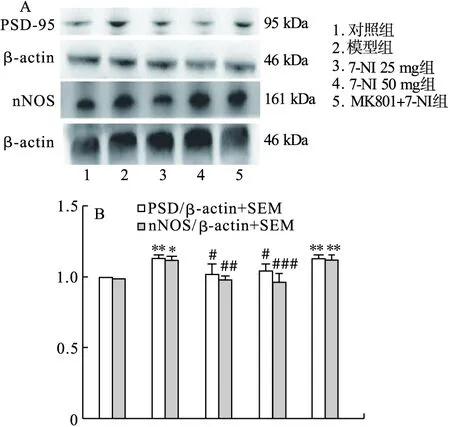
图5 Western blot结果
4 讨论
在儿童社会-情感成长理论中,父母教养行为被认为是儿童社会、情感、行为和认知发展的关键因素[18]。啮齿动物MS被普遍用来研究生命早期应激对个体发育过程中身心健康及学习记忆能力的影响[19]。断奶后实验动物的社会隔离会诱发许多行为和神经化学异常,例如抑郁和焦虑。因此,母婴分离和社会隔离动物模型适合研究神经精神症状的病理生理、探索治疗神经精神疾病的潜在药物[20]。
nNOS广泛表达于神经元,当机体面对压力时,nNOS与PSD-95结合形成nNOS-PSD-95复合蛋白。PSD-95是一种介导谷氨酸能突触可塑性、调解突触稳定性和树突棘发生的突触蛋白,参与调控多种神经精神类疾病,介导兴奋性毒性[21]。PSD-95与NMDAR相结合形成NAMDA-PSD-95-nNOS通路,研究表明,该通路功能障碍与多种神经精神疾病有关[22]。MK801是选择性最强的非竞争性NMDAR阻滞剂之一[23],可作为一种开放通道的阻滞剂,作用于NMDA受体操纵的离子通道。本研究结果表明,MS合并社会隔离导致青春期大鼠在旷场中央区访问时间减少,并增加了社交攻击性,其在多功能闭合式迷宫中央区访问频数和访问累计时间均减少,7-NI治疗增加了旷场中央区访问累计时间,显著降低了社交攻击性,增加了大鼠在迷宫中央区访问频数和访问累计时间,表明25 mg/kg 和50 mg/kg的7-NI均可改善青春期大鼠焦虑样行为,行为改变没有随着剂量增加而改变,这与已有报道一致:重复给予7-NI 大鼠不会导致脑 NOS 的累积抑制[24]。Western blot结果显示,模型组的PSD-95、nNOS表达较对照组增多,经过7-NI治疗降低了模型组nNOS蛋白和PSD-95蛋白的表达,表明大鼠先后经历了母婴分离合并社会隔离后大脑神经产生兴奋性毒性损伤,而7-NI可以通过降低神经兴奋性中毒改善焦虑样行为。同时,为了研究7-NI对神经突触的影响是否具有NMDAR依赖性,在MK-801+7-NI处理组中,用MK801预处理后再给予7-NI(25 mg/kg)没有改善焦虑样行为,这表明7-NI治疗焦虑样行为作用是依赖NMDAR的。
综上所述,7-NI改善了青春期大鼠焦虑样行为,该治疗作用可能与PSD-95/nNOS耦联降低神经兴奋性中毒有关。

