微小RNA-302c在高糖下对人肾小球系膜细胞的影响
朱艳,胡宇梦,刘释文,江芳芳,盛霞,余爱清,王群,刘玉婷,秦淑兰,
(1.中山大学附属南昌医院内分泌科,南昌330008;2.南方医科大学第五附属医院内分泌科,广州510900;3.大连海事大学,大连116026)
糖尿病肾病(Diabetic Nephropathy,DN)是世界上慢性肾脏病的主要病因[1],也是我国患者血液透析的第二大原因,对糖尿病死亡率有显著影响[2]。细胞外基质转换受金属蛋白酶(MMPs)和金属蛋白酶组织抑制剂(TIMPs)活性的调节。金属蛋白酶组织抑制因子-3(tissue inhibitors of metallo proteinase-3,TIMP3)是肾脏中表达最高的TIMP,研究表明在糖尿病情况下,肾脏中TIMP3的表达显著减少,并与小鼠的炎症、肾纤维化和肾小球系膜细胞凋亡有关[3-5]。但目前高糖下调控TIMP3表达的确切机制尚不明确[6]。前期研究我们通过使用TargetScan靶基因预测软件,选择靶基因中富集参与调控细胞增殖和生长的mi RNAs对TIMP3进行预测,结果发现miR-302c可能调控TIMP3的表达。因此,本研究中我们将进一步探讨高糖环境下mi R-302c是否调控人肾小球系膜细胞TIPM3的表达及其对人肾小球系膜细胞生存的影响。
1 材料与方法
1.1 主要材料及设备 人肾小球系膜细胞(HRMCs)(购自ScienCell公司);MCM全套培养基(ScienCell),0.25%Trypsin-EDTA(Gibco),葡萄糖(Sigma),Trizol(Invitrogen),Recombinant DNase I(RNase-free,TaKaRa),Reverse transcriptase MMLV(RNase H),RNase Inhibitor(TaKaRa),SYBR Green Supermix(Bio-RAD),SYBR green(Invitrogen公 司),NanoDrop 2000光 谱 仪 (Thermo Fisher Scientific,Waltham,MA),倒置显微镜(日本Nikon TS100),细胞培养箱 (Thermo),无菌操作台(LABGARD CLASSⅡ),PCR仪(ABI 9700),实时荧光定量基因检测系统(Roche 480)。
1.2 方法
1.2.1 荧光素酶报告实验 为了验证TIMP3是否为mi R-302c的直接靶基因,我们构建了荧光素酶报告基因pmiR-TIMP3-WT(H13064)和pmiRTIMP3-MUT(H13065),进行了荧光素酶报告实验。
1.2.2 细胞培养 取人肾系膜细胞3×106个/mL,在MCM培养基中培养,置于37℃,5%CO2的培养箱中。细胞每4天传代一次,传代至第9代。然后使用正常葡萄糖(5 mM D-glucose)或高葡萄糖(30 mM D-glucose)培养细胞48 h、72 h和96 h。
1.2.3 采用qRT-PCR检测miR-302c和TIMP3 mRNA的表达 正常或高糖下培养细胞,48 h后,使用Trizol试剂提取细胞总RNA。使用NanoDrop 2000光谱仪测定RNA的数量和质量,采用SYBR green定量检测miR-302c和TIMP3 mRNA的表达。
1.2.4 细胞计数 细胞培养48 h、72 h、96 h后,将细胞悬液转移至1.5 mL离心管,取10μL悬液置于新的1.5 mL离心管中,加入10μL台盼蓝染液,使用血球计数板,在显微镜下计算活细胞的数目。
1.2.5 采用qRT-PCR检测IL-6和IL-8 mRNA的表达 在正常和高糖条件下分别培养人肾小球系膜细胞,48 h后,提取细胞总RNA,使用qRT-PCR法检测IL-6和IL-8 mRNA的表达。
2 结果
2.1 TIMP3是miR-302c的直接靶基因 荧光素酶报告实验结果显示,miR-302c能特异性地与TIMP-3-3’UTR结合,抑制其荧光素酶活性,验证了TIMP-3是miR-302c的直接靶基因(图1)。
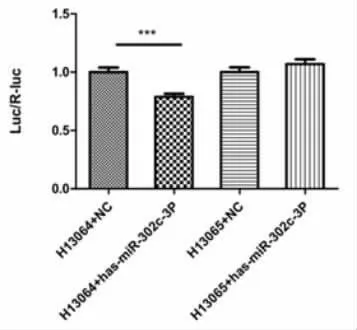
图1 荧光素酶报告实验:miR-302c能特异性地与TIMP-3-3’UTR结合,抑制其荧光素酶活性,验证了TIMP-3是miR-302c的直接靶基因(***P<0.001 vs对照组)。
2.2 高糖培养下人肾小球系膜细胞miR-302c及TIMP3 mRNA的表达 分别以正常糖(NG,5mM D-glucose)与高糖(HG,30mM D-glucose)培养人肾小球系膜细胞,发现与正常糖培养的细胞相比较,高糖培养48 h后,miR-302c表达显著性升高,其靶基因TIMP-3 mRNA表达显著性降低 (P<0.01)(图2)。
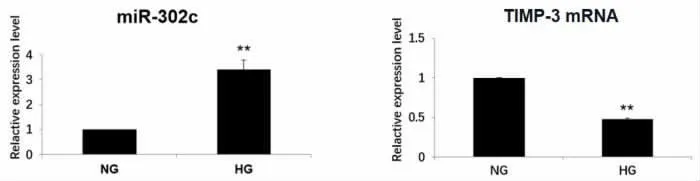
图2 人肾小球系膜细胞在不同糖浓度培养48 h后的miR-302c以及TIMP-3 mRNA表达(NG:正常糖HG:高糖;**P<0.01 vs NG)。
2.3 高糖对人肾小球系膜细胞存活的影响 为了探究高糖处理对人肾小球系膜细胞存活的影响,本研究分别用正常糖组(5 mM D-glucose)和高糖组(30 mM D-glucose)处理细胞,培养42 h、72 h以及96 h后,采用细胞计数法测定细胞数量,结果如图3所示,与正常糖组相比,高糖处理组细胞存活率显著性降低(P<0.05)。
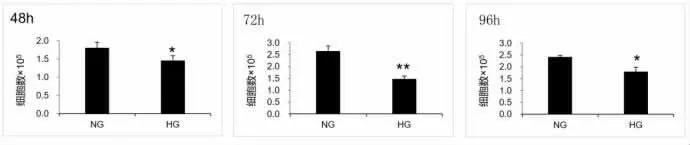
图3 与正常糖培养相比较,30 mMGlu(+)高糖培养后,人肾小球系膜细胞数显著性减少。(NG:正常糖HG:高糖;*P<0.05 VS NG**P<0.01 VS NG)。
2.4 高糖培养下人肾小球系膜细胞的炎症因子表达 采用qRT-PCR技术测定高糖培养下人肾小球系膜细胞IL-6和IL-8 mRNA的表达,结果如图4所示,与正常糖组相比,高糖处理组的肾小球系膜的IL-6 mRNA(P<0.05)和IL-8 mRNA(P<0.05)表达水平显著性升高。
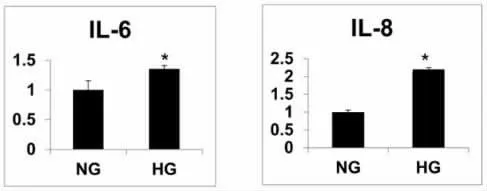
图4 与正常糖培养相比较,30 mMGlu(+)高糖培养后,人肾小球系膜细胞的炎症因子IL-6以及IL-8表达显著性升高。(NG:正常糖HG:高糖;*P<0.05 VS NG)。
3 讨论
DN是最常见的糖尿病慢性微血管并发症之一,约占慢性肾衰竭病因的45%[7]。截止目前,各种干预措施仅部分有效,不能阻断肾病进展[8]。因此,进一步探讨糖尿病肾病的发病机制,寻找预防和治疗DN的有效方法对于我国健康卫生事业发展具有深远而重大的指导意义。
MMPs和TIMPs的平衡决定了系膜细胞外基质的完整性。在糖尿病情况下,肾脏中TIMP3的表达显著性降低,并促使肾小球系膜细胞凋亡。例如,Lai等[9]研究显示在印第安糖尿病肾病患者中TIMP3表达下调,通过抑制TGF-β/Smad信号通路促使患者系膜细胞凋亡及足突细胞损失。Fiorentino等[5]研究报道糖尿病肾病患者肾活检结果证实TIMP3表达显著下降,其可通过FoxO1/STAT1信号途径导致患者系膜细胞凋亡、肾脏组织基底膜增厚、系膜扩张及蛋白尿增加。Basu等[10]报道TIMP3表达下调将促使系膜细胞凋亡,使得糖尿病肾病恶化。Menghini等[11]的研究发现TIMP3可通过抑制NH2-terminal和P38激酶活化,减轻细胞氧化应激及抑制TNF-α释放,从而抑制细胞的凋亡。上述研究结果提示TIMP3是一个多功能因子,TIMP3表达下调可以从多方面参与糖尿病肾脏的病理变化过程,然而调控TIMP3表达的因素尚未阐明。
miRNAs是一类高度保守的非编码小RNA分子,能与靶基因3’非编码区特异性结合,在转录后水平调控基因的表达,从而导致靶mRNA降解和翻译阻遏[12]。既往有研究显示TIMP3的表达水平受miRNA调控。MiR-770-5p通过靶向调控TIMP3促进糖尿病肾病足细胞凋亡和炎症反应[13];miR-21的下调通过靶向上调TIMP3,抑制炎症反应以及足细胞的凋亡[14];在糖尿病肾病系膜细胞中,TIMP3与miR-181b表达呈负调控关系[15]。 前期研究中我们通过TargetScan7.2靶基因预测软件发现miR-302c与TIMP3的表达可能相关。
miR-302属于miR-302/367家族,人源miR-302/367位于4号染色体q25区,包括miR-302a/b/c/d和miR-367等成员[16]。许多研究报道miR-302在肿瘤生长、肺纤维化及干细胞蛋白表达等各类生物学行为中发挥着重要作用[17-18],此外,部分学者证实miR-302与糖尿病肾病具有一定的相关性,Faherty等[19]发现miR-302的表达增加,可靶向TGFβ-II型受体,与肾病细胞表型密切相关,Chengjie等[20]报道miR-302b过度表达可抑制高糖诱导的上皮-间充质转化过程,在DN的发生发展中起到保护作用。De等[21]发现mi R-302可通过调节SNAI1的表达,调控系膜细胞的可塑性。本研究中我们进行了双荧光素酶报告分析,结果表明,TIMP3是miR-302c的直接靶基因,miR-302c水平与TIPM3的表达呈负反馈调控。因此,我们认为miR-302c可能通过对TIMP3的调控影响系膜细胞的生物活性,与糖尿病肾病发生发展相关。
本研究观察到在高糖环境下,系膜细胞miR-302c表达增加,TIMP3的表达水平下降,同时人系膜细胞存活率下降。众所周知,系膜细胞凋亡与细胞炎症机制激活密切相关[22],并涉及JAK/STAT,NF-κB以及Nrf-2等多种信号通路[23-26]。炎症介质的生成也受mi RNA调控,研究发现miRNA-302e可通过抑制NF-κB信号通路活化在过敏性疾病中发挥抗炎作用[27],并可通过RelA/BRD4/NF-κB信号途径减轻小儿肺炎的炎症反应[28]。mi R-302d抑制剂可通过抑制软骨细胞IκBα和p65的磷酸化,从而减轻软骨细胞的炎症反应,减少软骨细胞的凋亡[29]。mi R-302c可调节人体CD4+CD45RO+T淋巴细胞中IL-21的表达[30]。在胃癌细胞中,mi RNA-302c可调控炎症因子IL-8的表达[31]。此外,TIMP3作为炎症中的关键介质,可调控促炎症通路的关键酶的表达[32]。研究发现TIMP3是肿瘤坏死因子转化酶(TACE)的唯一生理抑制剂,它的缺失增强TNF-α信号途径进而引起肾小管间质损伤[33]。TIMP3过表达可显著抑制高糖处理的足细胞IL-1β和TNF-α的释放,改善细胞的炎症状态及凋亡[13,34]。在本研究中,我们进一步检测了炎症因子的表达水平,结果发现高糖环境下,系膜细胞存活率下降的同时,细胞的IL-6以及IL-8 mRNA的表达显著性增加。
综上所述,本研究首次报道了miR-302c可靶向负调控TIMP3的表达,并发现在高糖环境下人肾小球系膜细胞的mi R-302c表达上调、TIMP3 mRNA表达下调、细胞存活率降低,同时系膜细胞的炎症因子表达增高。本研究可为阐明miR-302c在DN发病中的作用及为临床治疗DN提供一定的理论依据。当然,我们研究仍存在不足之处,未进一步探讨在高糖环境中过表达或抑制miR-302c之后人肾小球系膜细胞TIMP3 mRNA的表达水平,以及细胞的存活率;未进一步阐述miR-302c靶向负调控TIMP3是通过哪些信号通路作用于系膜细胞。

