具有钾离子和谷胱甘肽双重响应特性的树状大分子药物载体的制备与控释性能
张 璐,刘玉琼,巨晓洁,2,谢 锐,2,汪 伟,2,刘 壮,2,褚良银,2
(1.四川大学化学工程学院,四川 成都 610065;2. 四川大学高分子材料工程国家重点实验室,四川 成都 610065)
癌症严重影响了人们的生命健康和生活质量。肿瘤组织特殊的血管结构使得肿瘤具有高通透性和滞留效应(EPR 效应),因此纳米药物载体可以通过EPR 效应在肿瘤部位富集,有效实现药物在肿瘤部位的被动靶向[1,2]。近年来,为了进一步提高纳米药物载体的靶向控释效果,研究者们致力于环境刺激响应型纳米载体的研究[3]。根据环境刺激因素的种类,环境刺激响应型纳米载体可分为外源性刺激响应型和内源性刺激响应型2 类。常见的外源性刺激响应型纳米载体通过响应外源性环境刺激(如温度、光、磁场、超声和电场等)实现药物释放,但其通常作用于整个病变部位,释药行为在胞内和胞外可能同时发生,控释不够精准,降低了药物的生物利用度[4,5]。内源性刺激响应型纳米载体能够基于人体固有的生理环境不同(如pH、还原性物质和酶浓度等)来实现药物释放,能更加精准地在病变部位甚至细胞内部释药[6,7]。靶向细胞内精准的释药方式可以进一步提高药物的生物利用度,减少给药量且降低药物的毒副作用。因此,设计制备能靶向细胞内部控释给药的纳米药物载体对于疾病精准治疗具有重要意义。
生物体细胞内外的钾离子(K+)浓度存在显著差异,细胞内液K+浓度大约是细胞外液K+浓度的30 倍[8]。此外,肿瘤细胞的细胞质和细胞核中存在高浓度的还原性谷胱甘肽(GSH),其浓度明显高于正常细胞内GSH 浓度[9]。因此,基于细胞内外K+浓度差异和肿瘤细胞高GSH 浓度,设计构建具有K+和GSH 双重响应特性的纳米药物载体有望实现药物在肿瘤细胞内部的精准控制释放。
因此,本文制备了一种具有K+和GSH 双重响应性的多功能树状大分子作为抗癌药物载体。一方面,将具有K+响应性的聚(N-异丙基丙烯酰胺-共聚-苯并-18-冠-6-丙烯酰胺)(PNB)线型高分子和具有GSH 敏感性的二硫键(-ss-)先后引入聚酰胺-胺型树状大分子(PAMAM)表面;另一方面,将末端带有叶酸(FA)的聚乙二醇(PEG)线型高分子引入树状大分子的最外层。如Fig.1 所示,载药PAMAM-g-PNB-ss-PEG-FA 树状大分子经静脉注射进入体内后,首先,最外层的亲水性PEG 链可以延长其血液循环时间,有利于其通过EPR 效应在肿瘤部位被动富集;并且,在体内递送过程中,PNB 高分子处于收缩状态,保护内载药物不被释放[10]。然后,基于FA与肿瘤细胞表面叶酸受体(FR)之间的特异性识别作用,载药树状大分子会主动靶向于肿瘤部位[11],经FR 介导的内吞作用进入肿瘤细胞后,在细胞质中高浓度的GSH 刺激下,二硫键-ss-发生断裂,裸露出来的PNB 高分子特异性地识别细胞质中高浓度的K+,分子构象由收缩状态变为伸展状态,释放出包载的抗癌药物。这种同时具有K+和GSH 响应性的多功能树状大分子为实现癌症的精准有效治疗提供了一种新材料。
1 实验部分
1.1 试剂与仪器
G4.0 PAMAM 树状大分子:威海晨源分子新材料有限公司;N-异丙基丙烯酰胺(NIPAM):日本Kohjin, Co., Ltd;4-硝基苯并-18-冠-6,TCI;2,2’-二硫二吡啶(Py-S-S-Py):上海弘邦医药有限公司;叶酸-聚乙二醇-巯基(FA-PEG-SH):上海芃硕生物科技有限公司;阿霉素(DOX):湖北康明德医药化工有限公司;GSH:TCI。实验所用其它试剂均为分析纯。实验用水:来自Milli-Q 纯水系统,电阻率为18.2 MΩ·cm。
纳米粒度分析仪:ZEN 3690,英国Malvern;核磁共振氢谱仪(1H-NMR):Varian-400,美国Varian;紫外-可见光分光光度计(UV-vis):UV-1700,日本Shimadzu;傅里叶变换红外光谱仪(FT-IR):IR Prestige-21,日本Shimadzu;酶标仪:SAF-680T,上海巴玖实业有限公司;流式细胞仪:CytoFLEx,美国Beckman Coulter;激光共聚焦显微镜(CLSM):SP5,德国Leica;扫描电子显微镜(SEM):JSM-IT800,美国Thermo Fisher。
1.2 PAMAM-g-PNB-ss-PEG-FA 树状大分子的制备
1.2.1 带有羧基末端的PNB 线型高分子的制备:如Fig.2(a)所示,采用可逆加成断裂自由基聚合法(RAFT)合成末端带羧基的PNB 线型高分子。其中,三硫代碳酸酯(DMP)作为链转移剂,偶氮二异丁腈(AIBN)作为引发剂,B18C6Am 参照文献中的方法由4-硝基苯并-18-冠-6 合成[12]。反应溶剂为四氢呋喃,NIPAM 和B18C6Am 作为单体,总单体浓度为0.3 mol/L,(NIPAM+B18C6Am),DMP 和AIBN 的摩尔比为150 : 1 : 0.2,理论上B18C6Am 占总单体(NIPAM+B18C6Am)的摩尔分数为15%。聚合反应在70 ℃进行24 h,产物用无水乙醚进行沉淀纯化,最后在40 ℃真空干燥24 h。
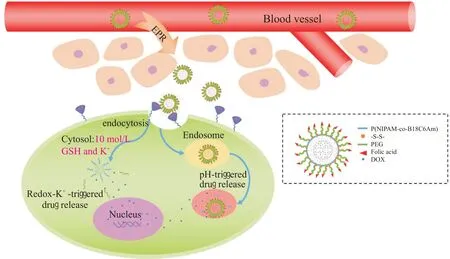
Fig. 1 Schematic diagram of targeted delivery and controlled release administration of PAMAM-g-PNB-ss-PEG-FA dendrimers in vivo
1.2.2 PAMAM-g-PNB 树状大分子的合成:如Fig.2(b)所示,以1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC)为催化剂、N-羟基琥珀酸亚胺(NHS)为羧基活化剂,通过酰胺缩合反应将PNB 线型高分子接枝到PAMAM 树状大分子表面,制备PAMAM-g-PNB树状大分子。反应以水为溶剂,在20 ℃反应48 h,最后用透析法纯化,冷冻干燥后得到产物。
1.2.3 PAMAM-g-PNB-ss-PEG-FA 树状大分子的合成:如Fig.2(c)所示,以正己胺为还原剂,在三丁基膦保护下对PAMAM-g-PNB 进行还原,溶剂为四氢呋喃,25 ℃反应2 h 得到末端带巯基的PAMAM-g-PNB-SH;然后与二硫吡啶进行交换反应得到末端带二硫键的PAMAM-g-PNB-ss-Py,反应溶剂为甲醇,25 ℃反应24 h;最后与FA-PEG-SH 高分子发生交换反应制备得到PAMAM-g-PNB-ss-PEG-FA 树状大分子,反应溶剂为二甲亚砜,在25 ℃避光反应24 h,最后用透析法纯化,冷冻干燥后得到最终产物。
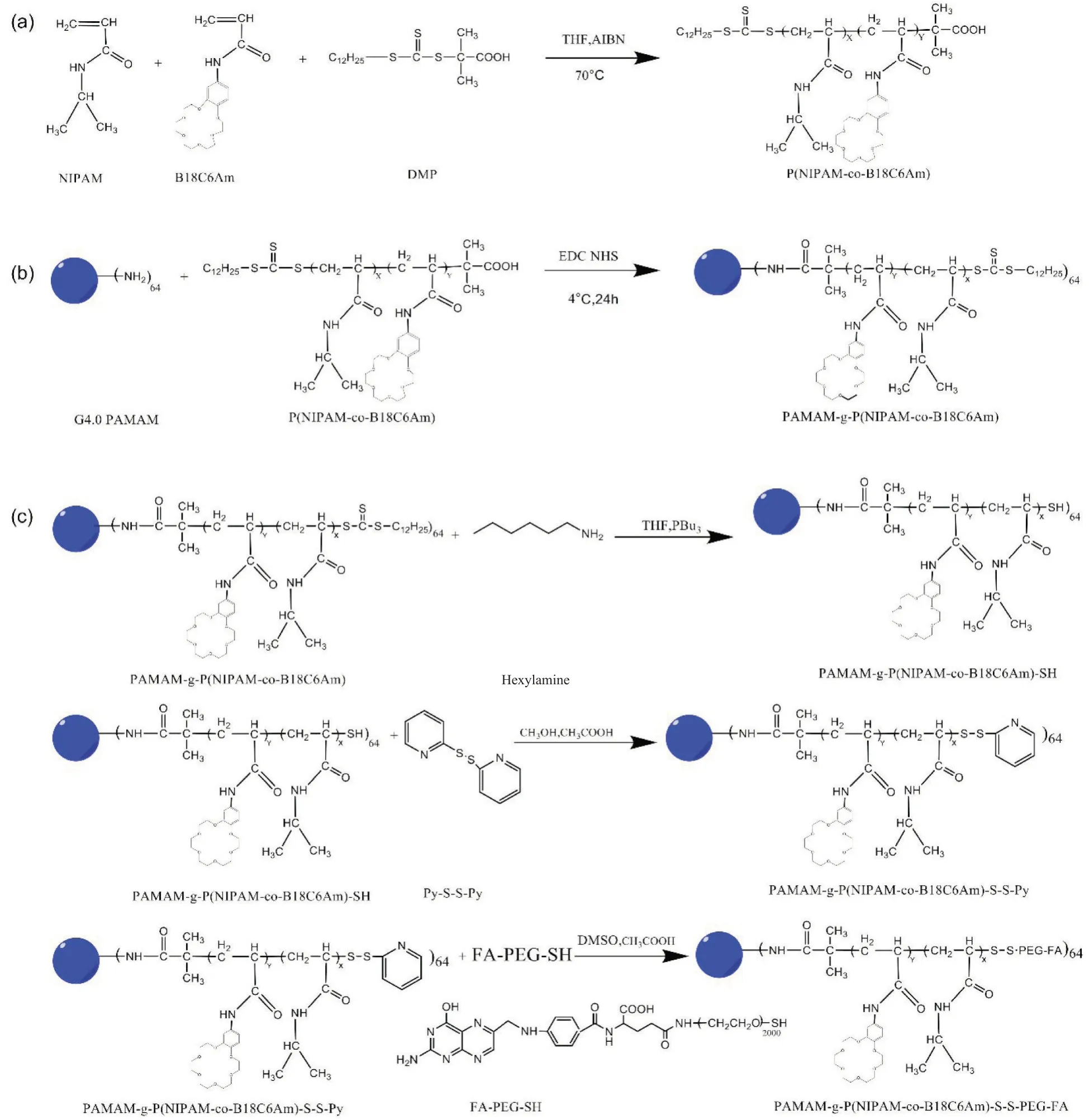
Fig. 2 Synthesis route of the PNB linear polymer(a), PAMAM-g-PNB (b) and PAMAM-g-PNB-ss-PEG-FA(c) dendrimers
实验中为了进行对比,用类似合成方法制备了不含18-冠-6 基团的PAMAM-g-PNIPAM 树状大分子。
1.3 PAMAM-g-PNB-ss-PEG-FA 树状大分子的成分和形貌表征
利用FT-IR,1H-NMR 对合成的PNB 线型高分子,以及PAMAM-g-PNB,PAMAM-g-PNB-ss-PEG-FA树状大分子的化学成分进行表征,并根据1H-NMR谱计算出PNB 高分子中B18C6Am 的实际含量。
用SEM 对制备得到的PAMAM-g-PNB-ss-PEGFA 树状大分子的形貌进行表征。
1.4 PAMAM-g-PNB-ss-PEG-FA 树状大分子的K+响应特性表征
以KCl 和NaCl 配制细胞内外液模拟液。其中,细胞内液模拟液中K+浓度为150 mmol/L、Na+浓度为5 mmol/L,细胞外液模拟液中K+浓度为5 mmol/L、Na+浓度为150 mmol/L[8]。
首先,将PNB 线型高分子以5 mg/mL 的浓度分别溶解于去离子水、细胞内液模拟液和细胞外液模拟液中,测定其温度响应特性。利用配有温度控制单元的UV-vis 测定高分子溶液在不同温度、500 nm波长下的透射率,每个温度点恒温10 min,绘制出高分子溶液的透射率随温度变化的关系曲线。线型高分子的相变温度(LCST)值为溶液透射率降低到其初始透射率50%时的温度[1,2]。然后,采用相同的方法,测定PAMAM-g-PNB 和PAMAM-g-PNB-ss-PEG-FA 树状大分子在去离子水、细胞内液模拟液和细胞外液模拟液中的温度响应特性,评价其相应LCST 变化。
1.5 PAMAM-g-PNB-ss-PEG-FA 树状大分子的还原响应特性表征
以pH=7.4 的PBS 缓冲液配制了不同浓度的GSH 溶液来模拟细胞内液和细胞外液。其中,细胞内液模拟液中GSH 浓度为10μmol/L,细胞外液模拟液中GSH 浓度为10 mmol/L。称取一定量的树状大分子,以0.25 mg/mL 的浓度分别溶解于PBS 缓冲液、细胞内液模拟液和细胞外液模拟液中,然后将各溶液转移至温度37 ℃的恒温摇床中,分别于0 min,15 min,30 min,45 min,60 min 时利用纳米粒度仪测定树状大分子在不同溶液中水合半径的变化。
1.6 PAMAM-g-PNB-ss-PEG-FA 树状大分子的体外药物释放研究
PAMAM 可通过疏水作用包载疏水性药物。本实验使用DOX 作为模型药物,制备载药的PAMAMg-PNB-ss-PEG-FA 树状大分子,简写为PSSPFA@DOX。 作为对照,还制备了负载DOX 的PAMAM-g- PNIPAM 树 状 大 分 子( 简 写 为PNA@DOX)和负载DOX 的PAMAM-g-PNB 树状大分子(简写为PNBA@DOX)。
分别在不同的细胞内外液模拟液中利用UV-vis测定了PSSP-FA@DOX 的药物释放曲线,考察PSSPFA@DOX 的K+和GSH 响应性药物释放行为。
1.7 PAMAM-g-PNB-ss-PEG-FA 树状大分子的细胞毒性考察与其细胞内释放表征
采用CCK-8 法,利用酶联免疫检测仪对PAMAM,PAMAM-g-PNIPAM,PAMAM-g-PNB 和PAMAM-g-PNB-ss-PEG-FA 4 种空白载体材料进行安全性评价,对PSSP-FA@DOX 的细胞毒性进行评价。
DOX 能够在一定波长下产生荧光,利用CLSM定性观察了载药树状大分子进入细胞后,在细胞内的分布情况。同时用Hochest 33342 染色标记细胞核,通过观察细胞内的荧光情况表征药物在细胞内的释放行为。
2 结果与讨论
2.1 PAMAM-g-PNB-ss-PEG-FA 树状大分子的成分和形貌分析
PAMAM 树状大分子,以及合成得到的PNB 线型高分子、PAMAM-g-PNB 和PAMAM-g-PNB-ss-PEG-FA 树状大分子的FT-IR 表征如Fig.3(a)所示。PAMAM 的FT-IR 谱 图 中,3276 cm-1处 为 酰 胺 基 上—NH—的伸缩振动吸收峰,2945 cm-1和2850 cm-1处为—CH2—的伸缩振动吸收峰,1659 cm-1和1559 cm-1处为酰胺I 带和II 带的吸收峰。PNB 的FT-IR 谱图中,1388 cm-1和1367 cm-1处出现了NIPAM 异丙基中甲基的对称弯曲振动吸收峰,1650 cm-1处是NIPAM 酰胺羰基的伸缩振动峰;同时,1502 cm-1附近出现了B18C6Am 苯环的C=C 骨架伸缩振动吸收峰,在1134 cm-1处出现了Ar—O—C 的C—O 不对称伸缩振动吸收峰,这些特征峰说明成功制备得到了PNB 线型高分子。PAMAM-g-PNB 的FT-IR 谱图中同时出现了PAMAM 与PNB 的特征峰,且与PAMAM 对比,3480 cm-1附近的氨基特征峰减弱,这是因为PNB 末端羟基与PAMAM 末端的氨基发生酰胺缩合,也进一步证明了PNB 成功接枝到PAMAM 上。PAMAM-g-PNBss-PEG-FA 的FT-IR 谱图中除了有PAMAM,PNB 的特征峰外,在1110 cm-1处的吸收峰为FA-PEG-SH 中C—O 的伸缩振动吸收峰,说明成功将PNB 和FAPEG-SH 依次接枝到PAMAM 上得到目标产物PAMAM-g-PNB-ss-PEG-FA。

Fig. 3 FT-TR spectra of PAMAM, PNB, PAMAM-g-PNB and PAMAM-g-PNB-ss-PEG-FA(a);1H-NMR spectrum of PAMAM-g-PNB-ss-PEG-FA(b)
利 用1H- NMR 对PNB,PAMAM-g- PNB 和PAMAM-g-PNB-ss-PEG-FA 树状大分子分别进行表征。PAMAM-g-PNB-ss-PEG-FA 的1H-NMR 图 谱 中 同时出现了NIPAM,B18C6Am,PAMAM 和FA-PEG-SH的特征峰(Fig.3(b)),同样证明了PNB 高分子和FAPEG-SH 高分子被成功接枝到PAMAM 树状大分子上。同时,根据PNB 线型高分子的1H-NMR 图谱可以计算出线型高分子中冠醚单元的实际含量为14.9%。
采用SEM 对PAMAM-g-PNB-ss-PEG-FA 树状大分子的形貌进行表征,结果如Fig.4 所示。可以看出,PAMAM-g-PNB-ss-PEG-FA 树状大分子的平均粒径在130 nm 左右,是一种表面具有类似“蘑菇状”褶皱结构的类球形颗粒。
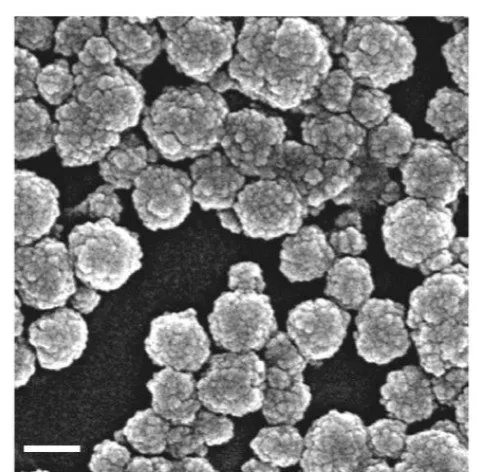
Fig. 4 SEM photo of PAMAM-g-PNB-ss-PEG-FA dendrimers(scale: 100 nm)
2.2 PAMAM-g-PNB-ss-PEG-FA 树状大分子的K+响应性
采用UV-vis 测定比较了PNB,PAMAM-g-PNB和PAMAM-g-PNB-ss-PEG-FA 在不同浓度K+溶液中的温度响应特性,比较其LCST 迁移行为,进而评价其K+响应特性,结果如Fig.5 所示。
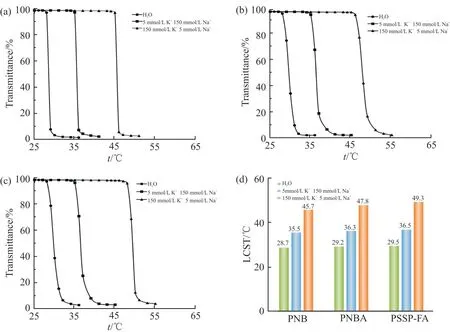
Fig. 5 Curves of light transmittance with temperature of aqueous solution, extracellular fluid simulation solution and intracellular fluid simulation solution containing PNB
可以看出,随着K+浓度从5 mmol/L 升高到150 mmol/L,3 种高分子的LCST 都相应升高,这是由于PNB 高分子中的B18C6Am 能够与溶液中的K+形成1:1 的主客体络合物,络合物间相互排斥使得高分子的亲水性增强,从而导致3 种高分子的LCST 均往高温迁移。虽然,在细胞内外液模拟液中还存在不同浓度的Na+,但由于Na+尺寸与B18C6Am 空腔不匹配,无法形成稳定的络合物,因此,Na+对高分子的LCST 不会产生影响。还可以看出,将PNB 接枝到PAMAM 树状大分子上后,高分子的K+响应性不受影响,但因为PAMAM 树状大分子具有亲水性,所以PAMAM-g-PNB 高分子受K+诱导的的LCST 迁移比PNB 高分子要大。同时,PEG 高分子链也具有亲水性,因此PAMAM-g-PNB-ss-PEG-FA 的LCST 迁移得更多。
另一方面,3 种高分子在细胞外液模拟液中的LCST 都低于37 ℃,而在细胞内液模拟液中的LCST都高于37 ℃。这意味着在体温37 ℃下,当PAMAM-g-PNB-ss-PEG-FA 所处环境从细胞外液变成细胞内液时,树状大分子中的PNB 链段将由疏水收缩状态变成亲水伸展状态,负载药物快速释放,如此可实现靶向细胞内药物控制释放。
2.3 PAMAM-g-PNB-ss-PEG-FA 树状大分子的GSH响应性
利用纳米粒度仪测定了PAMAM-g-PNB-ss-PEGFA 树状大分子在不同浓度GSH 溶液中(pH7.4)的粒径变化来考察其GSH 响应性。如Fig.6 所示,PAMAM-g-PNB-ss-PEG-FA 在GSH = 10μmol/L 的 细胞外液模拟液中,其粒径在60 min 内未发生明显变化;而在GSH = 10 mmol/L 的细胞内液模拟液中,PAMAM-g-PNB-ss-PEG-FA 的粒径明显变小,这是由于在高浓度GSH 下,PAMAM-g-PNB-ss-PEG-FA 结构中的二硫键发生断裂,PEG 从树状大分子上分离,导致其表面水化层减少,粒径减小。这意味着,在血液循环中,PAMAM-g-PNB-ss-PEG-FA 结构稳定,药物被很好地包封在树状大分子内;当PAMAM-g-PNB-ss-PEG-FA 被肿瘤细胞摄取后,在高浓度GSH 刺激下,二硫键断裂,树状大分子发生初步解离,协同后续K+响应性,最终实现靶向肿瘤细胞内的药物释放。
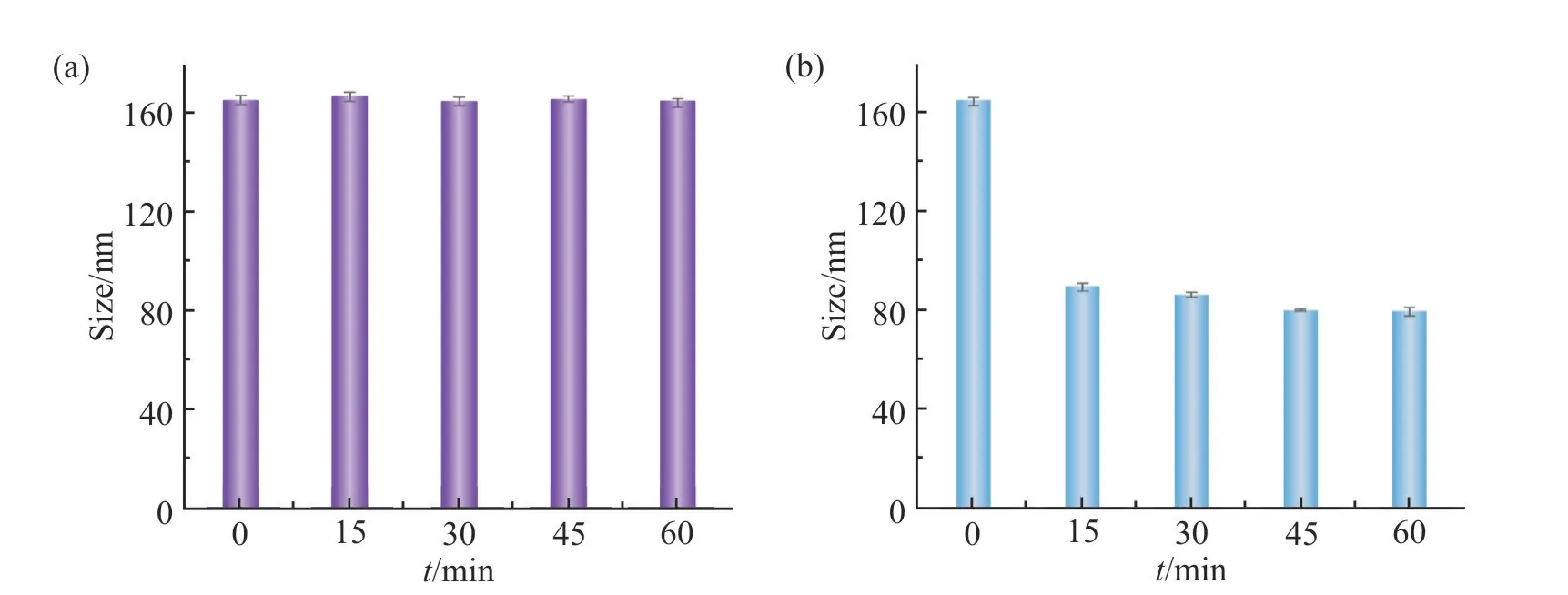
Fig. 6 Particle size of PAMAM-g-PNB-ss-PEG-FA at the GSH concentration of 10 μmol/L(a) and 10 mmol/L(b)
2.4 PAMAM-g-PNB-ss-PEG-FA 树状大分子的体外药物释放
Fig.7(a)是37 ℃下PSSP-FA@DOX 在含有不同浓度K+的细胞内外液模拟液中的药物释放曲线。可以看出,DOX 从树状大分子中的释放行为具有明显的K+响应性。在K+浓度为5 mmol/L 的细胞外液模拟液中,药物释放缓慢,96 h 时才基本达到平衡,累积释药率为30.1%。但在K+浓度为150 mmol/L 的细胞内液模拟液中,PSSP-FA@DOX 具有较快的释药速率,124 h 左右达到释放平衡,累积释药率为72.7%。实验结果验证了PAMAM-g-PNB-ss-PEG-FA树状大分子受K+诱导的药物控释性能。
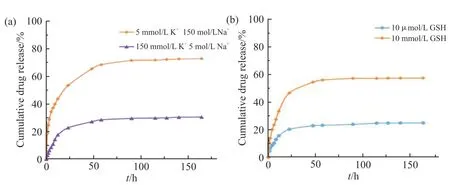
Fig.7 Drug release curves of PSSP- FA@DOX in low concentration potassium solution (5 mmol/L), in high concentration potassium solution (150 mmol/L) (a), and in low concentration GSH solution(10 μmol/L), in high concentration GSH solution (10 mmol/L)
Fig.7(b)是37 ℃下PSSP-FA@DOX 在不同浓度GSH 溶液中的药物释放行为。可以看出,在GSH 浓度为10μmol/L 的溶液中,DOX 从树状大分子中的释放比较缓慢,其累积释药率为24.4%。而在模拟细胞内的条件下(pH7.4,GSH = 10 mmol/L),DOX从树状大分子中的释放比较迅速,累积释药率达到57.6%。实验结果同样验证了PAMAM-g-PNB-ss-PEG-FA 树状大分子受GSH 刺激的药物控释性能。
以上结果说明,PSSP-FA@DOX 能够在正常的血液循环系统中保持稳定,药物释放较少;而当PSSP-FA@DOX 通过被动及主动靶向作用到达肿瘤部位并进入肿瘤细胞内部后,能够在细胞内的高K+、高GSH 环境刺激下,快速释放药物,发挥其抗肿瘤作用。
2.5 PAMAM-g-PNB-ss-PEG-FA 树状大分子的生物相容性
通过CCK-8 实验,采用2 种肿瘤细胞(HeLa 和4T1)和1 种正常细胞(L929)来考察PNB 线型高分子,以及PAMAM,PAMAM-g-PNIPAM,PAMAM-g-PNB-ss-PEG-FA 这3 种空白树状大分子的细胞毒性,结果如Fig.8 所示。
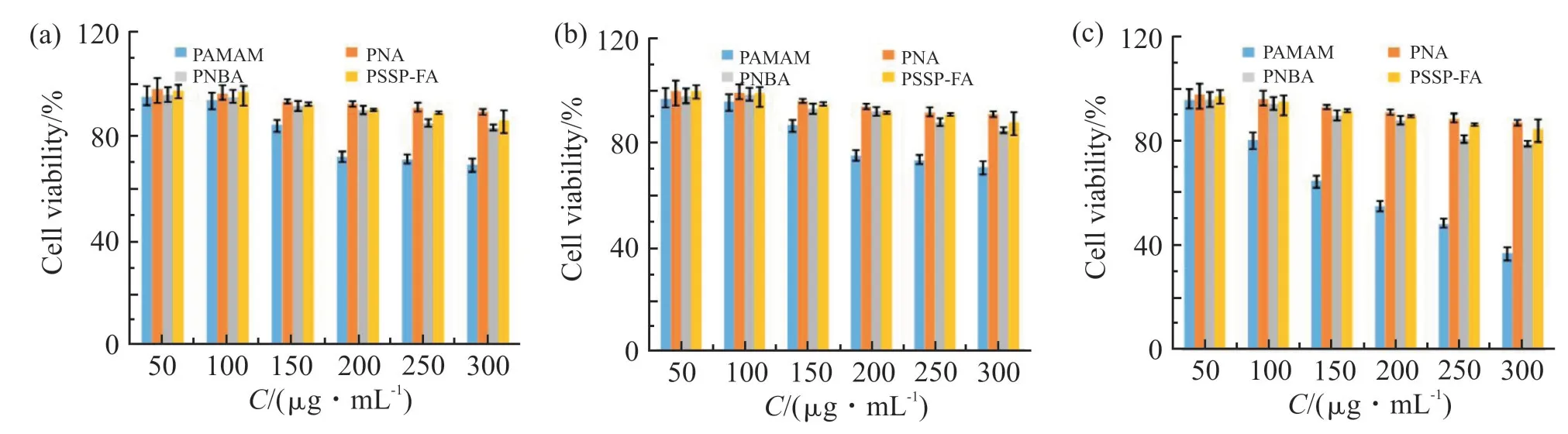
Fig. 8 Cytotoxicity of PNB, PAMAM, PAMAM-g-PNIPAM, PAMAM-g-PNB-ss-PEG-FA in different concentrations after incubation with HeLa cells (a), 4T1 cells (b) and L929 cells (c) for 48 h
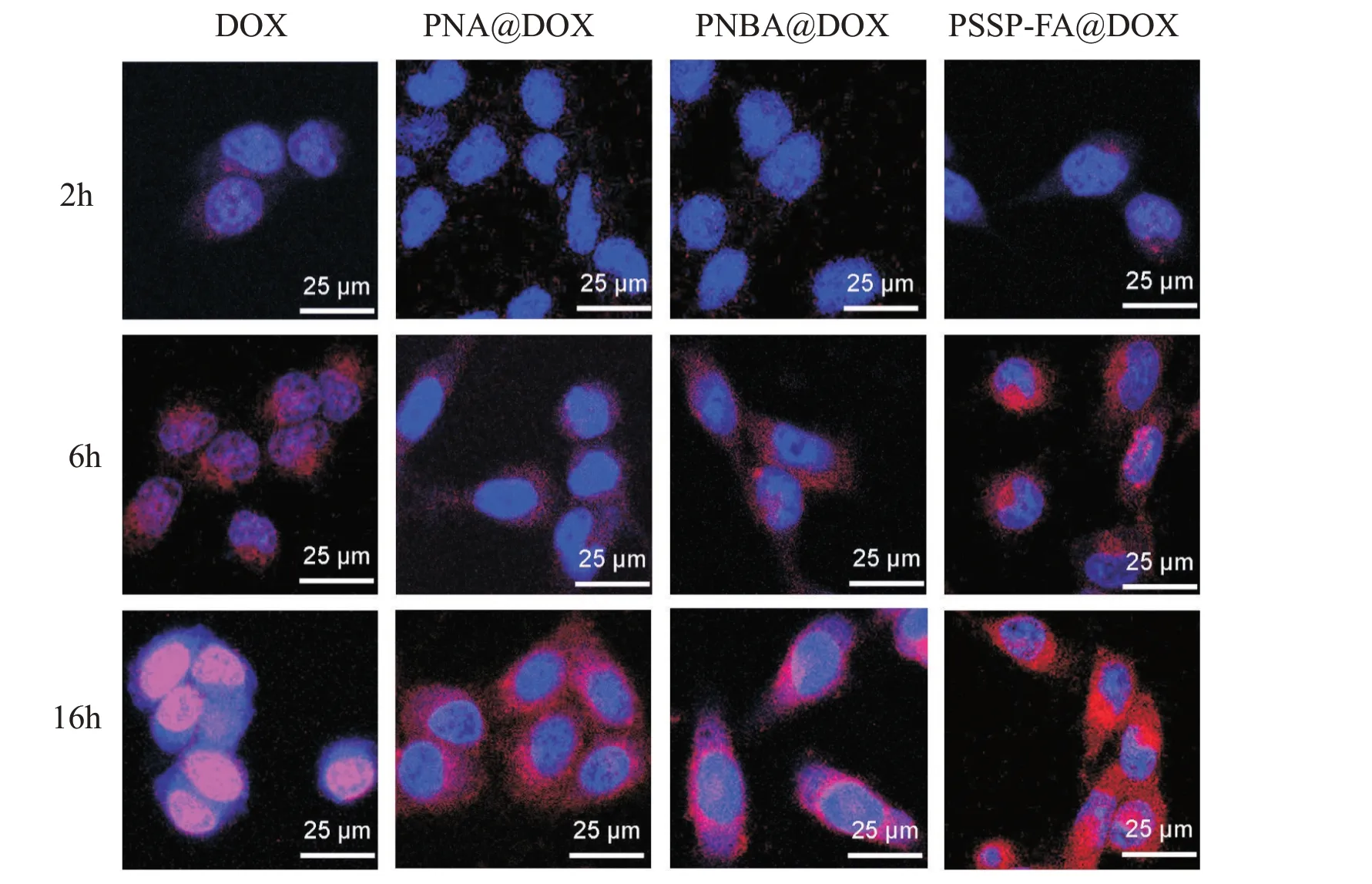
Fig. 9 CLSM photos of 4T1 cells after incubation with free DOX, PNA@DOX, PNBA@DOX and PSSP- FA@DOX for 2 h, 6 h and 16 h
可以看出,未经修饰的PAMAM 树状大分子对3种细胞均有较强的细胞毒性,特别是在浓度达到300μg/mL 时,正常L929 细胞的存活率低于40%,这是因为PAMAM 表面带有许多伯氨基,在生理条件下带正电荷,容易破坏细胞膜导致细胞凋亡。相比之下,表面接枝了PNIPAM 的PAMAM-g-PNIPAM 树状大分子,细胞毒性显著减小,这可能是因为PNIPAM 的加入降低了PAMAM 表面的电荷。另外,接枝了PNB 的PAMAM-g-PNB,其细胞毒性略高于PAMAM-g-PNIPAM,这可能是因为冠醚基团具有一定的生物毒性。最终产物PAMAM-g-PNB-ss-PEGFA 树状大分子,由于表面修饰了具有良好生物相容性的PEG,其细胞毒性相对PAMAM-g-PNB 降低,即使在浓度达到300μg/mL 时,细胞存活率仍可以达到85%以上。结果表明,PAMAM-g-PNB-ss-PEG-FA树状大分子在使用范围内几乎无细胞毒性,可以作为一种具有良好生物相容性的纳米给药载体材料。
2.6 PAMAM-g-PNB-ss-PEG-FA 树状大分子的细胞摄取
以4T1 作为模型细胞,采用CLSM 来观察载药树状大分子进入细胞后,DOX 在细胞内的分布情况,结果如Fig.9 所示。可以看出,游离DOX 组和载药树状大分子组的细胞中均能观察到红色荧光,并且红色荧光强度随着孵育时间的延长而逐渐增强,表明4T1 细胞对游离DOX 和载药树状大分子的摄取具有时间依赖性。在相同孵育时间内,游离DOX组的红色荧光强度明显强于载药树状大分子组,这是由于,DOX 能够通过自由扩散快速进入肿瘤细胞并直接作用于细胞核,而载药树大分子需要通过內吞作用才能进入细胞内。此外,3 个载药树状大分子组的4T1 细胞的细胞核中红色荧光随着孵育时间的延长而逐渐增强,并且呈现PSSP-FA@DOX >PNBA-DOX >PNA@DOX 的规律,这可能是由于PNBA-DOX 能够响应细胞内的高浓度K+信号并释放药物,而PSSP-FA@DOX 能够同时响应细胞内高浓度K+和GSH 信号,促进药物更快速地释放。
2.7 载药PAMAM-g-PNB-ss-PEG-FA 树状大分子的细胞毒性
选择4T1 细胞来考察载药树状大分子的细胞毒性,结果如Fig.10 所示。从图中可以看出,游离DOX 与载药树状大分子对4T1 细胞均表现出时间和剂量依赖的细胞毒性。在相同给药剂量下(尤其是高剂量),PNBA@DOX 对4T1 细胞的毒性明显大于PNA@DOX,这是由于在细胞内液高K+浓度条件下,PNBA@DOX 树状大分子中的PNB 链由疏水收缩状态转变为亲水伸展状态,快速释放DOX;而PNA@DOX 树状大分子没有K+响应性,在细胞内液仍然保持收缩状态,药物释放缓慢,从而表现出较低的肿瘤细胞杀伤力。此外,PSSP-FA@DOX 对肿瘤细胞的毒性略大于PNBA@DOX,这是由于PSSPFA@DOX 同时具有K+和GSH 响应性,在细胞内高浓度K+和GSH 环境中,PNB 链发生分子构象转变,同时二硫键断裂使得PEG 链段分离,两者共同作用促进了药物的胞内释放,从而表现出较强的抗肿瘤活性。
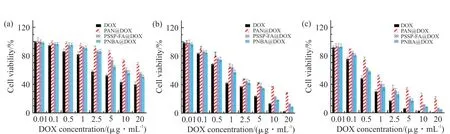
Fig. 10 Antitumor activity of free DOX, PNA@DOX, PSSP- FA@DOX and PNBA@DOX with different DOX concentrations after incubation with 4T1 cells for 24 h (a), 48 h (b) and 72 h (c)
3 结论
本文成功制备了一种同时具K+和GSH 双重响应性的树状大分子PAMAM-g-PNB-ss-PEG-FA。37 ℃下,PAMAM-g-PNB-ss-PEG-FA 树状大分子在高钾溶液中成功实现了K+诱导的收缩-伸展分子构象转变;同时,该树状大分子在低浓度GSH 溶液中,粒径无明显变化,而在高浓度GSH 溶液中,由于二硫键的断裂,树状大分子的粒径减小至初始粒径的50%,表现出良好的GSH 响应性。以抗肿瘤药DOX为模型药物,载药树状大分子表现出明显的高浓度K+和高浓度GSH 诱导下的快速释药行为。在一定浓度范围内,所制备的空白树状大分子对正常细胞和肿瘤细胞均无明显的毒性。体外细胞实验证明,负载DOX 的树状大分子能够被4T1 细胞摄取,并且在细胞内高浓度K+和高浓度GSH 环境下可以快速释放药物,而且释放的药物能有效地杀死肿瘤细胞。该多功能树状大分子有望作为纳米载体实现靶向肿瘤细胞内的药物精准释放。

