青蒿琥酯对多囊卵巢综合征模型大鼠卵巢组织形态的影响
韦奕,张淑芬,黄梦颖,马艳
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种内分泌及代谢功能障碍疾病,多见于育龄期女性,是不孕的重要原因之一,其主要特征是雄激素分泌过多、排卵少及多囊卵巢形态[1-2]。PCOS患者常伴有肥胖,患者随着体质量指数增加易产生胰岛素抵抗(insulin resistance,IR)[3]。目前,PCOS的发生机制尚不明确。近期有研究认为,慢性炎症与PCOS 发病关系密切,可引发卵巢多囊样改变、IR及雄激素分泌增加等症状[4]。因此,从炎症角度研究其治疗机制可能是一个新的方向。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/核因子-κB(nuclear factor-κB,NF-κB)在炎症反应调节中具有重要作用[5]。研究显示,NF-κB 表达增加可导致PCOS 患者产生IR 和慢性炎症[6]。青蒿琥酯(artesunate,ART)作为青蒿素衍生物,具有抗炎、抗肿瘤作用[7]。研究表明,ART可通过抑制p38 MAPK/NF-κB 通路激活来抑制脂多糖诱导的细胞炎症反应[8]。PCOS造成的子宫内膜中雌激素的缺乏可导致子宫内膜癌的发生,而ART可抑制子宫内膜癌细胞的增殖,发挥抑癌作用[9-10]。然而,目前关于ART对PCOS影响机制的研究少见。本研究基于p38 MAPK/NFκB 信号通路,探究ART 对PCOS 模型大鼠卵巢组织形态的影响,为PCOS治疗及新药的开发提供参考。
1 材料与方法
1.1 主要材料 SPF级雌性SD大鼠144只,购自上海斯莱克实验动物有限责任公司,动物生产许可证号:SCXK(沪)2019-0041,10~12 周龄,体质量175~205 g。大鼠在12 h/d 光照环境中饲养7 d,自由饮水摄食,饲养房温度(25.0±0.5)℃,湿度(55±5)%。ART(原料药,纯度99%,货号B3058,北京康瑞纳生物科技有限公司)以生理盐水溶解成质量浓度分别为2.5、5 g/L 的混悬液;达英-35(炔雌醇环丙孕酮片,批号YZ2021317,德国拜耳公司)以生理盐水溶解成质量浓度为0.033 9 g/L 的混悬液;p38 MAPK 特异性激活剂茴香霉素(anisomycin;货号HY-18982,美国MCE 公司);脱氢表雄酮(货号LBH4293,铼博上海生化科技有限公司);空腹胰岛素(FINS)酶联免疫吸附试验(ELISA)试剂盒(货号AT0689EL1,深圳市安提生物科技有限公司);白细胞介素(IL)-18、雌二醇(E2)、肿瘤坏死因子(TNF)-α、IL-1β、卵泡刺激素(FSH)ELISA 试 剂 盒(货 号:M095256、MZ095982、ss301254、BYT1003、MZ095203,上海三抒生物科技有限公司);空腹血糖(FPG)、促黄体生成素(LH)试剂盒(货号:YS-E93554、YSE50172,上海研生实业有限公司);苏木素-伊红(HE)染色试剂盒(货号YPC1275,北京华越洋生物科技有限公司);睾酮(T)试剂盒(货号JH-R31203,上海继和生物科技有限公司);BCA 蛋白检测试剂盒(货号SB-WB013,上海圣尔生物科技有限公司);兔抗鼠磷酸化p38 MAPK(p-p38 MAPK)、磷酸化NF-κB p65(p-NF-κB p65)、p38 MAPK、NF-κB p65、GAPDH单克隆抗体及羊抗兔二抗(货号:AL-4764、AL-2118、AL-3031、AL-9017、AL-1091、A-11008,美国CST 公司);全自动生化分析仪(型号7600,日本日立公司);光学显微镜(型号N-300M,深圳市欧博浩瀚科技有限公司);多功能酶标仪(型号Hybrid Multi-Mode Reader,上海优宁维生物科技股份有限公司);透射电子显微镜(型号LVEM5,上海双旭电子有限公司);凝胶成像仪(型号Auto Focus,上海培清科技有限公司)。本研究经南华大学附属第一医院伦理委员会批准。
1.2 研究方法
1.2.1 PCOS 模型构建和分组 参照文献[11]建立PCOS 模型:将大鼠皮下注射脱氢表雄酮60 mg/kg(0.2 mL注射油剂稀释),1 次/d,注射28 d 后连续4 d(1 个动情周期)观察大鼠阴道涂片,若大鼠阴道上皮出现持续角化且失去动情周期,表明造模成功。将造模成功的120 只大鼠按随机数表法分为PCOS 组、达英-35 组(0.339 mg/kg 达英-35)、ART 低剂量(ART-L)组、ART 高剂量(ART-H)组、ART-H+anisomycin组,每组24 只。另选取24 只大鼠皮下注射60 mg/kg 生理盐水作为正常组。造模成功后第1 天,达英-35 组、ART-L 组、ART-H 组大鼠分别灌胃0.339 mg/kg 达英-35(0.033 9 g/L 的达英-35 混悬液10 mL/kg 灌胃)、25 mg/kg ART(2.5 g/L 的ART混悬液10 mL/kg灌胃)、50 mg/kg ART(5 g/L的ART混悬液10 mL/kg 灌胃);ART-H+anisomycin 组大鼠灌胃50 mg/kg ART 以及腹腔注射25 mg/L anisomycin 1 mL;PCOS 组和正常组大鼠灌胃等量(10 mL/kg)生理盐水;各组干预均1次/d,连续给药28 d。
1.2.2 大鼠阴道涂片 造模结束后,正常组、PCOS组各抽取5只大鼠,分别于动情前期、动情期、动情后期及动情间期将蘸取生理盐水的棉签插入大鼠的阴道中,在阴道侧壁1/3 处刮取细胞,顺时针涂于载玻片上,经甲醛固定后使用吉姆萨染液进行20 min 染色,清洗后于光镜(×100)下观察细胞形态。
1.2.3 大鼠血清指标检测 给药结束后禁食不禁水24 h,次日清晨取各组全部大鼠尾静脉血0.5 mL,采用全自动生化分析仪检测FPG。使用戊巴比妥钠将大鼠麻醉后取其腹主动脉血4 mL,4 000 r/min 离心15 min 后取上清液,参照ELISA试剂盒说明书,检测FSH、LH、E2、T、FINS、IL-18、TNF-α、IL-1β 水平,计算胰岛素抵抗指数(HOMA-IR)=FPG(mmoL/L)×FINS(mIU/L)/22.5。
1.2.4 HE染色观察卵巢组织病理情况 给药结束后每组取8只大鼠,通过颈椎脱臼处死后取其双侧卵巢并称质量,将左侧卵巢放入4%多聚甲醛中进行固定,经过二甲苯脱水和浸蜡包埋后,制作连续切片(4µm),HE着色、封片,光镜(×400)观察病理情况,并统计卵巢切片中的卵泡数目。
1.2.5 透射电子显微镜观察卵巢组织超微结构 给药结束后每组另取8 只大鼠左侧卵巢组织,切为约1 mm3大小后置入2.5%戊二醛中(4 ℃)固定120 min,磷酸盐缓冲液清洗后用锇酸(1%)再次固定90 min,磷酸盐缓冲液清洗后进行脱水,使用环氧树脂包埋,制作50~60 nm的超薄切片,经枸橼酸铅及醋酸铀染色后于透射电镜下(×10 000)观察。
1.2.6 Western blot 法检测卵巢组织p38 MAPK/NF-κB 通路蛋白表达 给药结束后使用组织裂解液将每组剩余的8只大鼠左侧卵巢组织裂解后匀浆、12 000 r/min 离心5 min 取上清液。经蛋白定量、上样、凝胶电泳分离蛋白后依次进行湿法转膜、封闭,孵育兔抗鼠p-p38 MAPK、p-NF-κB p65、p38 MAPK、NF-κB p65、GAPDH(均1∶2 000)一抗,次日使用羊抗兔二抗(1∶3 000)孵育,经过ECL 显影后在凝胶成像仪中对蛋白条带进行扫描观察,Image J(版本V1.8.0.112)分析其灰度值,计算p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65蛋白表达。
1.3 统计学方法 采用GraphPad Prism 7.0 进行数据分析。符合正态分布的计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠动情周期阴道细胞形态观察 正常组大鼠的动情周期稳定:动情前期阴道涂片上存在有核上皮细胞;动情期存在大量呈“落叶状”堆积的不规则角化上皮细胞及少量的有核上皮细胞;动情后期可见比例相当的白细胞、角化上皮细胞、有核上皮细胞;动情间期存在少量有核上皮细胞以及阴道黏液,存在大量白细胞。PCOS 组大鼠阴道涂片上有核上皮细胞及角化上皮细胞均明显减少,角化上皮细胞数量减少更为明显,动情期和动情间期白细胞明显增加,而角化上皮细胞脱落明显减少,动情期明显缩短,而动情间期明显延长,造模成功,见图1。
2.2 各组血清FSH、LH、E2、T 水平比较 与正常组比较,PCOS 组血清LH、T 水平增加,FSH、E2水平降低(P<0.05);与PCOS 组比较,达英-35 组、ART-L组、ART-H组血清LH、T水平降低,FSH、E2水平增加(P<0.05);与达英-35组比较,ART-L组和ART-H+anisomycin组血清LH、T水平增加,FSH、E2水平降低(P<0.05),ART-H 组血清LH、T、FSH、E2水平差异无统计学意义(P>0.05);与ART-L 组比较,ART-H组血清LH、T 水平降低,FSH、E2水平增加(P<0.05);与ART-H组比较,ART-H+anisomycin 组血清LH、T水平增加,FSH、E2水平降低(P<0.05)。见表1。
2.3 各组FPG、FINS、HOMA-IR 水平比较 与正常组比较,PCOS 组血清FPG、FINS、HOMA-IR 水平增加(P<0.05);与PCOS 组比较,达英-35 组、ART-L组、ART-H 组血清FPG、FINS、HOMA-IR 水平降低(P<0.05);与达英-35组比较,ART-L组和ART-H+anisomycin 组血清FPG、FINS、HOMA-IR 水平增加(P<0.05),ART-H 组血清FPG、FINS、HOMA-IR 水平差异无统计学意义(P>0.05);与ART-L 组比较,ART-H组血清FPG、FINS、HOMA-IR 水平降低(P<0.05);与ART-H组比较,ART-H+anisomycin 组血清FPG、FINS、HOMA-IR水平增加(P<0.05)。见表2。
2.4 各组血清IL-1β、TNF-α、IL-18 水平比较 与正常组比较,PCOS 组血清IL-1β、TNF-α、IL-18 水平增加(P<0.05);与PCOS 组比较,达英-35 组、ART-L组、ART-H组血清IL-1β、TNF-α、IL-18水平降低(P<0.05);与达英-35 组比较,ART-L 组和ART-H+anisomycin 组血清IL-1β、TNF-α、IL-18 水平增加(P<0.05),ART-H组血清IL-1β、TNF-α、IL-18水平差异无统计学意义(P>0.05);与ART-L组比较,ART-H 组血清IL-1β、TNF-α、IL-18 水平降低(P<0.05);与ART-H组比较,ART-H+anisomycin 组血清IL-1β、TNF-α、IL-18水平增加(P<0.05)。见表3。
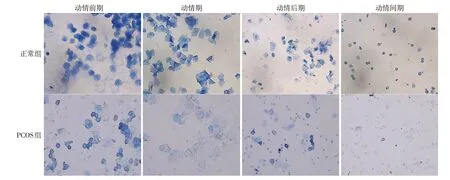
Fig.1 Observation of estrous cycle of rats in the normal group and the PCOS group(Giemsa staining,×100)图1 正常组及PCOS组大鼠动情周期观察(吉姆萨染色,×100)
Tab.1 Comparison of serum levels of FSH,LH,E2 and T between the six groups of rats表1 各组血清FSH、LH、E2、T水平比较(n=24,±s)
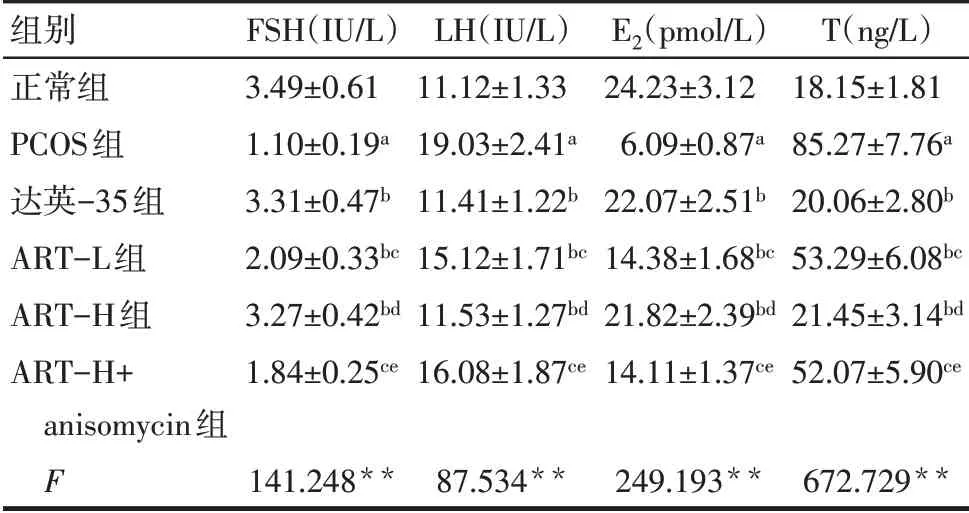
Tab.1 Comparison of serum levels of FSH,LH,E2 and T between the six groups of rats表1 各组血清FSH、LH、E2、T水平比较(n=24,±s)
**P<0.01;a与正常组比较,b与PCOS组比较,c与达英-35组比较,d与ART-L组比较,e与ART-H组比较,P<0.05;表2~5同。
组别正常组PCOS组达英-35组ART-L组ART-H组ART-H+anisomycin组F FSH(IU/L)3.49±0.61 1.10±0.19a 3.31±0.47b 2.09±0.33bc 3.27±0.42bd 1.84±0.25ce LH(IU/L)11.12±1.33 19.03±2.41a 11.41±1.22b 15.12±1.71bc 11.53±1.27bd 16.08±1.87ce E2(pmol/L)24.23±3.12 6.09±0.87a 22.07±2.51b 14.38±1.68bc 21.82±2.39bd 14.11±1.37ce T(ng/L)18.15±1.81 85.27±7.76a 20.06±2.80b 53.29±6.08bc 21.45±3.14bd 52.07±5.90ce 141.248**87.534**249.193**672.729**
Tab.2 Comparison of FPG,FINS and HOMA-IRlevels between the six groups of rats表2 各组FPG、FINS、HOMA-IR水平比较(n=24,±s)
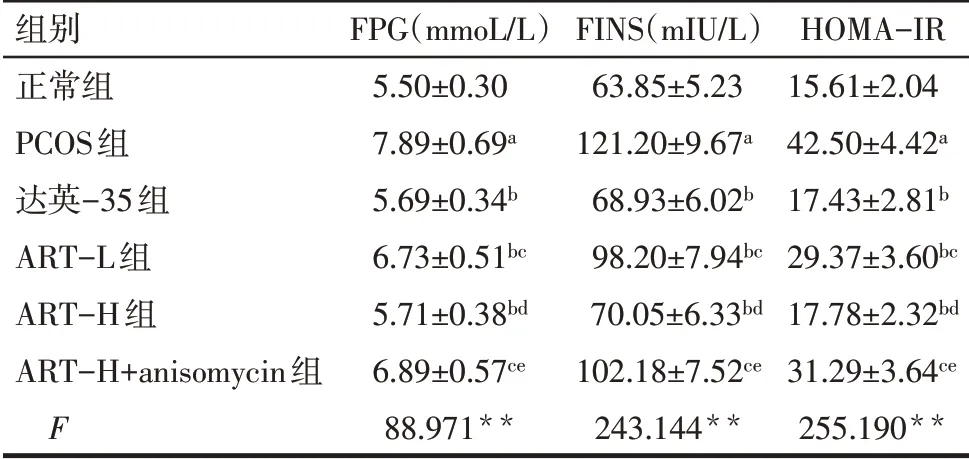
Tab.2 Comparison of FPG,FINS and HOMA-IRlevels between the six groups of rats表2 各组FPG、FINS、HOMA-IR水平比较(n=24,±s)
组别正常组PCOS组达英-35组ART-L组ART-H组ART-H+anisomycin组F FPG(mmoL/L)5.50±0.30 7.89±0.69a 5.69±0.34b 6.73±0.51bc 5.71±0.38bd 6.89±0.57ce 88.971**FINS(mIU/L)63.85±5.23 121.20±9.67a 68.93±6.02b 98.20±7.94bc 70.05±6.33bd 102.18±7.52ce 243.144**HOMA-IR 15.61±2.04 42.50±4.42a 17.43±2.81b 29.37±3.60bc 17.78±2.32bd 31.29±3.64ce 255.190**
Tab.3 Comparison of serum IL-1β,TNF-α and IL-18 levels between the six groups of rats表3 各组血清IL-1β、TNF-α、IL-18水平比较(n=24,ng/L,±s)
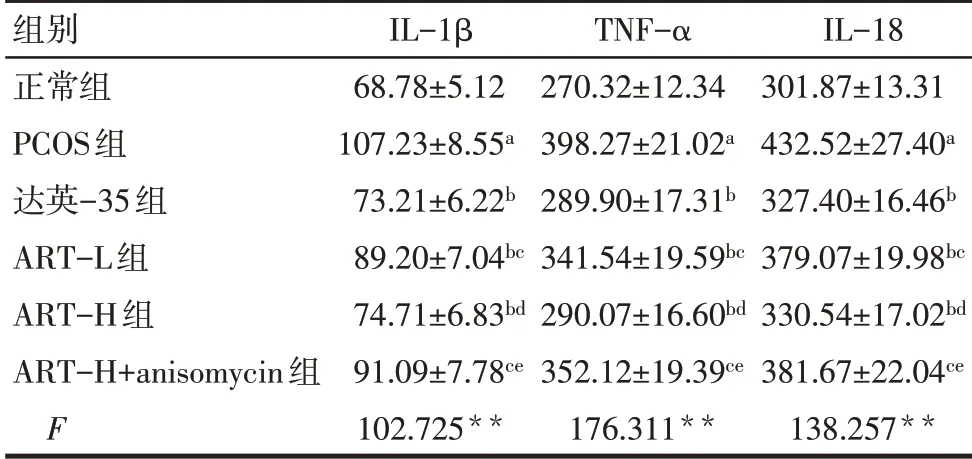
Tab.3 Comparison of serum IL-1β,TNF-α and IL-18 levels between the six groups of rats表3 各组血清IL-1β、TNF-α、IL-18水平比较(n=24,ng/L,±s)
组别正常组PCOS组达英-35组ART-L组ART-H组ART-H+anisomycin组F IL-1β 68.78±5.12 107.23±8.55a 73.21±6.22b 89.20±7.04bc 74.71±6.83bd 91.09±7.78ce 102.725**TNF-α 270.32±12.34 398.27±21.02a 289.90±17.31b 341.54±19.59bc 290.07±16.60bd 352.12±19.39ce 176.311**IL-18 301.87±13.31 432.52±27.40a 327.40±16.46b 379.07±19.98bc 330.54±17.02bd 381.67±22.04ce 138.257**
2.5 各组卵巢质量及卵泡数量比较 与正常组比较,PCOS组卵巢质量及卵泡数量增加(P<0.05);与PCOS组比较,达英-35组、ART-L组、ART-H组卵巢质量及卵泡数量降低(P<0.05);与达英-35组比较,ART-L 组和ART-H+anisomycin 组卵巢质量及卵泡数量增加(P<0.05),ART-H 组卵巢质量及卵泡数量差异无统计学意义(P>0.05);与ART-L 组比较,ART-H 组卵巢质量及卵泡数量降低(P<0.05);与ART-H组比较,ART-H+anisomycin组卵巢质量及卵泡数量增加(P<0.05)。见表4。
2.6 各组卵巢组织病理表现的比较 正常组大鼠卵巢组织中可见不同发育时期的卵泡及多个黄体,结构正常,未发生病变,卵母细胞结构清晰且完整,颗粒细胞排列紧密且整齐。PCOS 组卵巢组织内闭锁卵泡及囊性扩张卵泡增多,卵泡内卵母细胞或放射冠消失,黄体明显减少,颗粒细胞疏松排列且层数明显减少。与PCOS组比较,达英-35组可见不同发育时期的卵泡,未见明显的囊性改变,颗粒细胞紧密且有序的排列,黄体明显增加;ART-L组、ART-H组卵巢组织内囊性扩张卵泡依次减少,可见清晰的放射冠,颗粒细胞紧密且有序地排列,黄体均有一定增加,颗粒细胞疏松排列现象减轻。与ART-H 组比较,ART-H+anisomycin 组囊性扩张卵泡明显增多,黄体减少,颗粒细胞疏松排列。见图2。
Tab.4 Comparison of ovarian weight and number of follicles between the six groups of rats表4 各组卵巢质量及卵泡数量比较(n=8,±s)
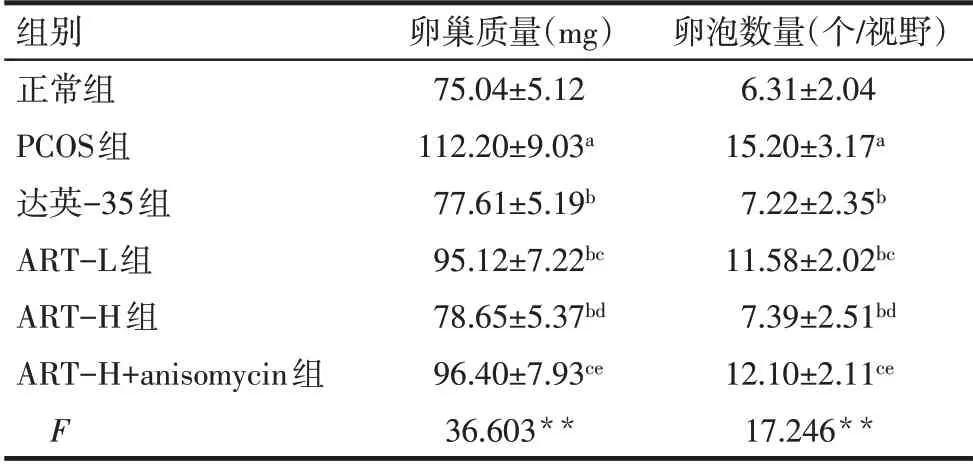
Tab.4 Comparison of ovarian weight and number of follicles between the six groups of rats表4 各组卵巢质量及卵泡数量比较(n=8,±s)
组别正常组PCOS组达英-35组ART-L组ART-H组ART-H+anisomycin组F卵巢质量(mg)75.04±5.12 112.20±9.03a 77.61±5.19b 95.12±7.22bc 78.65±5.37bd 96.40±7.93ce 36.603**卵泡数量(个/视野)6.31±2.04 15.20±3.17a 7.22±2.35b 11.58±2.02bc 7.39±2.51bd 12.10±2.11ce 17.246**

Fig.2 Comparison of pathological conditions of ovarian tissue in each group(HE staining,×400)图2 各组卵巢组织病理情况比较(HE染色,×400)
2.7 各组大鼠卵巢组织超微结构观察 正常组大鼠卵巢组织中颗粒细胞呈现椭圆形,染色质均匀分布,胞核正常,颗粒细胞及卵泡膜细胞中可见大量线粒体、内质网及脂滴空泡。PCOS 组颗粒细胞核皱缩、变形,线粒体肿胀、成絮状、嵴断裂,卵泡膜细胞数量较多且胞内脂滴、线粒体增加,存在大量的滑面内质网。与PCOS 组比较,达英-35 组、ART-L 组、ART-H组卵巢组织中颗粒细胞结构逐渐正常,线粒体数量增加且结构正常,存在大量的滑面内质网,卵泡膜细胞凋亡增加且脂滴空泡及线粒体减少。与ART-H组比较,ART-H+anisomycin组颗粒细胞损伤明显加重,卵泡膜细胞凋亡减少,脂滴空泡及线粒体增加。见图3。

Fig.3 Ultrastructural observation of ovarian tissue of rats in each group(lead citrate and uranyl acetate staining,×10 000)图3 各组大鼠卵巢组织超微结构观察(枸橼酸铅及醋酸铀染色,×10 000)
2.8 各组卵巢组织p38 MAPK/NF-κB 通路蛋白表达比较 与正常组比较,PCOS 组卵巢组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 蛋白表达增加(P<0.05);与PCOS 组比较,达英-35 组、ART-L 组、ART-H 组 卵 巢 组 织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 蛋白表达降低(P<0.05);与达英-35组比较,ART-L组和ART-H+anisomycin 组卵巢组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 蛋白表达增加(P<0.05),ART-H 组卵巢组织p-p38 MAPK/p38 MAPK、p-NFκB p65/NF-κB p65 蛋白表达差异无统计学意义;与ART-L 组比较,ART-H 组卵巢组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 蛋白表达降低(P<0.05);与ART-H组比较,ART-H+anisomycin组卵巢组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65蛋白表增加(P<0.05)。见表5、图4。
Tab.5 Comparison of p38 MAPK/NF-κB pathway protein expression in ovarian tissue between the six groups表5 各组卵巢组织p38 MAPK/NF-κB通路蛋白表达比较(n=8,±s)
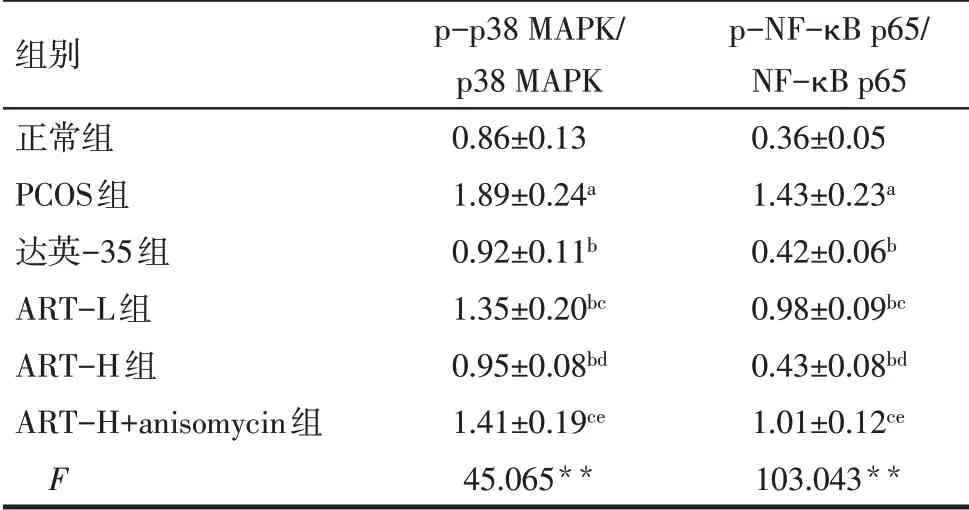
Tab.5 Comparison of p38 MAPK/NF-κB pathway protein expression in ovarian tissue between the six groups表5 各组卵巢组织p38 MAPK/NF-κB通路蛋白表达比较(n=8,±s)
组别正常组PCOS组达英-35组ART-L组ART-H组ART-H+anisomycin组F p-p38 MAPK/p38 MAPK 0.86±0.13 1.89±0.24a 0.92±0.11b 1.35±0.20bc 0.95±0.08bd 1.41±0.19ce 45.065**p-NF-κB p65/NF-κB p65 0.36±0.05 1.43±0.23a 0.42±0.06b 0.98±0.09bc 0.43±0.08bd 1.01±0.12ce 103.043**
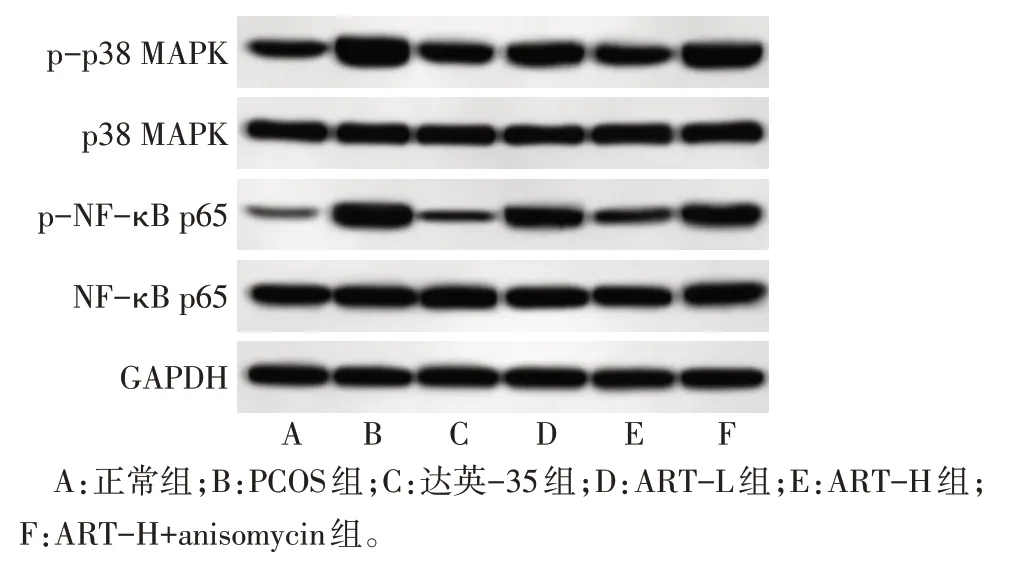
Fig.4 Western blot assay of p38 MAPK/NF-κB pathway protein in ovarian tissue of rats in each group图4 各组大鼠卵巢组织p38 MAPK/NF-κB通路蛋白Western blot结果
3 讨论
PCOS为育龄女性最常发生的一种内分泌疾病,是导致无排卵性不孕症的主要原因之一。PCOS 除影响女性生殖外,还会增加女性患心血管疾病和子宫内膜癌的概率[9,12]。大量证据表明,PCOS 的慢性低度炎症状态可造成胰岛β 细胞及卵巢损伤,导致性激素分泌异常及卵巢多囊样改变[13]。因此,改善PCOS炎症反应已成为PCOS治疗的一大研究热点。
ART是天然产物青蒿素衍生的一种半合成化合物,具有免疫调节、抗病毒、抗肿瘤的作用[14]。研究表明,ART 可通过以心脏神经嵴衍生物表达蛋白2依赖性方式激活雌激素受体-α 介导的肝激酶B1(LKB1)/腺苷酸活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)通路,从而发挥抗子宫内膜癌的作用[15]。ART 能改善糖尿病小鼠胰岛损伤,降低血糖水平,抑制IR[16]。ART 对血红素氧合酶-1(HO-1)通路有激活作用,进而抑制肾缺血再灌注损伤大鼠的肺部炎症反应[17]。ART还可通过抑制骨关节炎小鼠NF-κB信号通路激活来减轻IL-1β诱导的炎症反应[18]。颗粒细胞具有预防卵泡闭锁、促进卵泡发育的作用。本研究结果显示,高剂量ART 具有与达英-35相同的疗效,ART可有效降低PCOS大鼠炎症反应及IR,恢复卵巢形态,促使卵巢激素微环境平衡及卵泡正常发育,提示高剂量ART 具有作为PCOS治疗药物的潜能。
p38 MAPK参与炎症反应过程,其活化可以通过促进炎性细胞因子的表达来激活NF-κB,后者是p38 MAPK 通路的下游位点,而NF-κB 激活又可促进IL-1β、TNF-α、IL-18 等炎性因子的释放,其被作为炎症反应过程的中心介质[19]。研究表明,p38 MAPK/NF-κB 信号通路在PCOS 发生时被显著激活,针灸结合中药治疗可通过抑制MAPK 通路改善PCOS患者IR[20]。NF-κB介导的炎症通路在受到刺激后,NF-κB抑制蛋白α降解并释放NF-κB p65,进而激活下游炎性因子的表达,促进PCOS 炎症进展[6]。化痰通脉饮可通过抑制NF-κB 通路激活,减轻PCOS 大鼠血清炎性因子的表达[21]。ART 通过抑制MAPK/NF-κB 信号途径减轻TNF-α 诱导的肝癌HepG2 细胞炎症反应[22]。本研究结果显示,与正常组比较,PCOS 大鼠卵巢组织中p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 蛋白表达增加,表明PCOS 发生时p38 MAPK/NF-κB 通路处于激活状态,与相关研究结果一致[6];与PCOS组比较,ART-L组及ART-H组PCOS大鼠卵巢组织中p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 蛋白表达水平降低,表明ART 可有效抑制PCOS 大鼠p38 MAPK/NF-κB 通路激活,提示ART 可能通过抑制p38 MAPK/NF-κB 通路来减轻PCOS 大鼠炎症反应,从而改善卵巢损伤。为验证这一推测,本研究使用p38 MAPK/NF-κB通路激活剂anisomycin处理大鼠,结果显示anisomycin 可逆转ART 减轻PCOS 大鼠炎症反应、IR 及恢复卵巢形态的效应,提示ART 可能通过抑制p38 MAPK/NF-κB 炎症通路而恢复PCOS大鼠性激素水平,改善卵巢组织形态及功能。
综上所述,ART 可通过抑制p38 MAPK/NF-κB炎症通路,降低炎性因子表达,从而促使PCOS 大鼠性激素水平恢复,改善卵巢形态及功能,本研究结论可为治疗PCOS药物的研究提供参考,但有关其进一步的下游机制仍有待后续深入探讨。

