circ_0007762通过miR-18a-5p调节肺成纤维细胞自噬的机制研究
黄彬,张军,郑金旭△,丁慢玲,吴妍
特发性肺纤维化(IPF)为一类病因未明的慢性进展性纤维化性间质性肺病,以肺泡上皮细胞损伤的异常修复、纤维细胞激活等共同导致的胞外基质(ECM)过度沉积为特征[1-2]。IPF 好发于中老年人,且发病率逐年上升[3]。尽管目前对IPF 病理方面的研究已取得较大突破,但对成纤维细胞在纤维组织重塑过程中激活的机制却了解甚少。环状RNA(circRNA)为一类3'至5'端反向剪接产生的单链闭合环状RNA[4]。circRNA 可作为竞争性内源RNA(ceRNA)竞争微小RNA(miRNA)结合位点,影响miRNA活性并减轻miRNA对靶mRNA的抑制;部分circRNA 结合蛋白后将其定位至特定DNA 序列,并充当蛋白支架分子或蛋白海绵[5-6]。Li 等[7]从数据集GSE102660中发现IPF样本中存在67个表达失调的circRNA,其中circ_0007762明显上调。本研究在预测circ_0007762 的靶miRNA 的基础上,探讨circ_0007762能否通过ceRNA 机制调节自噬这一亚细胞降解途径,影响肺成纤维细胞增殖分化,进而调控IPF进程并促进纤维化样表型,为探索IPF进展的潜在机制提供理论基础。
1 材料与方法
1.1 材料 人胚肺成纤维细胞株HFL1、F12K 培养基,青霉素-链霉素(武汉普诺赛生命科技有限公司);胎牛血清(Gibco 公司);转化生长因子(TGF)-β1(北京达科为生物技术有限公司);自噬抑制剂3-甲基腺嘌呤(3-MA)购自Sigma公司;circ_0007762 小干扰RNA(si-circ_0007762)由广州锐博生物科技有限公司合成;miRNA inhibitor 及mimics 由北京合生生物科技有限公司合成;TransMaxR-100(bioexplorer 公司);反转录和实时荧光定量PCR 试剂盒(TAKARA 公司);miRNA反转录试剂盒、CCK-8、BCA试剂盒及ECL发光液(南京诺唯赞生物科技股份有限公司);PARISTM核质分离试剂盒(赛默飞公司);HEK293细胞株、circ_0007762引物、双荧光素酶报告基因载体构建(广州吉赛生物科技有限公司);其他引物(上海生工股份有限公司);TRIzol、Lipofectamine 2000(Invitrogen 公司);兔抗GAPDH、Ⅰ型胶原(collagenⅠ)抗体(proteintech公司);兔抗P62、微管相关蛋白1轻链3β(LC3B)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗(CST公司)。
1.2 方法
1.2.1 生物信息学分析 通过GEO 数据库(www.ncbi.nlm.nih.gov/geo)分 析circ_0007762 在IPF 患 者circRNA 数 据 集GSE102660 中的表达。使用circBank 数据库(www.circbank.cn)获取circ_0007762 基本信息。通过ENCORI(starbase.sysu.edu.cn)及circBank 预测circ_0007762 的靶miRNA 及相应的结合位点,并与GEO 来源的IPF 肺组织miRNA 表达谱GSE13316取交集筛选靶miRNA。
1.2.2 细胞培养、转染及给药分组 HFL1细胞接种于F12K培养基,添加10%胎牛血清、1%青霉素-链霉素,于5%CO2、37 ℃恒温培养箱培养。通过转染si-circ_0007762 实现circ_0007762 敲低,通过转染miR-18a-5p 模拟物和抑制剂实现miR-18a-5p 的过表达和敲低。接种HFL1 细胞于6 孔板,待其生长至60%~70%融合度时,依照TransMaxR-100 说明书转染si-circ_0007762、miRNA模拟物、抑制剂及相应阴性对照(终浓度50 nmol/L),转染6 h后更换培养基,转染序列见表1。转染后添加TGF-β1(10µg/L)、二甲基亚砜(DMSO,0.1%)或3-MA(5 nmol/L,溶于0.1%DMSO)干预48 h。实验分组如下:(1)正常组(Control组)、TGF-β1组、TGF-β1+DMSO组、TGF-β 1+3-MA 组。(2)si-NC 组(siRNA 阴性对照)、si-circ_0007762组(转染si-circ_0007762)、miR-NC组(转染miRNA单链阴性对照)、miR-18a-5p inhibitor 组(转染miR-18a-5p inhibitor)、mimics-NC 组(转染miRNA 双链阴性对照)、miR-18a-5p mimics 组(转染miR-18a-5p mimics)、si-circ_0007762+miRNC组、si-circ_0007762+miR-18a-5p inhibitor组。
Tab.1 Synthetic gene sequences表1 合成物基因序列
1.2.3 Sanger测序及实时荧光定量PCR 委托广州吉赛生物科技有限公司利用sanger 测序检测环化位点,验证circ_0007762 引物特异性。TRIzol 法提取细胞总RNA 后,进行反转录和实时荧光定量PCR,以2-ΔΔCt表示目的基因相对表达水平。PCR 反应条件:95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环。以GAPDH 为内参,检测给药或转染后的circ_0007762表达改变,以U6 为内参检测miR-18a-5p、miR-135a-5p、miR-135b-5p水平变化,各引物序列见表2。实验分组如下:(1)Control 组、TGF-β1 组。(2)si-NC 组、si-circ_0007762 组。(3)miR-NC 组、miR-18a-5p inhibitor 组。(4)mimics-NC 组、miR-18a-5p mimics组。
1.2.4 荧光原位杂交(FISH)及核质分离实验 HFL1细胞爬片由4%多聚甲醛固定5 min,0.5%Triton X-100 于室温孵育后无水乙醇洗涤。Cy3 标记的circ_0007762 探针变性:88 ℃5 min,4 ℃3 min。加入探针杂交,37 ℃孵育过夜。第2天弃杂交液后2×含盐的柠檬酸钠缓冲液(SSC)漂洗爬片。50µL DAPI-Antifade 溶液滴于载玻片,将爬片倒扣在液滴上并封片,避光20 min 以上,通过激光共聚焦显微镜观察。利用PARISTM试剂盒分离细胞核和细胞质蛋白及RNA,分别对2种RNA进行实时荧光定量PCR检测。

Tab.2 Primer sequences for qPCR表2 qPCR引物序列
1.2.5 双荧光素酶报告基因检测 通过PCR 分别扩增包括miR-18a-5p结合位点的circ_0007762 3'UTR序列,将目的片段连接入psiCHECK2 载体中,得到野生型circ_0007762 3'UTR 报告基因载体circ_0007762 WT。上述序列突变并扩增后连接入psiCHECK2 载体,得到突变型载体circ_0007762 MUT。参照说明书使用Lipofectamine 2000 共转染1µg 报告基因载体与终浓度100 nmol/L 的miR-18a-5p mimics 或mimics-NC 至HEK293 细胞中。48 h 后收取细胞,用发光仪检测荧光素酶活性。
1.2.6 细胞增殖实验 将HFL1细胞(约3×103/孔)接种至96孔板,在37 ℃培养24 h 后进行转染。实验分组如下:(1)si-NC 组、si-circ_0007762 组、si-circ_0007762+miR-NC 组、sicirc_0007762+miR-18a-5p inhibitor组。(2)Control组、TGF-β1组、TGF-β1+DMSO组、TGF-β1+3-MA组。分别于转染后0、24、48、72 h 添加CCK-8 试剂10µL/孔,37 ℃孵育1 h 后测量450 nm 处的光密度,计算各组间细胞活力。细胞活力=(给药组光密度-空白组光密度)/(正常组光密度-空白组光密度)×100%。
1.2.7 Western blot 实验分组如下:(1)Control 组、TGF-β1组、TGF-β1+si-NC 组、TGF-β1+si-circ_0007762 组、TGF-β 1+si-circ_0007762+miR-NC 组、TGF-β1+si-circ_0007762+miR-18a-5p inhibitor 组。(2)TGF-β1 组、TGF-β1+DMSO 组、TGF-β1+3-MA组。提取各组HFL1总蛋白,BCA法定量后蛋白变性。取30µg进行电泳、转膜及封闭后,4 ℃兔抗一抗孵育过夜:GAPDH 抗体(1∶5 000);collagenⅠ抗体(1∶3 000);P62、LC3B、α-SMA抗体(1∶1 000)。HRP标记的山羊抗兔二抗(1∶3 000)室温孵育1 h,暗室内使用ECL 发光液显影曝光及Image J软件分析上述蛋白相对表达水平。
1.2.8 统计学方法 使用Graphpad Prism 8.3.0 及SPSS 22.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
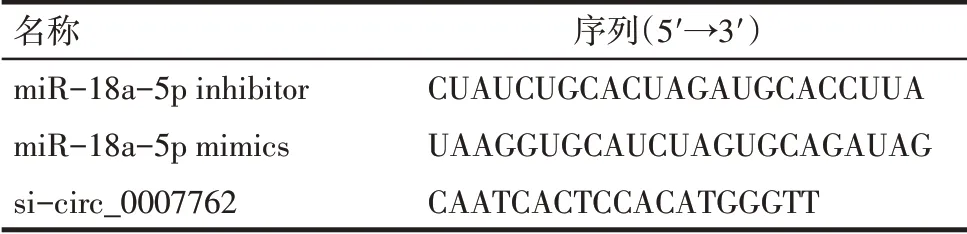
2.1 circ_0007762 的miRNA 靶标的预测及筛选结果 通过对GEO 数据库的数据集GSE102660 分析发现,circ_0007762在IPF中上调,见图1A。circBank查询结果提示circ_0007762定位于6号染色体q24.3片段(147581750-147599340),由外显子反向剪接形成,见图1B。利用circBank 及ENCORI 分别预测出25个和17个circ_0007762的miRNA靶点,将两者与GEO 数据集GSE13316 中504 个下调的miRNA 取交集,初步筛选出circ_0007762可能的靶miRNA:miR-18a-5p、miR-135a-5p、miR-135b-5p,见图1C。
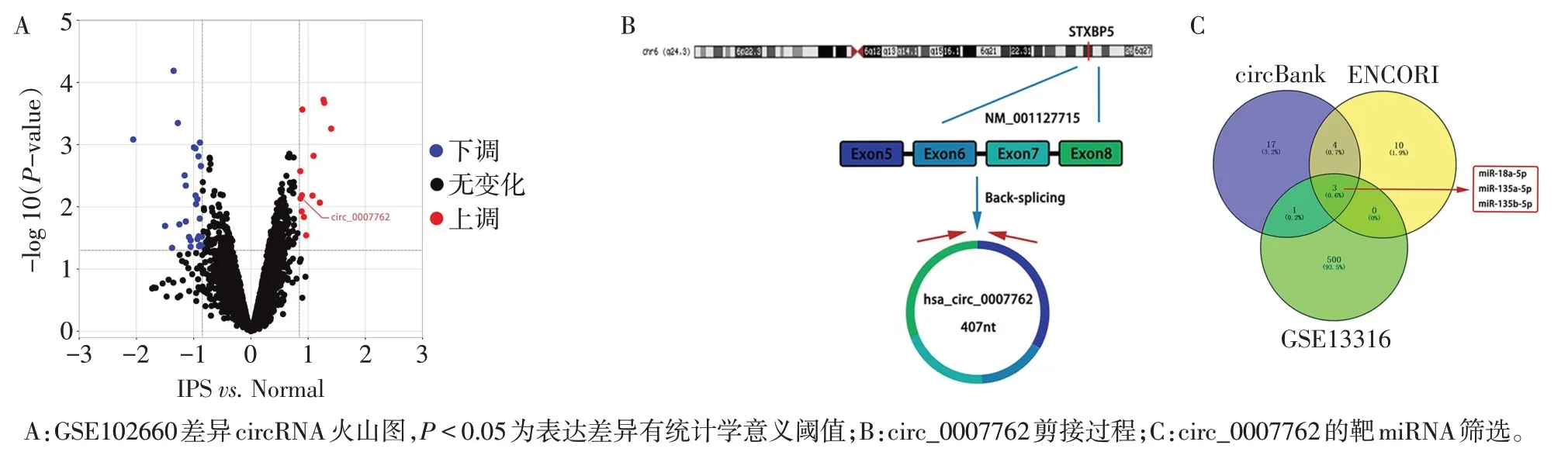
Fig.1 The circ_0007762 pattern and the screening of its target miRNAs图1 circ_0007762模式图及其靶miRNA筛选
2.2 TGF-β1 干预后HFL1 细胞中circ_0007762 及miRNA 表达变化 Sanger 测序示circ_0007762 的PCR 产物环化位点(图2A)。与Control 组相比,在TGF-β1干预HFL1 48 h后,circ_0007762、miR-135a-5p 和miR-135b-5p 表达水平上调(P<0.05),miR-18a-5p表达下调(P<0.05),见图2B、C。miR-18a-5p与circ_0007762存在竞争性结合的可能性更大。
2.3 circ_0007762 竞争性结合miR-18a-5p 荧光原位杂交及核质分离结果显示circ_0007762细胞质分布多于细胞核,见图3。利用ENCORI数据库证实circ_0007762 存在miR-18a-5p 结合位点,见图4A;荧光素酶实验结果显示,在circ_0007762 WT 中,与mimics-NC 组相比,miR-18a-5p mimics 组荧光素酶活性明显减弱(P<0.05),见图4B,证明两者存在内源性结合。此外,抑制circ_0007762 表达后可上调miR-18a-5p 表达水平(P<0.05),见图5A。抑制miR-18a-5p 表达可上调circ_0007762 表达水平,增强miR-18a-5p 表达则下调circ_0007762 表达水平(P<0.05),见图5B、C。
2.4 敲低circ_0007762 对细胞增殖的抑制作用及miR-18a-5p 对其影响 CCK-8 结果显示,与si-NC组比较,si-circ_0007762组HFL1细胞增殖活性受到抑制(P<0.05),然而si-circ_0007762+miR-18a-5p inhibitor 组 与si-circ_0007762+miR-NC 组 相 比,HFL1 增殖活性升高(P<0.05),敲低miR-18a-5p 的表达逆转了si-circ_0007762 对HFL1 细胞的增殖抑制作用,见图6、表3。
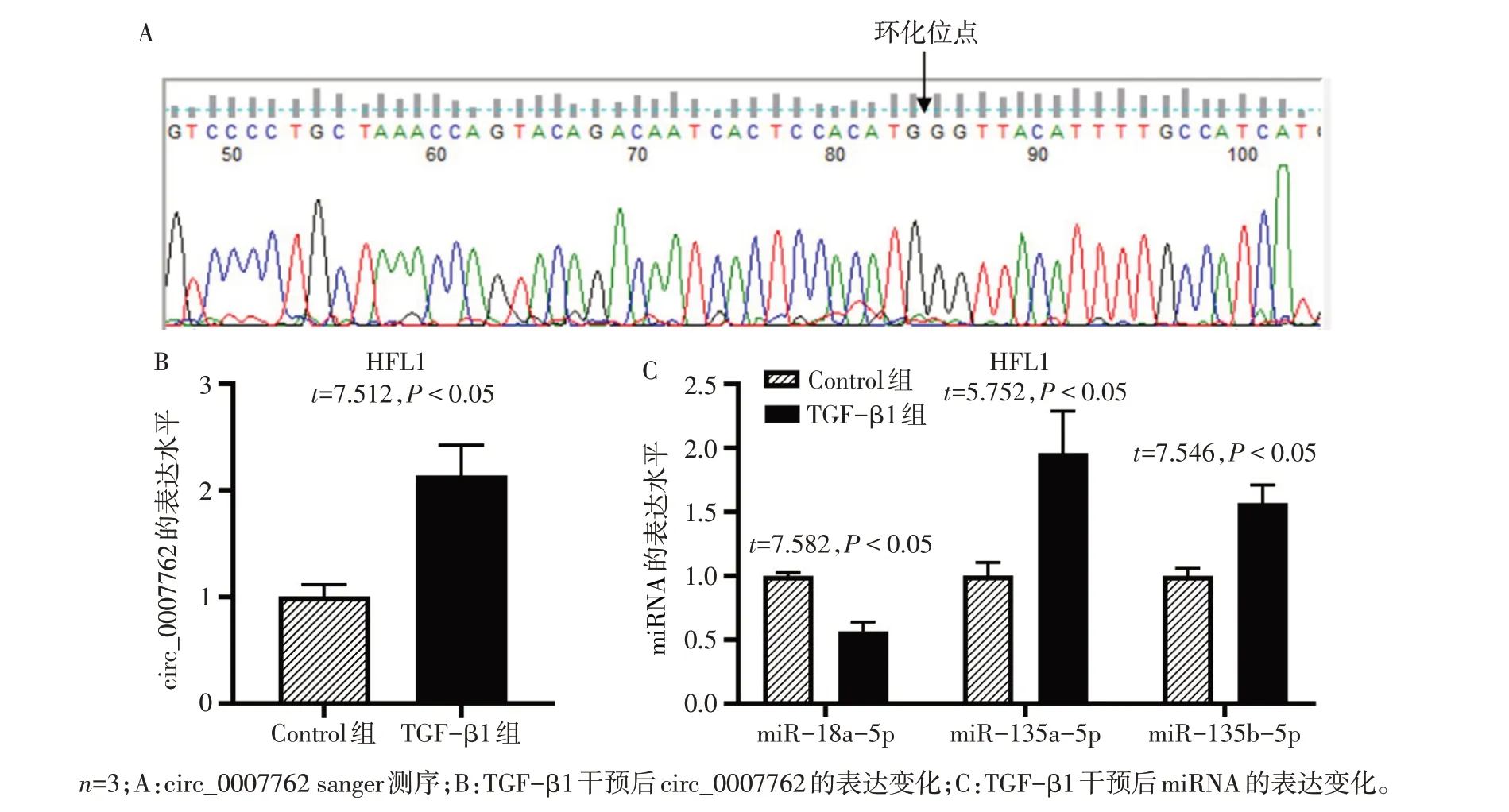
Fig.2 The cyclization site of circ_0007762 and changes of circ_0007762 and miRNAs after TGF-β1 intervention图2 circ_0007762环化位点及TGF-β1干预后HFL1细胞中circ_0007762及miRNA表达变化
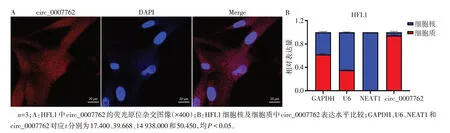
Fig.3 Subcellular localization of circ_0007762图3 circ_0007762亚细胞定位
2.5 敲低circ_0007762抑制肺成纤维细胞纤维化相关表型并激活自噬的作用及抑制miR-18a-5p 对其影响 Western blot 结果显示,在HFL1 细胞中,与Control组相比,TGF-β1干预后α-SMA、collagenⅠ表达升高;相反,siRNA 敲低circ_0007762 表达后α-SMA、collagenⅠ表达下降,纤维化受到抑制,并且其对α-SMA、collagenⅠ表达的影响可被miR-18a-5p的抑制所逆转(P<0.05),见图7、表4。相较于Control组,TGF-β1干预后P62表达降低,同时LC3BⅡ/Ⅰ升高,自噬活化;相反,siRNA 敲低circ_0007762 表达后P62 表达上调,同时LC3BⅡ/Ⅰ降低,自噬被抑制;并且si-circ_000776 对P62 及LC3BⅡ/Ⅰ表达的影响可因miR-18a-5p 的抑制所逆转(P<0.05),见图7、表4。
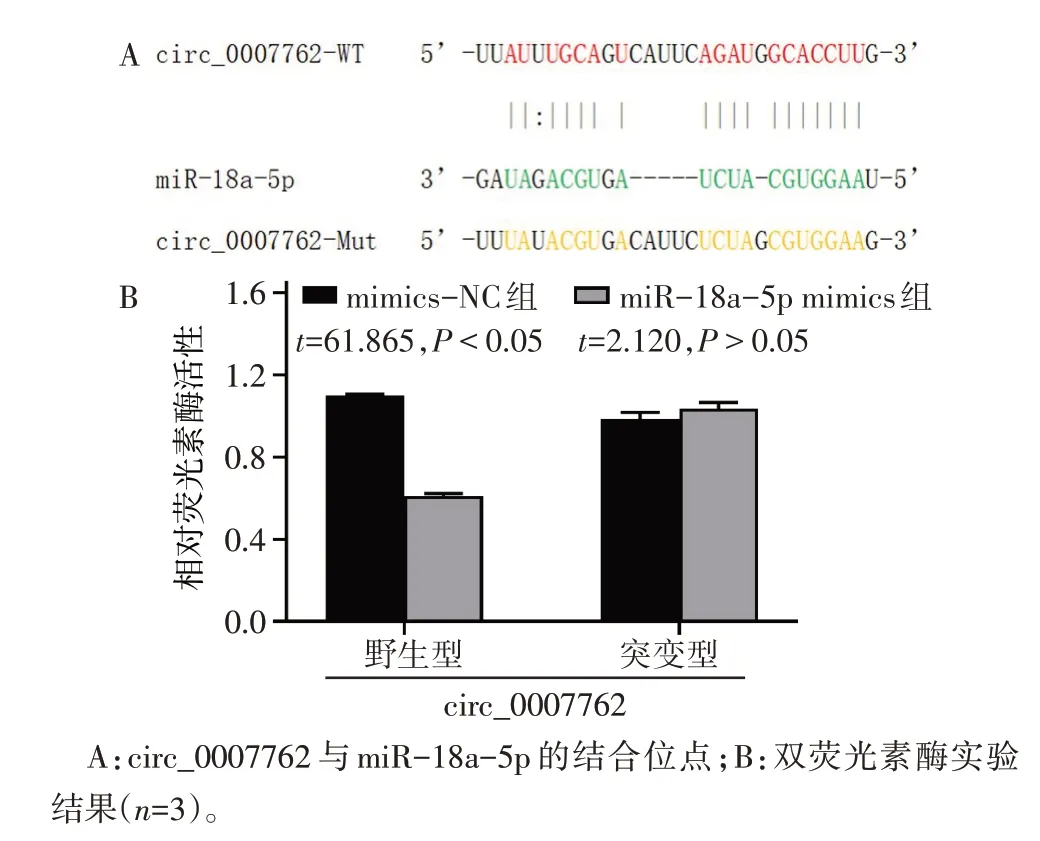
Fig.4 Binding sites of circ_0007762 to miR-18a-5p and results of dual-luciferase assay图4 circ_0007762与miR-18a-5p的结合位点及双荧光素酶检测结果
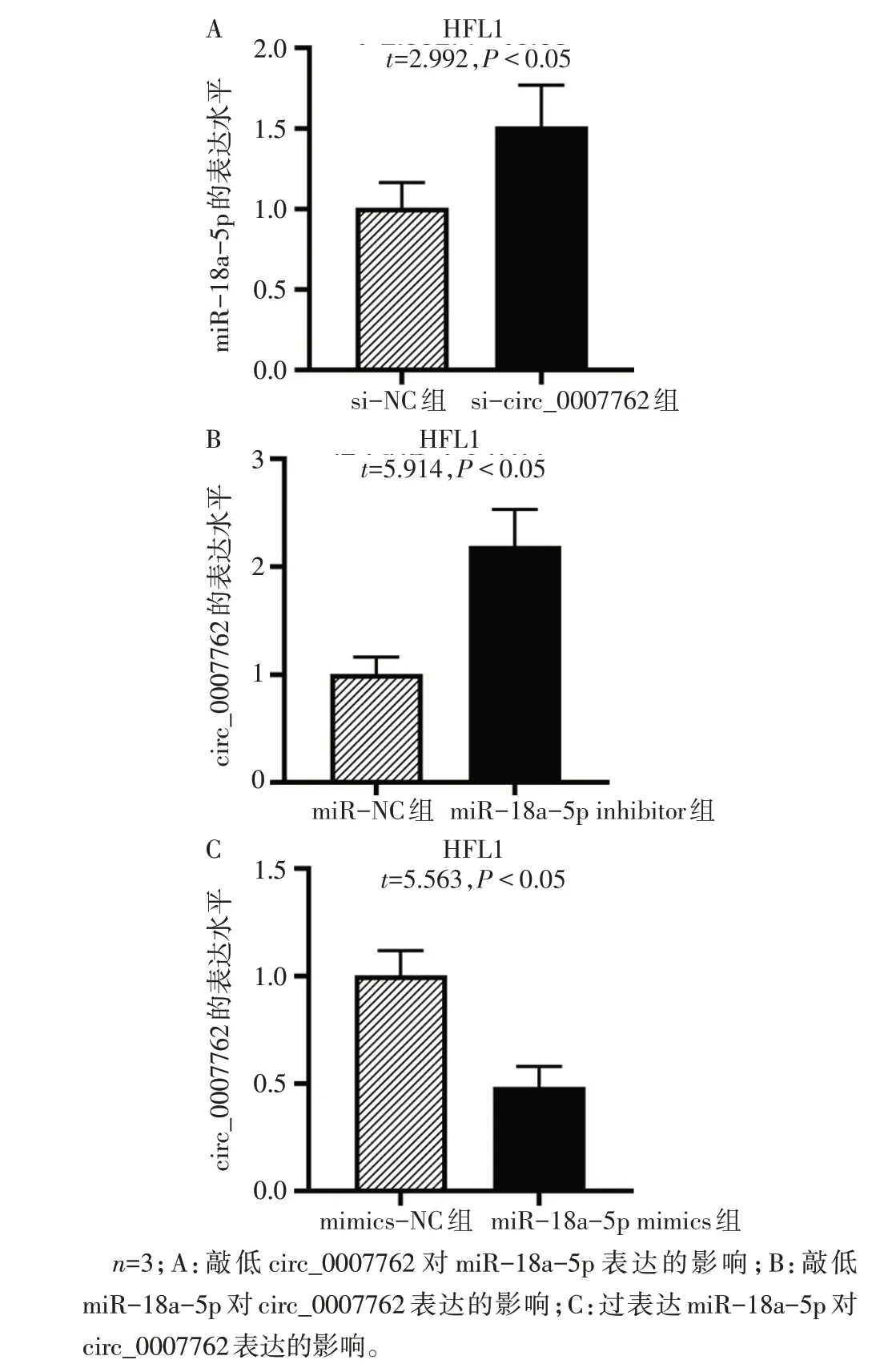
Fig.5 The interaction between circ_0007762 and miR-18a-5p图5 circ_0007762与miR-18a-5p的相互作用关系
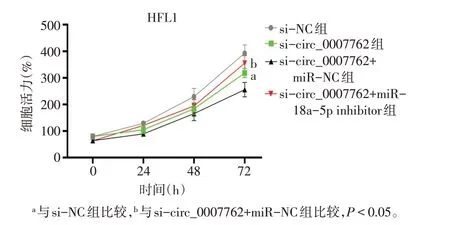
Fig.6 Effects of circ_0007762 and miR-18a-5p inhibition on HFL1 proliferation图6 抑制circ_0007762及miR-18a-5p表达对HFL1增殖的影响
Tab.3 Comparison of HFL1 cell viability between the four groups表3 各组间HFL1细胞活力差异(n=3,%,±s)
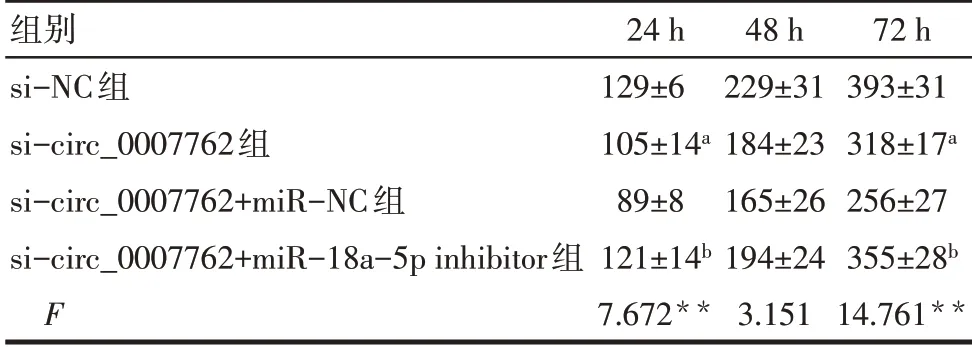
Tab.3 Comparison of HFL1 cell viability between the four groups表3 各组间HFL1细胞活力差异(n=3,%,±s)
**P<0.01,a 与si-NC 组比较,b 与si-circ_0007762+miR-NC 组比较,P<0.05。
组别si-NC组si-circ_0007762组si-circ_0007762+miR-NC组si-circ_0007762+miR-18a-5p inhibitor组F 24 h 129±6 105±14a 89±8 121±14b 7.672**48 h 229±31 184±23 165±26 194±24 3.151 72 h 393±31 318±17a 256±27 355±28b 14.761**
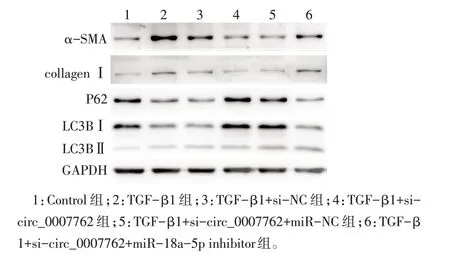
Fig.7 Effects of circ_0007762 and miR-18a-5p inhibition on protein expression in HFL1 cells图7 抑制circ_0007762及miR-18a-5p表达对HFL1细胞蛋白表达的影响
2.6 自噬抑制剂3-MA缓解了肺成纤维细胞增殖及纤维化表型 TGF-β1 加速了HFL1 细胞的增殖,而与TGF-β1+DMSO 组比较,3-MA 的 干预抑制了HFL1 细胞的增殖(P<0.05),见图8、表5。此外,TGF-β1+3-MA 组较TGF-β1+DMSO 组collagenⅠ、α-SMA 表达下调,LC3BⅡ/Ⅰ下降,而P62 表达上调,通过抑制细胞自噬缓解了纤维化(P<0.05),见图9、表6。
Tab.4 Comparison of autophagy and fibrosis related protein expression between the six groups表4 各组自噬及纤维化相关蛋白表达的比较 (n=3,±s)

Tab.4 Comparison of autophagy and fibrosis related protein expression between the six groups表4 各组自噬及纤维化相关蛋白表达的比较 (n=3,±s)
**P<0.01;a与Control组比较,b与TGF-β1+si-NC组比较,c与TGF-β1+si-circ_0007762+miR-NC组比较,P<0.05。
组别Control组TGF-β1组TGF-β1+si-NC组TGF-β1+si-circ_0007762组TGF-β1+si-circ_0007762+miR-NC组TGF-β1+si-circ_0007762+miR-18a-5p inhibitor组F α-SMA 1.00±0.02 2.46±0.21a 2.06±0.13 1.13±0.13b 1.04±0.15 1.96±0.11c 60.794**collagen Ⅰ1.00±0.00 2.31±0.20a 1.94±0.10 1.09±0.06b 1.36±0.15 2.63±0.09c 94.044**P62 1.00±0.01 0.47±0.07a 0.42±0.06 0.89±0.06b 0.81±0.13 0.40±0.11c 30.874**LC3BⅡ/Ⅰ1.00±0.03 2.80±0.17a 2.65±0.16 1.43±0.07b 1.68±0.41 3.88±0.34c 59.812**
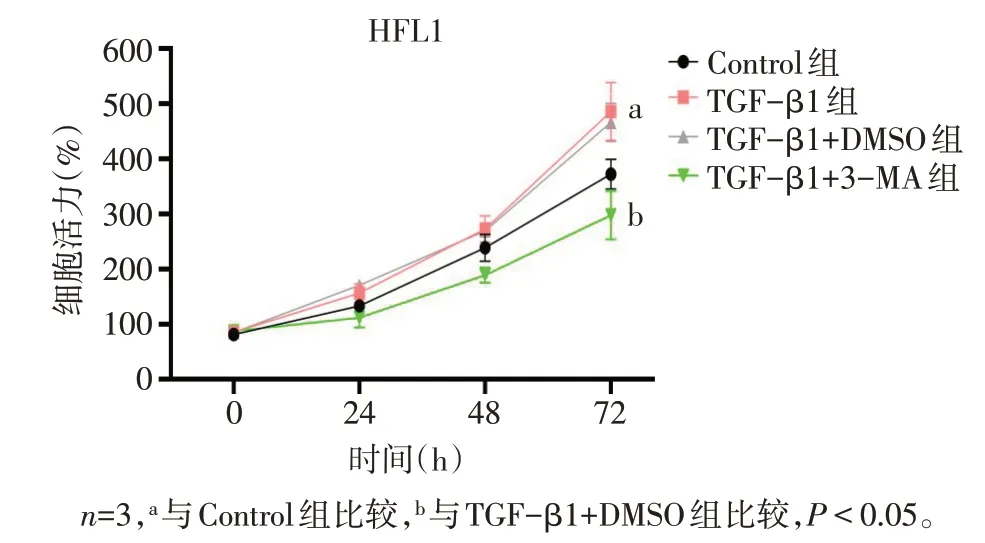
Fig.8 Effects of 3-MA on HFL1 proliferation induced by TGF-β1图8 3-MA对TGF-β1诱导的HFL1增殖的影响
Tab.5 Differences in HFL1 cell viability between the four groups表5 各组间HFL1细胞活力差异(n=3,%,±s)
Tab.5 Differences in HFL1 cell viability between the four groups表5 各组间HFL1细胞活力差异(n=3,%,±s)
**P<0.01;a与Control组比较,b与TGF-β1+DMSO组比较,P<0.05。
组别Control组TGF-β1组TGF-β1+DMSO组TGF-β1+3-MA组F 72 h 372±27 486±52a 466±35 297±44b 14.003**24 h 133±7 156±17 171±7 112±18b 11.450**48 h 238±24 273±24 269±9 189±14b 12.515**
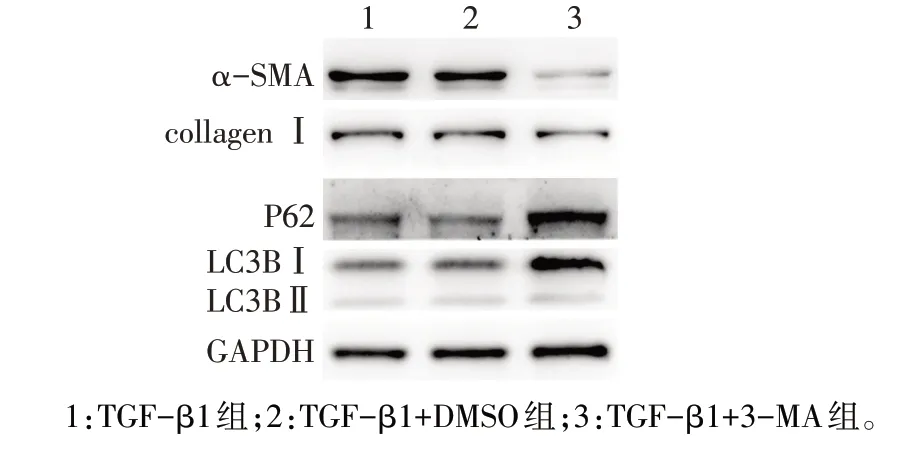
Fig.9 Effects of 3-MA on protein expression induced by TGF-β1 in HFL1 cells图9 3-MA对TGF-β1诱导的HFL1细胞蛋白表达的影响
Tab.6 Comparison of autophagy and fibrosis related protein expression between the three groups表6 各组自噬及纤维化相关蛋白表达水平比较(n=3,±s)
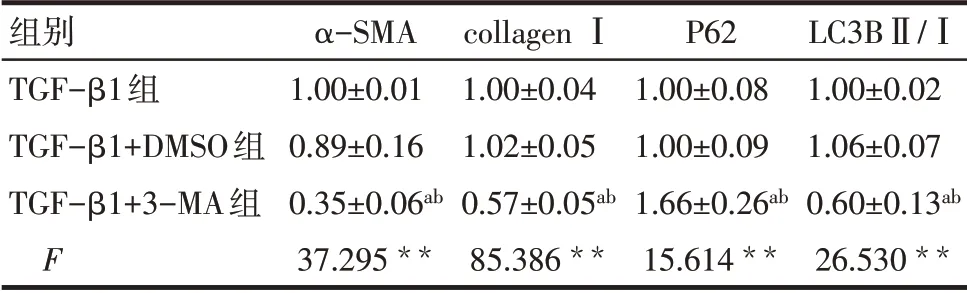
Tab.6 Comparison of autophagy and fibrosis related protein expression between the three groups表6 各组自噬及纤维化相关蛋白表达水平比较(n=3,±s)
**P<0.01;a与TGF-β1组比较,b与TGF-β1+DMSO组比较,P<0.05。
组别TGF-β1组TGF-β1+DMSO组TGF-β1+3-MA组F α-SMA 1.00±0.01 0.89±0.16 0.35±0.06ab 37.295**collagen Ⅰ1.00±0.04 1.02±0.05 0.57±0.05ab 85.386**P62 1.00±0.08 1.00±0.09 1.66±0.26ab 15.614**LC3BⅡ/Ⅰ1.00±0.02 1.06±0.07 0.60±0.13ab 26.530**
3 讨论
circRNA 与miRNA 的结合对IPF 进展起关键作用,近年多个研究发现该机制涉及IPF 中肺成纤维细胞功能异常。Zhang 等[8]发现circ_0044226 可充当miR-7的ceRNA,增强人胚肺细胞WI38细胞向肌成纤维细胞的转化。而circTADA2A作为miR-526b或miR-203 的ceRNA 可调控小窝蛋白1/2 的表达,抑制肺成纤维细胞的激活,减轻ECM 沉积并缓解IPF 进程[9]。Zhang 等[10]发现miR-18a-5p 在纤维化小鼠及胸膜间皮细胞中表达降低,并靶向抑制TGFβ 受体2 缓解类上皮间充质转化。本研究发现,miR-18a-5p 在TGF-β1 诱导的肺成纤维细胞中降低,可能是IPF 中重要的保护性因子。并且抑制circ_0007762可促进miR-18a-5p表达,而抑制miR-18a-5p 同样可上调circ_0007762 表达,两者呈负调控关系。双荧光素酶实验进一步揭示了两者的内源性结合。由此可见,circ_0007762 可充当miR-18a-5p 的ceRNA,通过负调控miR-18a-5p,作为重要的促纤维化因子,诱导肺成纤维细胞发生纤维化表型。
肺成纤维细胞对损伤修复至关重要,其异常激活对IPF进展最为关键[11]。肺成纤维细胞受促纤维化介质诱导而异常活化增殖,增强ECM 分泌,后者加速肌成纤维细胞分化(FMT)及ECM 合成的前馈循环,使肺纤维化程度持续加剧[12]。TGF-β1是IPF中最强的促纤维化因子,以往有报道其对肺泡上皮细胞及成纤维细胞增殖存在调控作用,可抑制肺泡上皮细胞增殖而促进成纤维细胞增殖[13-14]。本实验表明circ_0007762可促进HFL1细胞的活化与增殖,且该作用可被miR-18a-5p 所逆转,提示circ_0007762对细胞增殖调控部分是通过miR-18a-5p变化而实现的。
自噬是选择或非选择性对胞质物质进行降解的适应性过程,以巨噬、微噬和伴侣介导的自噬为主要的3 种类型[15-16]。大量证据揭示自噬参与IPF 的发病环节,但目前对两者的关系尚且存在争议。Hill等[17]认为在IPF 肺组织中自噬受损,抑制自噬可通过NF-κB/Snail2 通路促进类上皮间充质转化。然而,另有研究发现自噬正向调控TGF-β1 诱导的细胞纤维化过程;首先,自噬有助于肺泡巨噬细胞的凋亡抵抗,这是肺纤维化发展所必需的[18],其次,TGFβ1诱导IPF和非IPF肺成纤维细胞中collagenⅠ及纤连蛋白的生成,同时促进自噬体的积累,激活自噬通量[19]。此外,有报道阿奇霉素显著减少了TGF-β干预后的成纤维细胞胶原分泌,治疗过程伴随着溶酶体功能受损[20]。本研究证实TGF-β1 可激活自噬,并伴随胶原产生增强及α-SMA 这一肌成纤维细胞标志物升高,表明自噬可能参与肺纤维化早期的启动环节。此外,在circ_0007762 抑制后自噬受到抑制,HFL1 的FMT 改变得到改善,胶原分泌减少。而抑制circ_0007762 后上述受损过程同样可由miR-18a-5p 下调有所恢复,这揭示circ_0007762 参与自噬的活化,能激活肺成纤维细胞增殖,抵抗FMT 变化,并且该过程一定程度上受miR-18a-5p影响。总体来看,自噬在IPF肺组织与TGF-β1诱导的纤维化模型的差异性可能由两者所处病程的不同来解释,细胞模型更趋于纤维化早期发展,而IPF 肺组织样本则呈现纤维化终末期变化,其中可能存在微环境的适应过程。非IPF 来源的肺成纤维细胞对collagenⅠ敏感,在应激时凋亡增加,而IPF成纤维细胞因长期暴露于该微环境导致对collagenⅠ脱敏[21]。此外,自噬还参与细胞增殖的调控,有研究发现3-MA可抑制骨分化和增殖,自噬激活剂雷帕霉素则可增强成骨分化和增殖[22]。同时自噬介导了接触抑制所致的增殖减少[23]。本研究中,在使用3-MA 阻断自噬通量后,HFL1 增殖活性受抑制,这揭示了自噬可以促进肺成纤维细胞的活化增殖。
综上所述,本研究证明circ_0007762 可作为miR-18a-5p的ceRNA,通过激活自噬活化肺成纤维细胞增殖,加速FMT,诱导纤维化表型,为理解circ_0007762 介导的肺纤维化机制提供了新的信息。然而,本研究仅通过体外验证circ_0007762 及miR-18a-5p 对肺成纤维细胞的影响,IPF 的病变过程涉及多细胞功能失调,除成纤维细胞外,还累及肺泡上皮细胞及巨噬细胞等。此外,circ_0007762 改变在体内的效应可能不同于体外,这需要进一步研究。

