Wnt 5a在支气管肺发育不良模型中的作用机制探讨
李羽白,王军△,殷静
支气管肺发育不良(broncho-pulmonary dysplasia,BPD)是极早产儿常见的不良结局。随着孕妇糖皮质激素以及早产儿肺泡表面活性物质替代疗法的广泛应用,早产儿存活率显著提高,但BPD发病率逐年上升[1]。已有研究表明Wnt信号通路在早期肺发育和肺部疾病中至关重要[2],但Wnt 5a 作为Wnt 信号通路中的关键因子在BPD中的作用鲜有报道。本研究采用Western blot 和胸腺嘧啶脱氧核苷类似物(EdU)染色法检测BPD细胞和动物模型中肺泡表面标志物表面活性蛋白C(SPC)、水通道蛋白5(AQP5)、Wnt 5a 蛋白表达水平以及细胞增殖能力的变化,初步探讨Wnt 5a在BPD发生发展中的作用及意义。
1 材料与方法
1.1 材料与试剂 人非小细胞肺癌细胞A549细胞系购自美国ScienCell Research Laboratiories 公司;SD 孕鼠购自浙江维通利华实验动物技术有限公司[动物生产许可证号:SCXK(浙)2019-0001];胎牛血清、F12培养基、青霉素/链霉素溶液(Gibco,美国);蛋白裂解液RAPI、蛋白酶抑制剂Cocktail(Servicebio,中国);BCA 蛋白浓度测定试剂盒及BeyoClickTMEdU-488 细胞增殖检测试剂盒(Beyotime,中国);兔源一抗SPC 抗体(Affinity,美国);兔源一抗AQP5 抗体(Bioworld,美国);兔源一抗Wnt 5a 抗体及鼠源一抗GAPDH 抗体(Proteintech,美国);辣根过氧化物酶标记的山羊抗兔二抗、辣根过氧化物酶标记的山羊抗鼠二抗(Servicebio,中国);Wnt 5a抑制剂HY-123071(MCE,中国)。
1.2 方法
1.2.1 细胞培养 A549 细胞采用含10%胎牛血清和1%青霉素/链霉素溶液的F12培养基于37 ℃、5%CO2中进行培养。在6 孔板中按照2×105个/孔种植细胞,24 h 细胞贴壁后将细胞分成2 部分。第一部分分2 组:对照组、BPD 组;第二部分分3 组:对照组、BPD 组、BPD+Wnt 5a 抑制剂组,Wnt 5a 抑制剂终浓度为5µmol/L。BPD 组和BPD+Wnt 5a 抑制剂组置于37 ℃、85%O2敷箱中培养48 h,对照组置于37 ℃、5%CO2的敷箱中培养48 h。
1.2.2 动物模型制备 将2 只SD 孕鼠所产的仔鼠按随机数字表法分为对照组和BPD 组(各5 只)。BPD 组新生大鼠连同母鼠置于85%O2的密闭塑料箱中,温度25~26 ℃、CO2体积分数<50%(碱石灰吸收CO2)、湿度50%~60%、每日开箱1 h添加水、饲料,更换垫料。对照组同母鼠置于同一室内环境(25~26 ℃、21%O2)中,其余条件同高氧保持不变。
1.2.3 标本的采集和处理 在BPD 组SD 大鼠高氧环境7 d后,2组大鼠行10%水合氯醛(0.05 mL/10 g)腹腔注射麻醉取肺。每只大鼠肺组织来源样品分为2份:1份为200 mg,用于组织蛋白提取;剩余组织置于组织冻存管,-80 ℃冰箱冻存备用。对照组A549细胞在孵育72 h后,BPD组及BPD+Wnt 5a抑制剂组在高氧48 h后收取细胞,用蛋白裂解液和蛋白酶抑制剂提取蛋白。
1.2.4 肺组织形态学观察 经HE 染色、扫描后使用CaseViewer软件观察2组大鼠肺组织形态学变化。
1.2.5 细胞和肺组织SPC、AQP5、Wnt 5a 蛋白表达检测 将细胞及大鼠肺组织提取的蛋白测定蛋白浓度后,取30µg 变性蛋白进行Western blot:使用浓度为12%的SDS-PAGE分离目标蛋白质,然后通过湿转将蛋白转移至PVDF 膜中;用5%的脱脂奶粉室温封闭2 h,1×TBST洗涤5 min后将PVDF膜置于经推荐稀释浓度稀释后的一抗中,4 ℃孵育过夜;1×TBST洗涤10 min×3次后将PVDF膜置于二抗中,室温下孵育2 h;再次1×TBST洗涤10 min×3次后经化学发光(ECL)采集图像。
1.2.6 细胞增殖水平检测 采用EdU细胞增殖检测试剂盒,严格按照试剂盒说明书操作。经EdU 与Hoechst 染色后,在荧光显微镜下观察细胞并采集照片,增殖细胞呈现绿色荧光。每组选取5 张照片,使用Image J 软件对结果进行量化(n=5):阳性细胞率=EdU 荧光染色细胞数/总细胞数×100%,然后将其标化统计。
1.3 统计学方法 采用GraphPad Prime 8 软件进行数据分析。数据均以±s表示。2 组间均数比较采用t检验,多组间比较使用单因素方差分析,组间多重比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组A549细胞SPC、AQP5蛋白表达量比较 A549细胞在高氧造模48 h 后SPC、AQP5 表达量降低,提示在BPD 组中肺泡Ⅰ型上皮和肺泡Ⅱ型上皮受损,见图1。
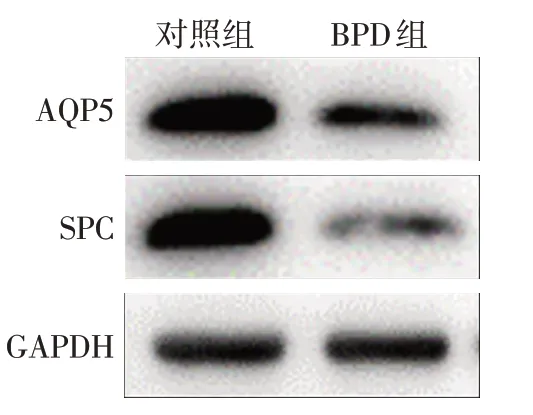
Fig.1 Changes of SPC and AQP5 expression levels in BPD cell model图1 BPD细胞模型SPC、AQP5表达量变化
2.2 2组A549细胞增殖能力比较 与对照组相比,BPD组阳性细胞率(标化后)小于对照组阳性细胞率(0.42±0.08vs.0.83±0.10,t=7.214,P<0.01,n=5),高氧造模显著抑制了A549细胞的生长,见图2。
2.3 2组A549细胞Wnt 5a蛋白表达量比较 Western blot 结果显示,A549 细胞在高氧造模48 h 后Wnt 5a表达量升高,提示Wnt 5a信号通路在BPD细胞模型中被激活,见图3。
2.4 BPD动物模型中肺组织病理改变 结果显示,BPD组较对照组肺泡面积增大、肺泡数量减少、肺泡间隔明显增宽,BPD 高氧造模破坏了肺泡的形态功能,见图4。
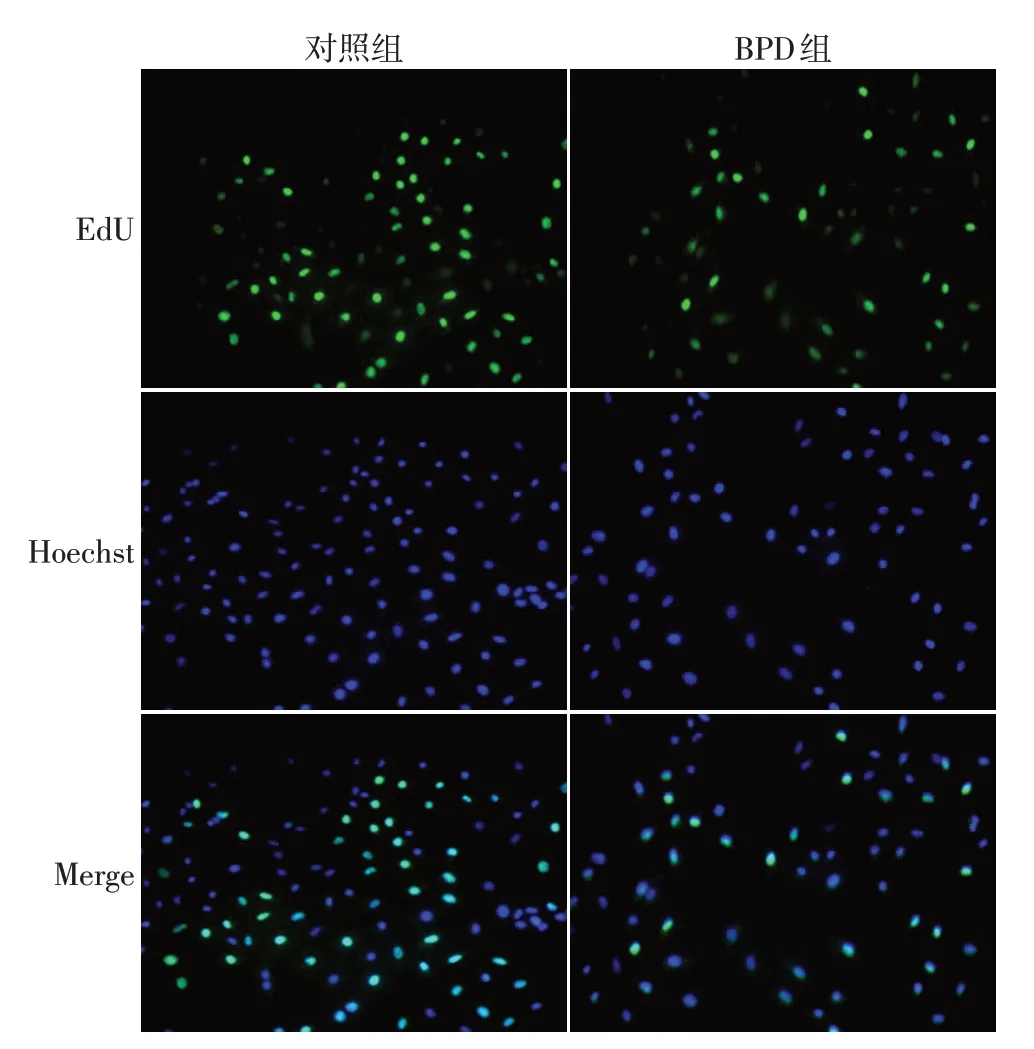
Fig.2 EdU changes in BPD cell model(×200)图2 BPD细胞模型EdU变化(×200)
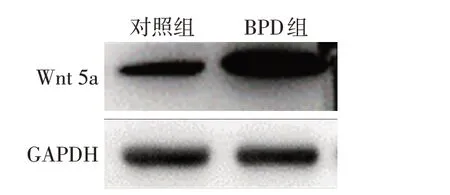
Fig.3 Changes of Wnt 5a expression levels in BPD cell model图3 BPD细胞模型Wnt 5a表达量变化
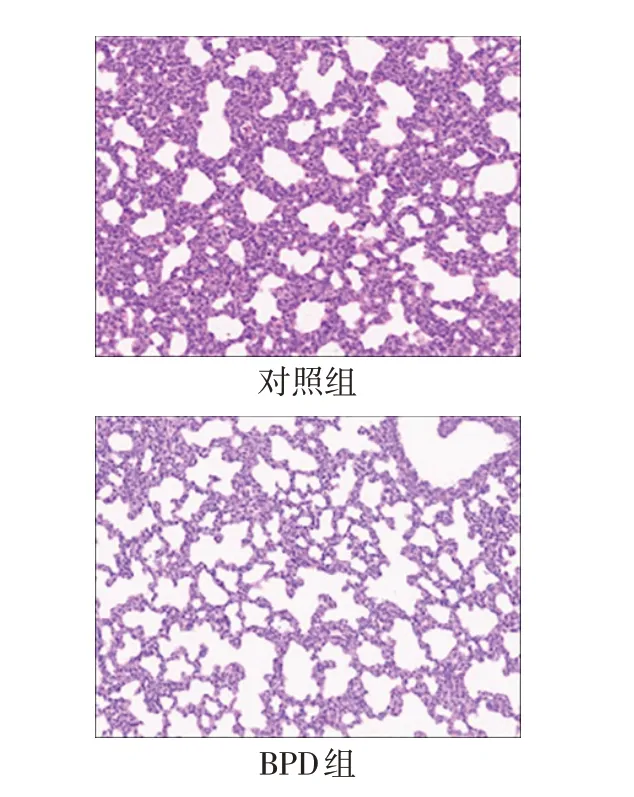
Fig.4 Pathological sections of rat lung tissue in the control group and BPD group(HE,×200)图4 对照组与BPD组大鼠肺组织病理切片(HE,×200)
2.5 2组大鼠肺组织SPC、AQP5、Wnt 5a蛋白表达水平比较 Western blot 结果显示,BPD 组SPC、AQP5蛋白表达量均低于对照组,而Wnt 5a蛋白表达高于对照组,与在细胞水平观察结果一致,见图5。
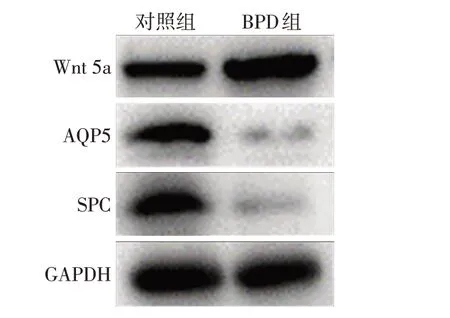
Fig.5 Changes of expression levels of SPC,AQP5 and Wnt 5A in BPD animal model图5 BPD动物模型中SPC、AQP5、Wnt 5a表达量变化
2.6 Wnt 5a 抑制剂对BPD 细胞模型Wnt 5a、SPC、AQP5 蛋白表达的影响 Western blot 结果显示,与BPD 组相比,BPD+Wnt 5a 抑制剂组A549 细胞Wnt 5a 蛋白表达量降低,SPC、AQP5 蛋白表达量增高,见图6。
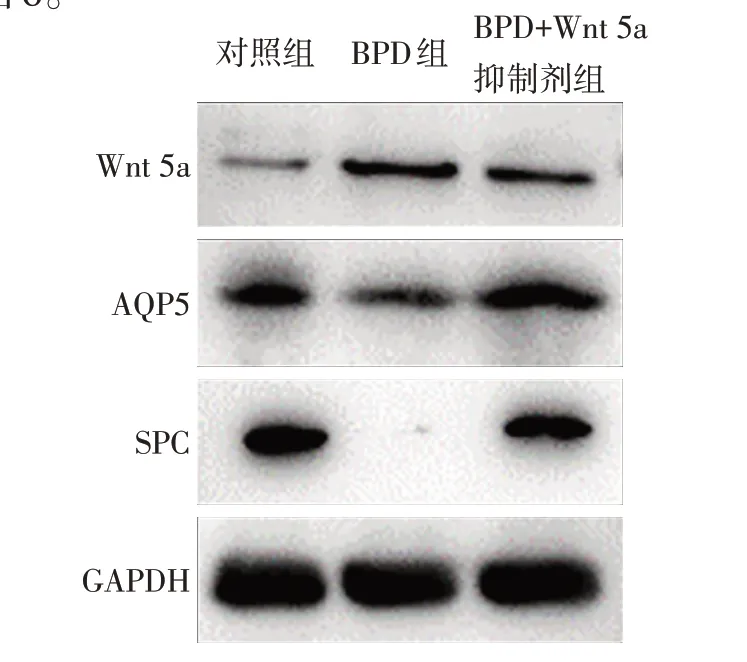
Fig.6 Expression changes of Wnt 5A,SPC and AQP5 in BPD cell model after treatment with Wnt 5a inhibitor图6 应用Wnt 5a抑制剂后BPD细胞模型Wnt 5a、SPC、AQP5表达量变化
2.7 应用Wnt 5a抑制剂后各组A549细胞增殖能力比较 细胞增殖实验结果显示,经量化后对照组、BPD 组、BPD+Wnt 5a 抑制剂组阳性细胞率分别为0.81±0.12、0.36±0.09、0.52±0.01,差异有统计学意义(F=34.270,P<0.01)。对照组EdU荧光染色细胞数/总细胞数阳性细胞率大于BPD 组(P<0.01);BPD+Wnt 5a 抑制剂组较BPD 组升高(P<0.05)。可见在高氧造模条件下阻断Wnt 5a 信号通路后肺泡上皮细胞损伤减小,细胞增殖能力恢复,见图7。
3 讨论
3.1 防治BPD 的重要性 有调查显示2017 年江苏省19 家医院胎龄<34 周早产儿BPD 的发病率为24.9%[3],是国内2006—2008 年10 家医院回顾性调查的发病率(4.2%)的4.9倍[4]。因此,BPD仍然是婴幼儿健康的一大威胁。感染、炎症、胎儿生长受限、孕妇并发子痫前期、机械通气和氧疗、动脉导管未闭以及遗传因素等被认为是BPD 的高危影响因素,但具体发病机制仍不清楚[1]。严重BPD患儿可因呼吸衰竭而死亡[5]。存活的BPD患儿在儿童期也更易发生感染和肺功能下降[6]。Wnt 5a在早期肺发育及肺部疾病中发挥重要作用,但Wnt 5a在BPD中的研究却鲜有报道,探究Wnt 5a在BPD模型中的作用可能为防治BPD提供新思路。
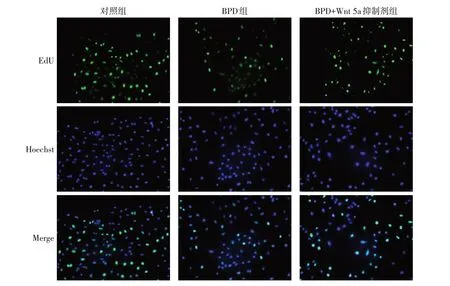
Fig.7 EdU changes in BPD cell model after treatment with Wnt 5a inhibitor(×200)图7 应用Wnt 5a抑制剂后BPD细胞模型EdU变化(×200)
3.2 Wnt 5a 蛋白广泛参与肺发育及肺部疾病的发生 Wnt 信号通路是早期肺发育、肺泡形成及损伤修复的重要调控途径,依据是否激活β 连环素分为β 连环素依赖的Wnt 经典信号通路和非β 连环素依赖的Wnt非经典信号通路。Wnt 5a是非经典Wnt信号通路的配体之一,广泛参与肺形态的形成和肺部疾病的发生。在肺发育早期,Wnt 5a 缺失会导致远端气道分支过多,而Wnt 5a过表达可干扰正常上皮间充质相互作用,导致远端气道分支和扩张减少[7]。在小鼠脓毒症致新生小鼠肺发育急性肺损伤中,血清Wnt 5a 水平随肺损伤严重程度加深而升高[8];在小鼠哮喘肺组织中Wnt 5a mRNA 和蛋白水平升高[9];同时,慢性阻塞性肺疾病和肺纤维化时Wnt 5a表达亦升高[10-11]。
3.3 Wnt 5a 在BPD 造模过程中异常激活 Wnt 5a在肺发育早期和肺疾病中的作用提示其可能参与了BPD的发生发展。本研究通过高氧诱导的BPD细胞和动物模型来模拟疾病在人体中的表现,高氧对新生大鼠和A549 细胞的刺激常用于制作实验性动物模型和细胞模型。肺的发育分为胚胎期、假腺期、小管期、囊状期和肺泡期5 个阶段。新生大鼠肺发育相当于极早产儿肺发育的囊状期,将新生大鼠用于制作动物模型符合早产儿发生BPD 的病理条件[12]。通过Western blot 和EdU细胞增殖实验发现,在BPD细胞模型和动物模型中AQP5 和SPC 蛋白表达量降低,Wnt 5a 蛋白表达量升高,细胞增殖能力减弱。AQP5 和SPC 分别为肺泡Ⅰ型上皮细胞(AECⅠ)和AECⅡ表面标志蛋白,其表达量变化反映AECⅠ和AECⅡ损伤修复的变化[13]。在应用Wnt 5a抑制剂后AQP5、SPC 蛋白表达量有所升高,细胞增殖能力也有所恢复。上述结果提示在高氧造成的肺泡上皮细胞损伤过程中Wnt 5a 信号通路被激活,表明Wnt 5a异常激活参与了BPD 的发生发展,同时也为防治BPD提供了新思路。在85%高氧造模的动物模型和对照组动物病理切片中,高氧动物模型肺组织肺泡面积增大,肺泡数量减少,肺泡间隔明显增宽,同以往研究结论一致[14],提示BPD 的动物造模成功。在既往研究中发现,AECⅡ可作为肺泡上皮细胞的祖细胞,在肺泡上皮细胞受到损伤后AECⅡ可向AECⅠ转化,是BPD肺组织损伤修复的重要机制,即SPC表达降低、AQP5表达增加[15]。这与本研究结果不一致,可能是因为损伤中后期AECⅡ向AECⅠ转化不足以代偿AECⅠ的损伤,导致AECⅠ、AECⅡ在高氧后同时受损。
Wnt 5a可通过非经典Wnt信号通路或者抑制经典信号通路发挥作用,但本研究未能进一步阐明Wnt 5a 在BPD 模型中如何发挥作用,这也将是后续研究中需要探究的问题。

