大鼠缺血性脑卒中早期miR-27a表达与铁死亡的关系
张婧,孙辉,朱礼军,冯子人,杜琳,孟爱国
2020 年我国40岁以上人群中卒中患者约1 780万人,其中新发脑卒中患者高达340万人[1]。临床上针对缺血性脑卒中的治疗主要为药物溶栓疗法和手术取栓治疗[2],因时间窗等因素限制,只有少数患者可从中获益。铁死亡(Ferroptosis)是近年来新发现的一种非细胞凋亡性的程序性细胞死亡方式,是铁依赖性的脂质过氧化物积累的结果[3]。研究发现,铁死亡在神经系统性疾病的发生发展过程中发挥重要作用,调控细胞铁死亡可能会成为预防和治疗脑卒中的新方法[4-5]。微小RNA(miRNA,miR)主要与靶基因mRNA的3'-非编码区结合,通过降解靶基因mRNA或抑制其翻译来控制靶基因在转录水平的表达[6]。本课题组前期研究表明,miRNA 参与调节了缺血性脑损伤的进展,且miRNA表达的动态变化与脑组织损伤进展密切相关[7-8]。另有研究发现,在大鼠脑皮层神经元拟缺血损伤模型中,miR-27a 参与缺血性脑血管疾病发病过程[9]。然而miR-27a在其中具体的作用机制尚不清楚。本研究采用大鼠大脑中动脉栓塞(MCAO)模型,观察miR-27a 表达及铁死亡变化情况,探讨两者间的关系。
1 材料与方法
1.1 实验动物 8 周龄SPF 级雄性SD 大鼠88 只,体质量250~280 g,购自北京华阜康科技有限公司,生产许可证号:SCXK(京)2020-0004;大鼠饲养于华北理工大学实验动物中心,使用许可编号:SYXK(冀)2015-0038。
1.2 试剂与仪器 线栓(L0000)购自广州佳灵生物技术有限公司;ago-miR-27a 以及antago-miR-27a 购自广州锐博生物科技有限公司;二甲基亚砜(DMSO)购自梯希爱(上海)化成工业发展有限公司,铁死亡特异性抑制剂Ferrostatin-1(纯度≥90%,17729)购自美国Cayman Chemical公司;TTC溶液购自北京雷根生物技术有限公司;谷胱甘肽过氧化物酶4(GPX4)一抗购自武汉ABclonal 公司;β-actin 一抗购自北京博奥森;辣根过氧化物酶标记的抗兔IgG 二抗购自北京中杉金桥;超敏ExPlus ECL化学发光检测试剂购自北京庄盟国际生物基因科技有限公司;谷胱甘肽(GSH)、组织铁和丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;RNA提取试剂盒购自北京金百特生物技术有限公司;反转录试剂盒(ZR102-1)、2×SYBR qPCR Mix(荧光定量)试剂盒(ZF102-2)购自北京庄盟国际生物基因科技有限公司。
1.3 分组及给药 将88只大鼠按随机数字表法分成以下11组,每组8 只。实验1 设正常(control)组、假手术(Sham)组、模型组(按照缺血时间不同,分为6 h组、12 h组、24 h组、48 h组)。实验2设缺血48 h组(I 48 h组)、缺血48 h+Ferrostatin-1 组(I 48 h+Fer-1 组,于手 术 前2 h 腹腔注射0.5 mL 的Ferrostatin-1,按2 mg/kg 给药)、缺血48 h+DMSO 组(I 48 h+DMSO组,于手术前2 h腹腔注射0.5 mL DMSO)。实验3设缺血48 h 组(I 48 h 组)、I 48 h+阴性对照(NC)组、缺血48 h+miR-27a激动剂组(I 48 h+ago-miR-27a组)、缺血48 h+miR-27a抑制剂组(I 48 h+antago-miR-27a组);于术前7 d开始向侧脑室分别注射阴性对照试剂(20 µmol/L)、ago-miR-27a(20 µmol/L)、antago-miR-27a(20 µmol/L),每日1 次,连续5 d,给药量为5µL。术后48 h处死大鼠并取材。
1.4 大鼠造模 利用2%戊巴比妥钠(30 mg/kg)腹腔麻醉动物。麻醉满意后行颈正中切口,充分暴露颈动脉后,小心将迷走神经与颈总动脉分离,结扎颈总动脉和颈外动脉,线栓经颈内动脉至大脑中动脉,形成大鼠半脑缺血。所有手术均为左侧大脑中动脉栓塞,模型组的缺血时间分别为6、12、24、48 h,经药物干预的大鼠缺血时间为48 h。假手术组只经颈正中切口,不栓塞大脑中动脉。成功造模标志:术后清醒但不能直线行走,出现右侧偏瘫,神经功能学评分1~4分。
1.5 脑组织TTC染色 大鼠在脑缺血后相应时间点,立即处死并于冰上取脑组织,迅速放入-20 ℃冰箱冷冻30 min,其后将冷冻的大鼠脑组织切成2 mm 厚的5个冠状切片。随后将脑片置于TTC 溶液中,37 ℃放置15 min,翻面继续于TTC 染液中避光浸染15 min。染色完成后,脑组织通过4%多聚甲醛固定1 d,后拍照留存。使用Image J 软件进行分析以计算大鼠的脑梗死面积,用梗死面积的百分比(%)表示。缺血区面积比=(脑切片白色缺血区域面积)/(脑切片总面积)×100%。
1.6 Western blot检测GPX4蛋白表达 称取冻存的脑组织,每50 mg加入0.2 mL组织裂解液(每1 mL组织裂解液中加入0.01 mL 的蛋白酶抑制剂)进行组织蛋白提取。待蛋白提取完成后,对其进行SDS-PAGE,后将胶中蛋白转到PVDF 膜上。5%脱脂牛奶封闭2 h,洗膜后于GPX4 抗体(1∶1 000)中4 ℃孵育过夜。加入含有辣根过氧化物酶的二抗(1∶5 000)室温孵育2 h,滴加配置好的ECL显色液,后通过全自动化学发光图像分析仪扫描并保存结果图像。经Image J 软件分析所显出的蛋白图像灰度值,以β-actin作为内参蛋白,计算出目的蛋白的相对表达量。
1.7 脑组织GSH、组织铁和MDA 含量检测 称取0.1 g脑组织,加入0.9 mL 的匀浆介质,冰水浴中剪碎、研磨,制成10%的匀浆液,2 500 r/min离心15 min,吸取上清液。严格按照检测试剂盒说明进行相应操作,计算GSH、组织铁和MDA含量。
1.8 qPCR 检测miR-27a 的相对表达量 根据RNA 提取试剂盒说明书,严格进行大鼠脑组织中总RNA的提取,在波长为260 nm 和280 nm 处测量吸光度,计算RNA 纯度和总量。经反转录后得到cDNA,保存于-20 ℃冰箱。使用qPCR法进行扩增,扩增引物序列见表1。PCR条件:94 ℃预变性3 min;94 ℃15 s,60 ℃30 s,72 ℃30 s,40 个循环;72 ℃7 min。选择U6 snRNA 作为miR-27a 检测的标准化内参,使用相对定量2-ΔΔCt的循环阈值法计算miR-27a的相对表达量。
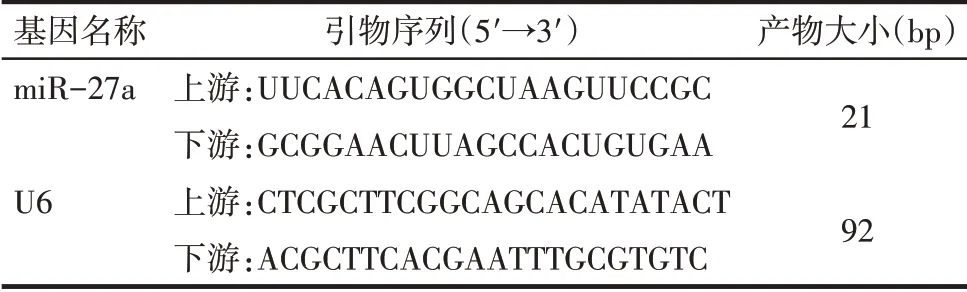
Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.9 统计学方法 采用SPSS 17.0 对结果进行统计学分析,计量数据以均数±标准差(±s)表示,结果数据符合正态分布,多组结果比较用单因素方差分析,多重比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠缺血性脑卒中早期脑组织中miR-27a 表达及铁死亡水平变化 与Sham组比较,各模型组大鼠神经功能评分增加(P<0.05),提示造模成功,见图1A。与Sham组比较,随着缺血时间的延长,各模型组脑组织中miR-27a的表达增多,GPX4和GSH含量下降,组织铁和MDA 的含量升高(P<0.05)。其中在缺血48 h 组变化最为明显,在后续实验中选择此时点进行缺血干预。与Control组相比,Sham组中上述结果变化差异无统计学意义。见图1、2,表2。
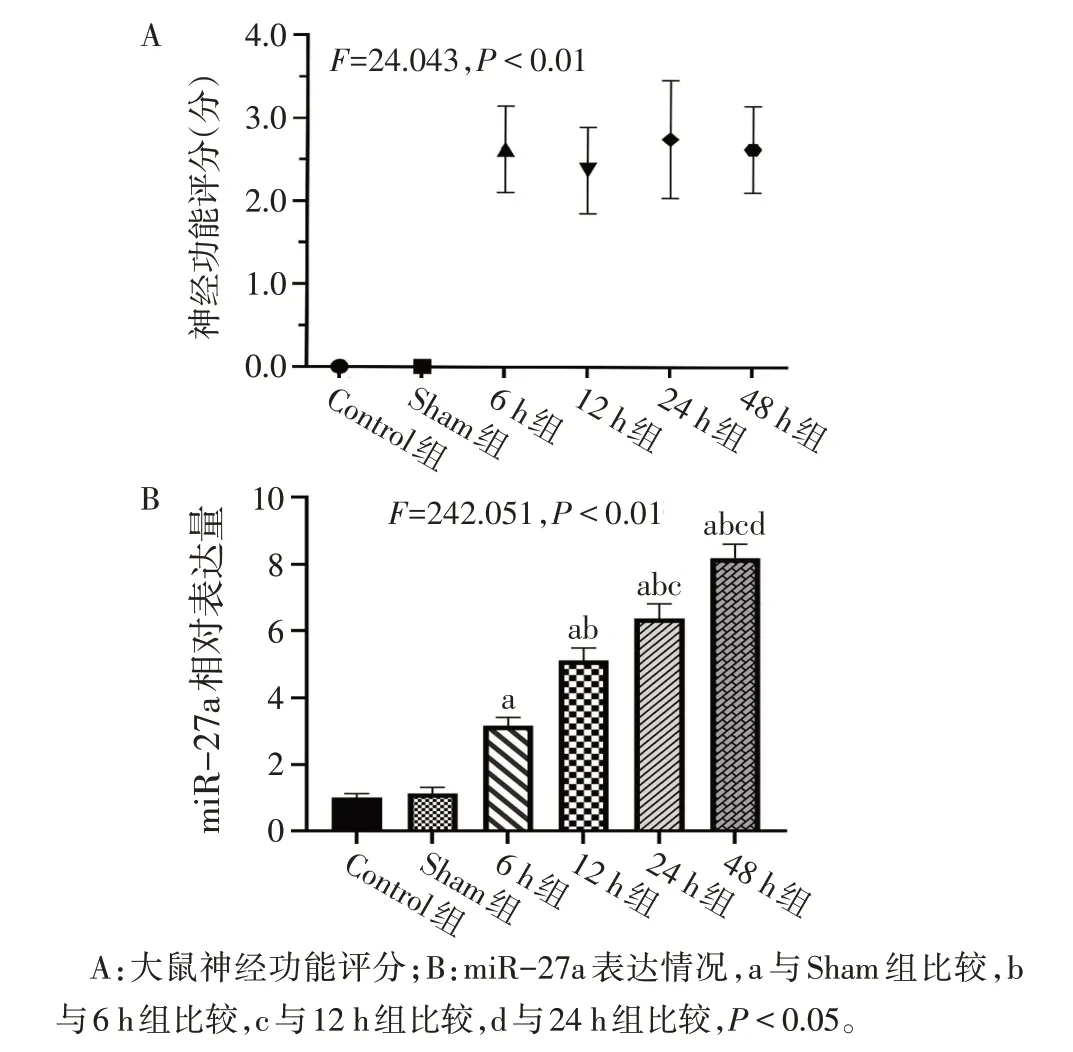
Fig.1 Neurological function score and miR-27a expression in each group of rats图1 各组大鼠神经功能评分和miR-27a表达情况
Tab.2 Comparison of GSH,Fe and MDA between the six groups of rats表2 6组中GSH、Fe及MDA水平比较(n=8,±s)
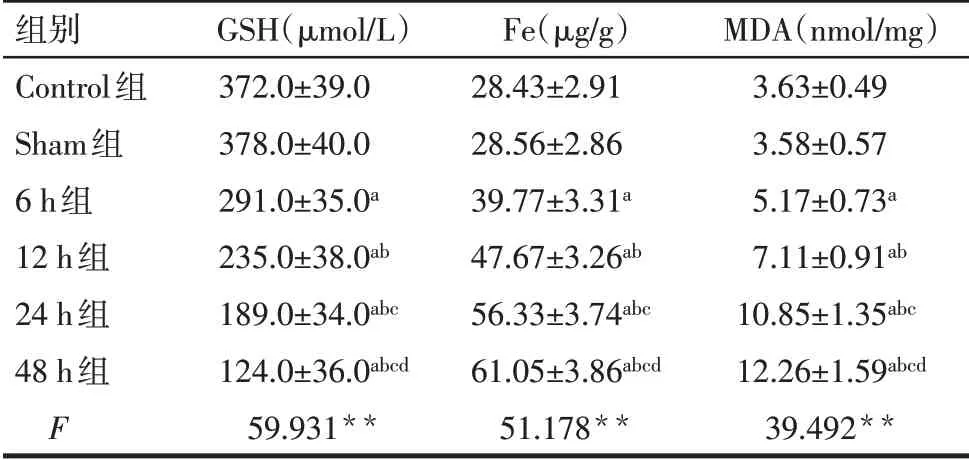
Tab.2 Comparison of GSH,Fe and MDA between the six groups of rats表2 6组中GSH、Fe及MDA水平比较(n=8,±s)
**P<0.01;a与Sham 组比较,b与6 h 组比较,c与12 h 组比较,d与24 h组比较,P<0.05。
组别Control组Sham组6 h组12 h组24 h组48 h组F GSH(µmol/L)372.0±39.0 378.0±40.0 291.0±35.0a 235.0±38.0ab 189.0±34.0abc 124.0±36.0abcd 59.931**Fe(µg/g)28.43±2.91 28.56±2.86 39.77±3.31a 47.67±3.26ab 56.33±3.74abc 61.05±3.86abcd 51.178**MDA(nmol/mg)3.63±0.49 3.58±0.57 5.17±0.73a 7.11±0.91ab 10.85±1.35abc 12.26±1.59abcd 39.492**
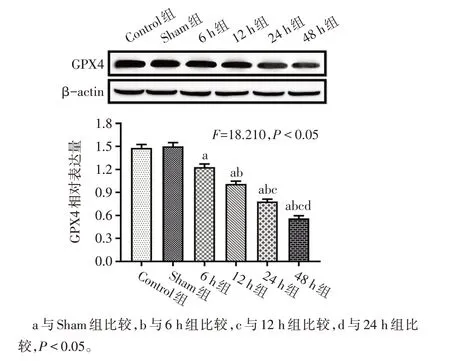
Fig.2 Expression of GPX4 protein in brain tissues of rats in each group of rats图2 各组大鼠脑组织GPX4蛋白表达情况
2.2 Ferrostatin-1 可减轻缺血性脑卒中大鼠早期脑组织损伤 与I 48 h+DMSO 组比较,I 48 h+Fer-1 组大鼠脑梗死面积减小(P<0.01),同时GPX4 和GSH表达升高(P<0.05),而组织铁及MDA 含量减少(P<0.05);与I 48 h 组相比,I 48 h+DMSO 组变化差异无统计学意义(P>0.05)。见图3、4,表3。
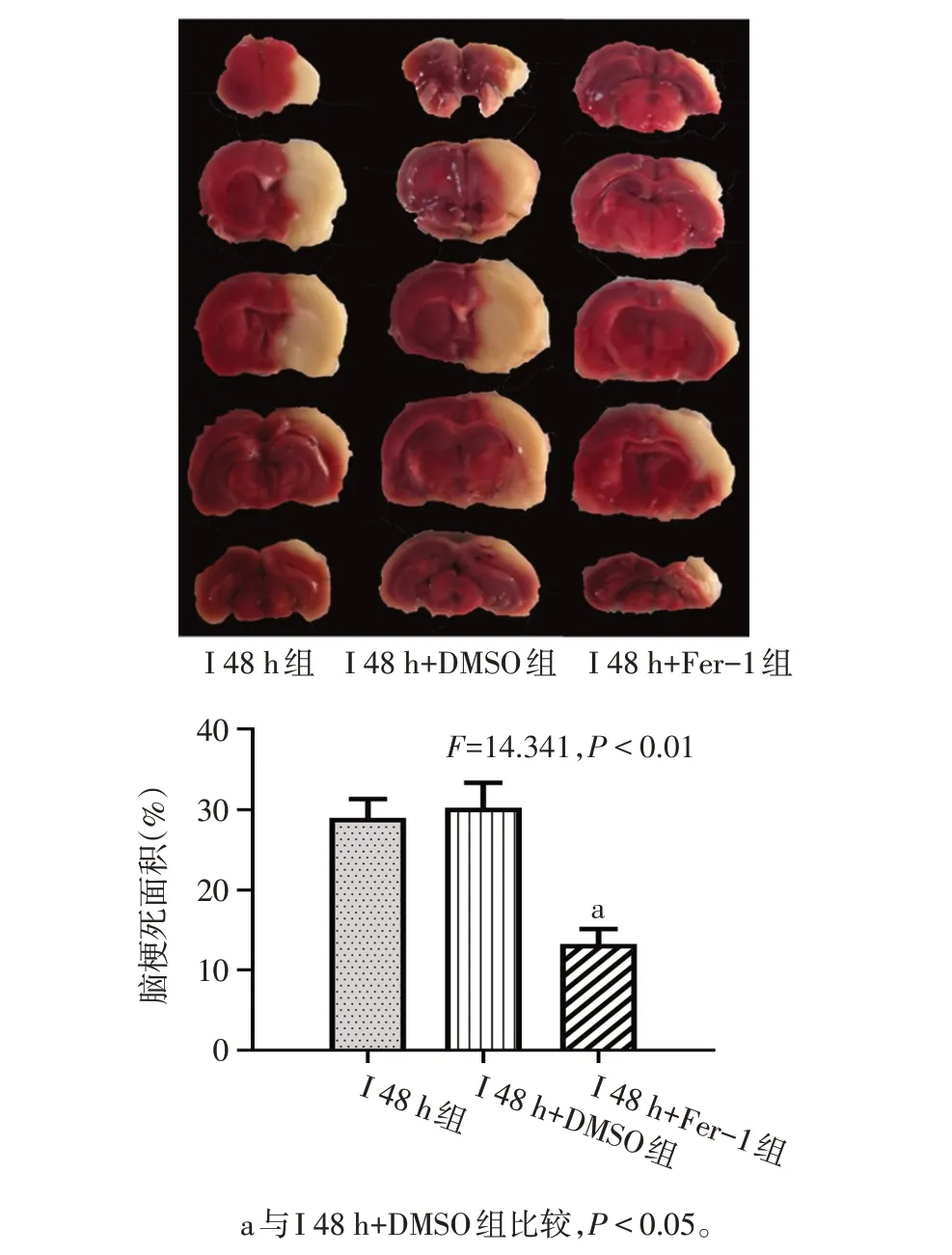
Fig.3 Cerebral infarct area of rats in each group of rats图3 各组大鼠脑梗死面积情况
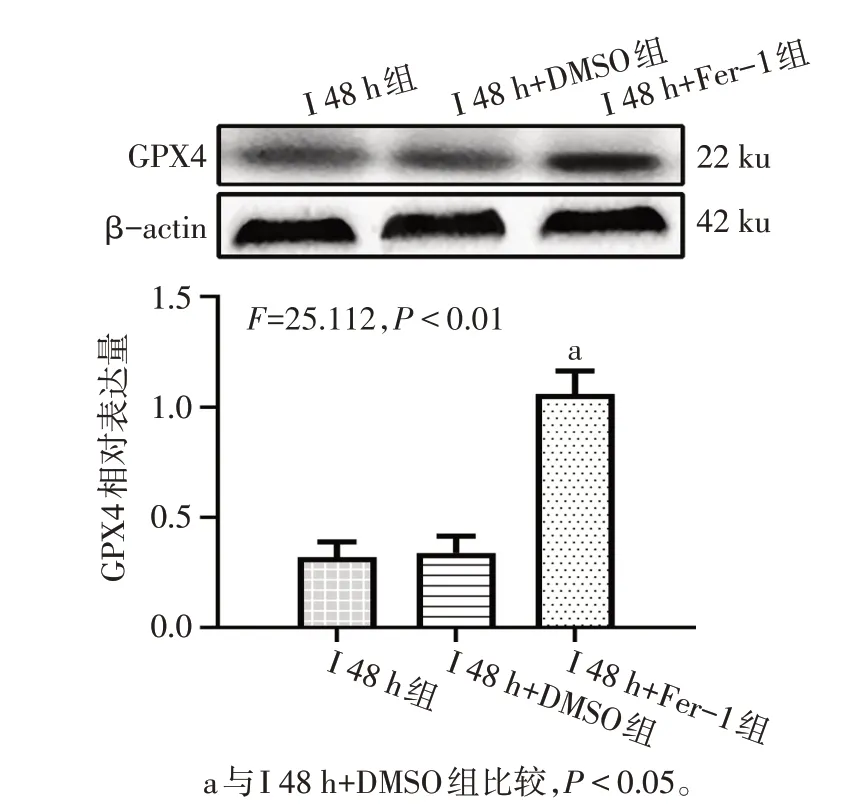
Fig.4 The relative expression of GPX4 in each group of rats图4 各组大鼠GPX4相对表达情况
2.3 miR-27a促进大鼠缺血性脑卒中早期铁死亡和脑组织损伤 与I 48 h+NC组相比,I 48 h+ago-miR-27a组大鼠脑组织中miR-27a表达升高,脑梗死面积增加(P<0.05),神经功能评分升高(P<0.05),GPX4和GSH 表达降低(P<0.05),但组织铁及MDA含量增多(P<0.05);而给予antago-miR-27a 干预后,ago-miR-27a 作用被逆转;与I 48 h 组相比,I 48 h+NC 组中相关结果差异无统计学意义(P>0.05)。见图5、6,表4。
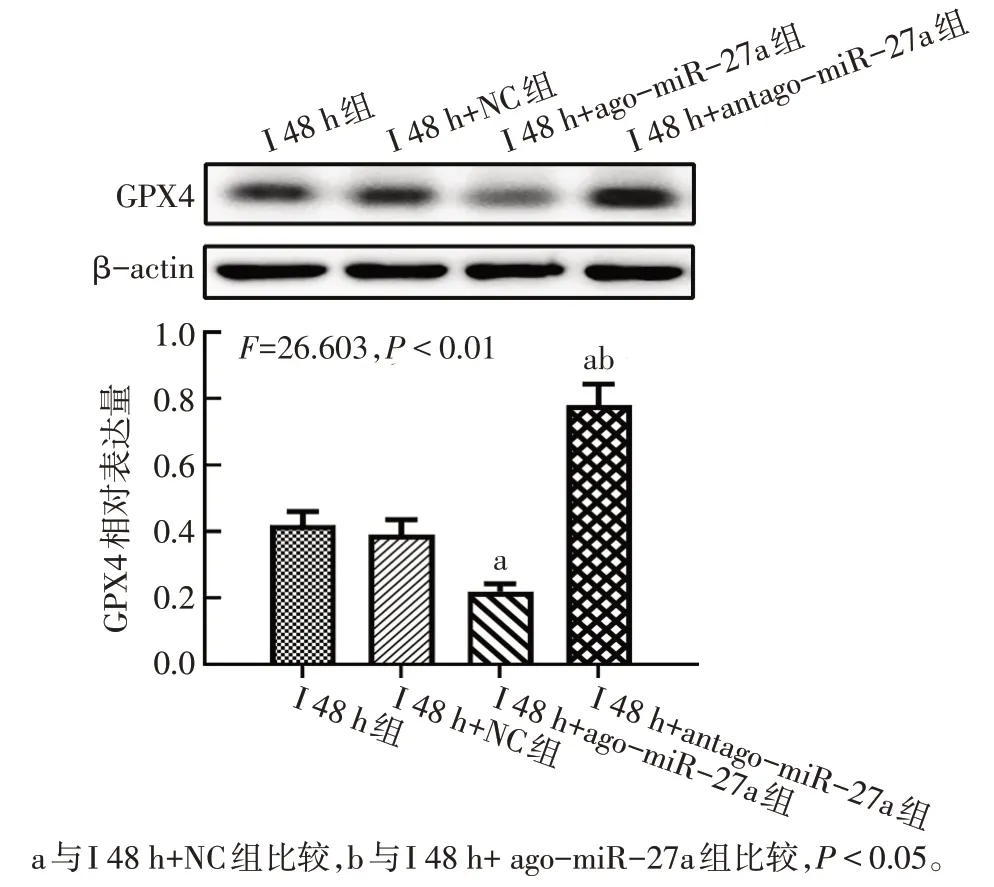
Fig.5 The changes of GPX4 in each group of rats图5 各组大鼠GPX4蛋白表达变化
3 讨论
Tab.3 Comparison of GSH,Fe and MDA between the three groups of rats表3 3组中GSH、Fe及MDA水平比较(n=8,±s)
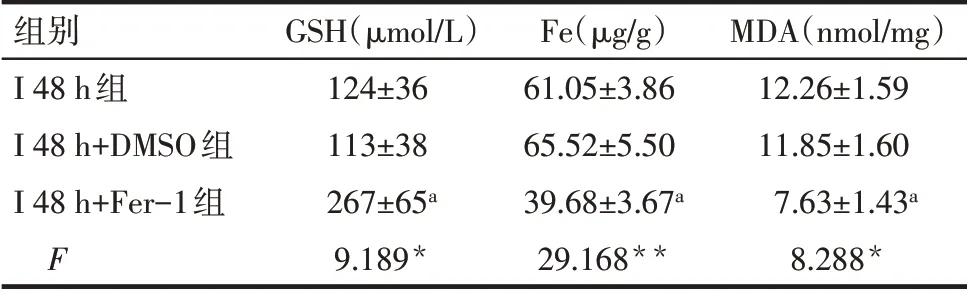
Tab.3 Comparison of GSH,Fe and MDA between the three groups of rats表3 3组中GSH、Fe及MDA水平比较(n=8,±s)
*P<0.05,**P<0.01;a与I 48 h+DMSO组比较,P<0.05。
组别I 48 h组I 48 h+DMSO组I 48 h+Fer-1组F GSH(µmol/L)124±36 113±38 267±65a 9.189*Fe(µg/g)61.05±3.86 65.52±5.50 39.68±3.67a 29.168**MDA(nmol/mg)12.26±1.59 11.85±1.60 7.63±1.43a 8.288*
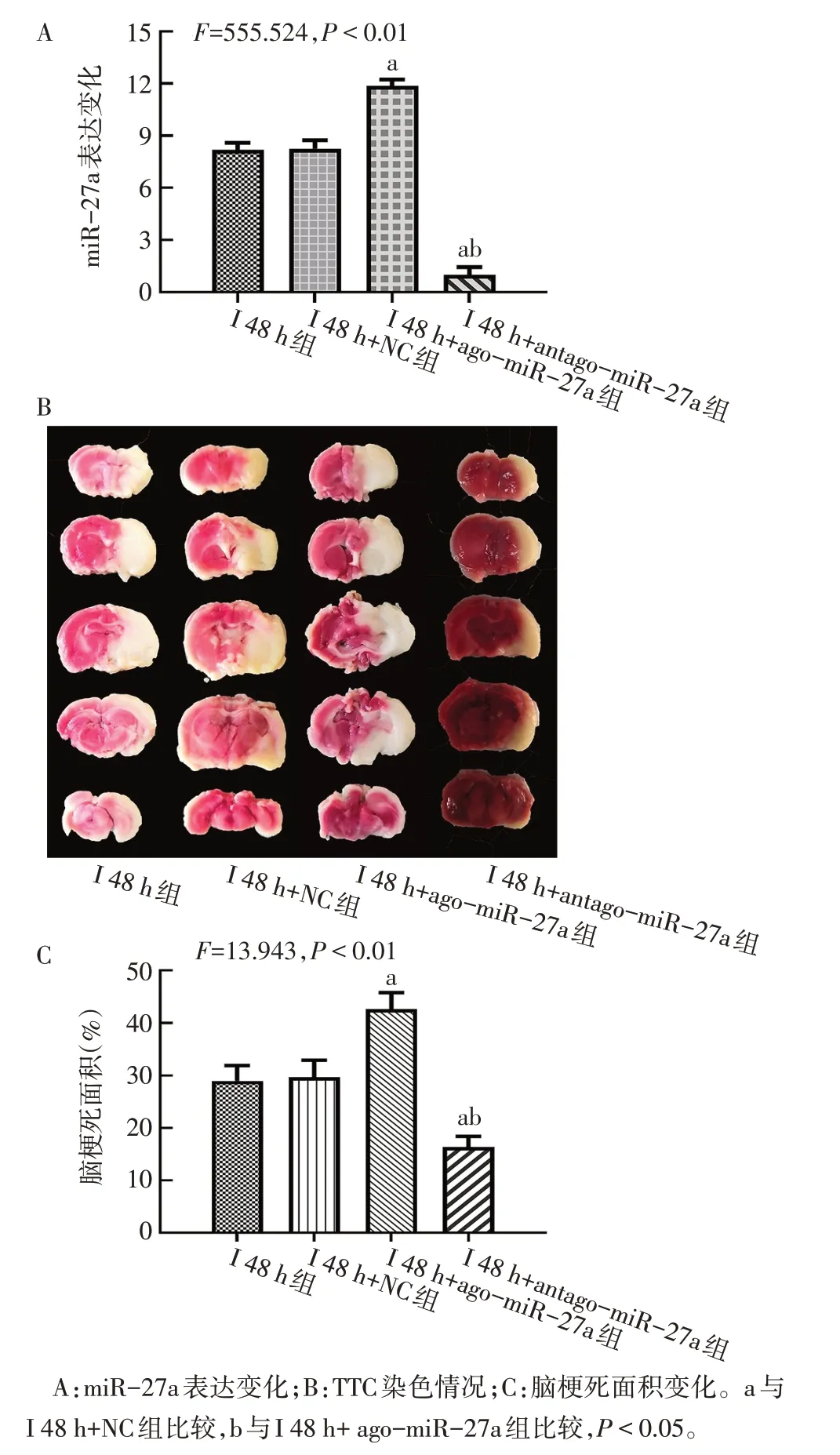
Fig.6 The expression of miR-27a and changes of cerebral infarct size of rats in each group图6 各组大鼠miR-27a表达和脑梗死面积变化
铁死亡是由铁和脂质过氧化物的积累所引起的,当细胞内Fe2+增多时,会引起细胞发生芬顿(Fenton)反应,产生大量的活性氧以及羟自由基等氧化物质;这些物质会在细胞中与多不饱和脂肪酸结合,进而形成大量脂质过氧化物和MDA,最终导致铁死亡的发生[10]。铁螯合剂如去铁胺、去铁酮,铁死亡抑制剂Ferrostatin-1 通过降低铁和脂质过氧化物抑制铁死亡的发生。GPX4 是重要的抗氧化物,GSH 是其发挥作用的辅助因子,GSH 和GPX4 减少是引起铁死亡产生的关键因素[11]。研究发现,铁死亡诱导剂Erastin 通过抑制胱氨酸/谷氨酸逆向转运体减少GSH合成,使得GPX4合成原料不足,活性下降,促进铁死亡[3]。铁死亡诱导剂RSL3则直接抑制GPX4活性[12]。因此,铁、MDA、GSH和GPX4被作为检测铁死亡的生物标志物,其中前两者为促铁死亡因子,后两者被视为抗铁死亡因子。当缺血性脑卒中发生时,会引发脑组织中兴奋性毒性反应,并诱导细胞中GSH 以及GPX4 产生减少[13-14];同时,当缺血性脑卒中发生后,脑组织中铁和脂质过氧化物积累增加[15-16],进一步促进铁死亡的发生。因此,探究铁死亡与缺血性脑卒中的关系,对缺血性脑卒中的机制研究以及防治均有重要意义。
Tab.4 Comparison of neurological function score and ferroptosis-associated indicators in brain tissue between the four groups of rats表4 4组中神经功能评分和铁死亡相关指标的水平比较 (n=8,±s)
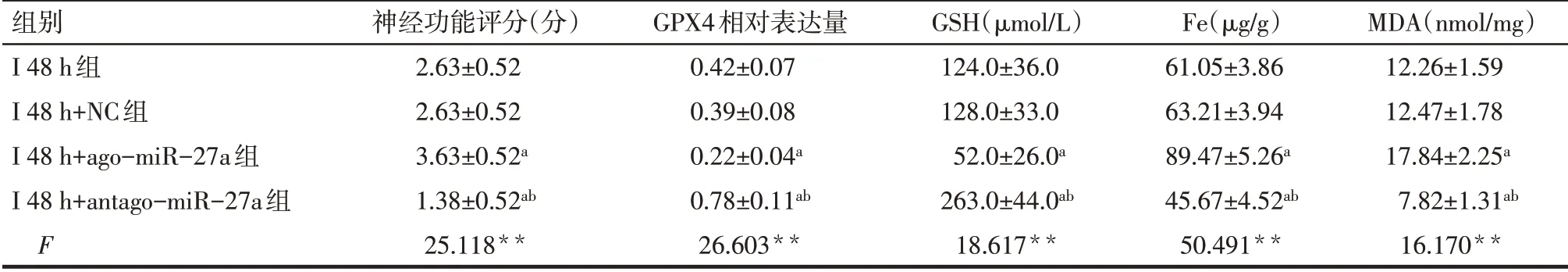
Tab.4 Comparison of neurological function score and ferroptosis-associated indicators in brain tissue between the four groups of rats表4 4组中神经功能评分和铁死亡相关指标的水平比较 (n=8,±s)
**P<0.01;a与I 48 h+NC组比较,b与I 48 h+ago-miR-27a 组比较,P<0.05。
组别I 48 h组I 48 h+NC组I 48 h+ago-miR-27a组I 48 h+antago-miR-27a组F神经功能评分(分)2.63±0.52 2.63±0.52 3.63±0.52a 1.38±0.52ab 25.118**GPX4相对表达量0.42±0.07 0.39±0.08 0.22±0.04a 0.78±0.11ab 26.603**GSH(µmol/L)124.0±36.0 128.0±33.0 52.0±26.0a 263.0±44.0ab 18.617**Fe(µg/g)61.05±3.86 63.21±3.94 89.47±5.26a 45.67±4.52ab 50.491**MDA(nmol/mg)12.26±1.59 12.47±1.78 17.84±2.25a 7.82±1.31ab 16.170**
研究发现,小鼠缺血性脑卒中模型中GSH 含量明显减少,脂质活性氧(ROS)的含量增加[17]。Tuo等[18]研究显示,在单侧短暂性大脑中动脉闭塞存在的情况下,tau蛋白等与铁水平的升高有关。研究发现使用Ferrostatin-1可抑制心肌细胞铁死亡,减轻心肌损伤[19]。上述研究表明铁死亡是一些疾病的重要病理因素之一,抑制铁死亡的发生可减轻疾病的病理损伤。本研究结果发现,在缺血性脑卒中早期,大鼠脑组织中GPX4、GSH表达水平降低,而铁和MDA含量升高,提示铁死亡参与缺血性脑卒中的发生发展过程。本研究进一步使用Ferrostatin-1 干预后发现,其可使脑组织中GPX4、GSH表达水平升高,降低铁和MDA含量,同时明显减轻大鼠脑组织损伤。提示抑制铁死亡的发生可减轻缺血性脑卒中损伤。
miR-27a 是miR-23a~27a~24-2 基因簇中 的 一员,在神经系统疾病中发挥重要作用[20-21]。有研究报道,在大鼠脑皮层神经细胞拟缺血损伤模型中,miR-27a 表达升高,可以参与缺血性脑血管疾病发病过程[22];而给予外泌体miR-27a 后可以明显增加缺血的脑组织损伤[23],表明miR-27a 具有潜在的促脑缺血损伤作用。另有研究发现miR-27a可促进铁死亡的产生[24],故本研究推测miR-27a 可能与缺血性脑卒中过程中铁死亡的发生有关。为了明确miR-27a 是否参与了缺血性脑卒中的病理过程,笔者观察了miR-27a的表达变化,结果显示,模型组大鼠脑组织中miR-27a表达出现显著升高,抑制miR-27a 表达后,大鼠神经功能评分降低,脑梗死面积明显减小,而GPX4 和GSH 的产生增多,且铁和MDA含量降低。而使用agomiR-27a 促进miR-27a 表达具有相反的效果。提示miR-27a具有加重脑组织损伤的作用,该作用是通过促进铁死亡的发生实现的。
综上所述,在大鼠缺血性脑卒中早期miR-27a的表达增多,其通过促进铁死亡的发生,从而加重脑组织损伤。本研究为探究miR-27a和铁死亡在缺血性脑卒中过程中的机制以及临床预防和治疗缺血性脑卒中提供了新的方法和途径,但miR-27a 与铁死亡之间的具体作用机制还需更进一步研究。

