二苯乙烯苷、大黄素改善高糖诱导下小鼠海马神经元凋亡
陈钢,许永劼,黄昶煜东,林海容,杨婷婷,朱丽英,李兴,潘卫△
糖尿病脑病(diabetes encephalopathy,DE)是糖尿病(diabetes mellitus,DM)的慢性并发症之一,主要表现为认知功能障碍,其发病机制复杂,且无有效的治疗手段[1]。组蛋白乙酰化修饰在DM 及其并发症的发生发展中扮演着重要角色[2]。组蛋白乙酰化转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)参与组蛋白乙酰化修饰,在一些神经退行性疾病中,两者通过调节细胞凋亡影响突触可塑性[3],这与本课题组在高糖诱导的神经元细胞凋亡中发现一致[4]。因此,寻找合适的药物调节组蛋白乙酰化,改善神经元细胞凋亡具有重要的临床意义。何首乌是中国传统中药,具有增强免疫、提高DNA 修复能力等功效[5-6],其可用于治疗DM[7]。何首乌的主要成分为二苯乙烯苷(TSG)和大黄素(Emodin)[8],前者可通过抑制细胞凋亡保护神经细胞免受损伤[9]。课题组前期研究发现,TSG 可以介导丝裂原活化蛋白激酶/c-Jun 氨基末端激酶(MAPK/JNK)信号通路,抑制海马神经元细胞凋亡[10]。然而,在DE 中TSG 和Emodin 是否通过HAT 和HDAC 调节神经细胞的凋亡尚不清楚。本研究旨在观察TSG 和Emodin 能否通过调节HAT和HDAC活性改善高糖诱导下的HT-22细胞凋亡。
1 材料与方法
1.1 材料、试剂及仪器 小鼠海马神经元细胞系HT-22 购于上海中乔新舟生物科技有限公司。DMEM 培养基、0.25%胰酶购于美国Gibco公司;胎牛血清购于以色列BI公司;TSG(成分:2,3,5,4'-四羟基二苯乙烯2-O-β-D-葡萄糖苷;相对分子质量:406.38;规格:5 mg)和Emodin(成分:6-甲基-1,3,8-三羟基蒽醌;相对分子质量:270.24;规格:50 mg)均购于Merck 公司。CCK-8 试剂盒购于日本同仁化学研究所(Dojindo);RIPA 高效裂解液、二喹啉甲酸(BCA)试剂盒购于北京索莱宝科技有限公司;膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡测试试剂盒购于江苏凯基生物技术股份有限公司;HAT和HDAC酶联免疫吸附试验(ELISA)测试试剂盒购于上海酶联生物科技有限公司;兔源β-肌动蛋白(β-actin)多克隆抗体、兔源B 淋巴细胞瘤-2(Bcl-2)多克隆抗体、兔源Bcl-2 相关X 蛋白(Bax)多克隆抗体、兔源胱天蛋白酶3(Caspase-3)多克隆抗体、羊抗兔二抗均购于武汉三鹰生物技术有限公司。蛋白免疫印迹(Western blot)电泳仪、IMARK型酶标仪购于美国Bio-Rad公司;流式细胞仪购于美国贝克曼库尔特有限公司。
1.2 方法
1.2.1 细胞培养与干预 将HT-22 细胞注入含有10%胎牛血清的DMEM 培养基中,置于37 ℃、5%CO2的培养箱中培养24 h,当HT-22细胞在对数生长期时进行后续实验。将HT-22细胞分为4组:对照培养基(葡萄糖浓度25 mmol/L)组(NC组)、高糖培养基(葡萄糖浓度55 mmol/L)组(HG 组)、HG+TSG组和HG+Emodin组。
1.2.2 细胞活力测定 用CCK-8检测试剂盒测定细胞活力。将细胞密度调整为1×105/mL,每组设置5 个复孔,均匀铺于96 孔板中,37 ℃、5%CO2的环境下培养24 h。用高糖培养基将TSG 和Emodin 稀释至50、100、200 µmol/L,并在37 ℃、5%CO2的环境下作用12、16、20、24、48 h。在相应的作用时间结束后,弃去原培养基,加入细胞活性检测试剂(10 µL CCK-8 检测试剂,90µL 培养基),避光置于37 ℃、5%CO2的培养箱中孵育2.5 h。用酶标仪在波长为450 nm处检测光密度(OD)值。细胞存活率=(TSG/Emodin 组OD 均值-空白组OD 均值)/(NC/HG 组OD 均值-空白组OD 均值)×100%。选择最适条件(细胞存活率为70%左右)后继续实验。
1.2.3 细胞凋亡率的检测 细胞经药物作用24 h后,用PBS清洗3 次,加入0.125%胰蛋白酶消化细胞,用培养基终止消化后,1 000 r/min离心5 min,收集细胞。加入500µL结合缓冲液(Binding Buffer)将细胞重悬,并依次加入Annexin VFITC 和Propidium Iodide 各5 µL,室温避光作用10 min 后用流式细胞仪检测细胞凋亡率。每组重复3次。
1.2.4 ELISA 法检测HDAC 和HAT 活性 在96 孔板中加入每组细胞裂解液各50µL,每组设4个复孔。每孔加入100µL辣根过氧化物酶(HRP)标记的羊抗兔抗体,孵育、洗涤后加入100µL显色剂,避光15 min,加入终止液50µL。用酶标仪在波长为450 nm处检测OD值。
1.2.5 Western blot检测凋亡蛋白Bcl-2、Bax、Caspase-3的表达 对各组细胞进行Western blot分析。用细胞裂解液RIPA裂解细胞。蛋白浓度测定采用BCA 试剂盒。每孔蛋白量为30 µg,通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至聚偏二氟乙烯(PVDF)膜上。室温条件下5%脱脂牛奶封闭2 h。TBST洗涤3次,每次10 min。分别加入相应的一抗β-actin 抗体(1∶5 000)、Bax 抗体(1∶1 000)、Bcl-2抗体(1∶1 000)、Caspase-3抗体(1∶2 000),4 ℃孵育过夜。孵育后,用TBST 洗涤3 次,每次10 min。用羊抗兔二抗(1∶2 000)室温孵育2 h。最后通过增强型化学发光(ECL)检测系统进行检测。每组重复3 次。结果用Image J 1.8.0软件进行灰度值分析。
1.3 统计学方法 使用SPSS 19.0 统计软件进行数据分析。数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 TSG和Emodin的最适作用时间和浓度 CCK-8 实验结果显示,TSG 和Emodin 在50 µmol/L 作用HT-22 细 胞12 h 的 条 件 下,HG+TSG 组 和HG+Emodin 组细胞存活率在85%左右;作用48 h 时,HG+TSG 组 和HG+Emodin 组 细 胞 存 活 率>75%。100µmol/L 的TSG 和Emodin 作用细胞48 h 时,HG+TSG 组和HG+Emodin 组细胞存活率分别为76%和70%。200µmol/L 的TSG 作用细胞48 h时,HG+TSG组细胞存活率在70%左右。因此选择TSG 以200µmol/L,Emodin 以100 µmol/L 作用HT-22 细胞48 h为最适条件,见图1。
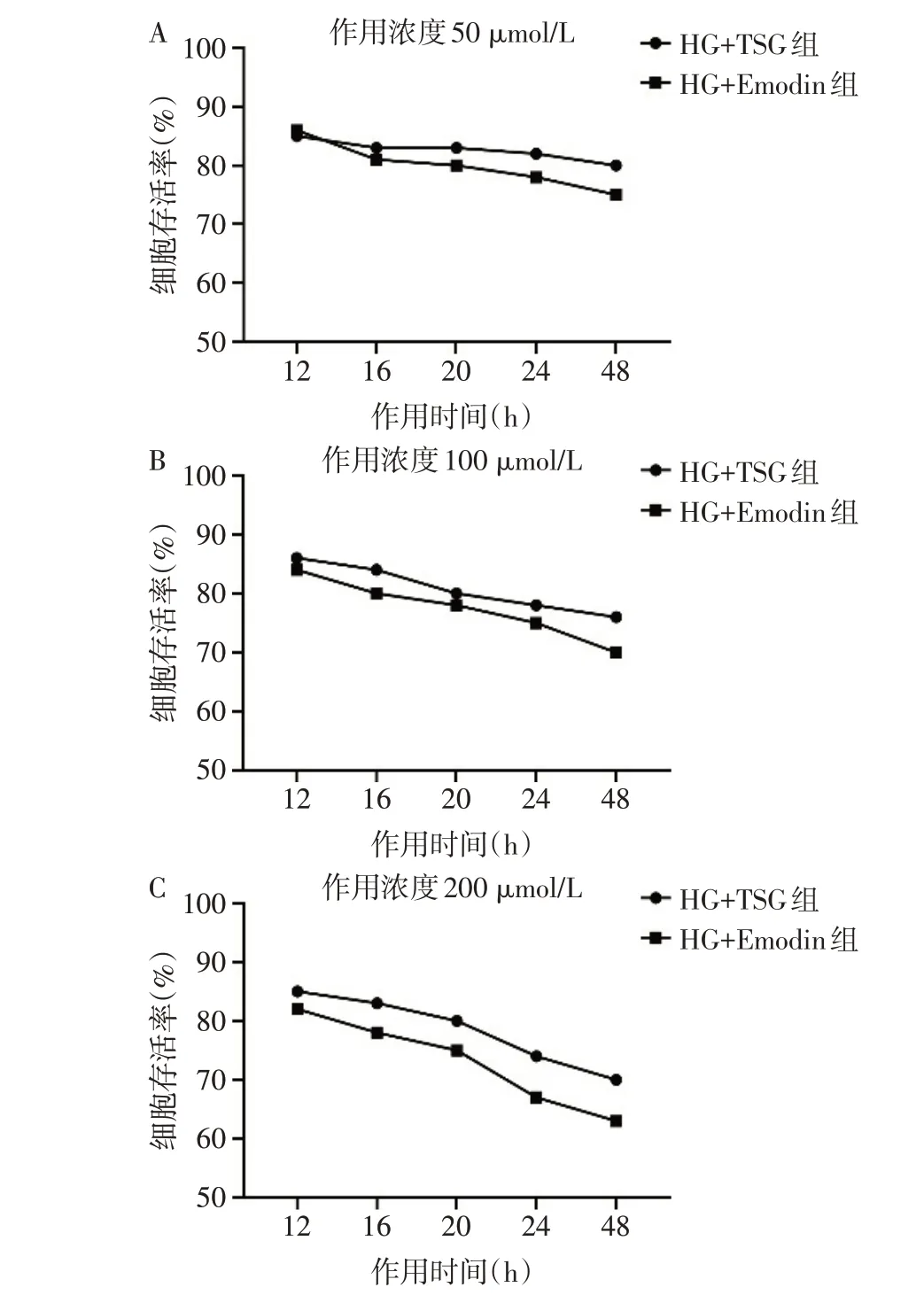
Fig.1 The effects of different action concentrations and time points of TSG and Emodin on HT-22 cell viability图1 TSG和Emodin不同作用浓度和时间对HT-22细胞活性的影响
2.2 TSG 和Emodin 改善高糖环境下神经元细胞凋亡率 流式细胞术结果显示,与NC组相比,HG组细胞凋亡率显著升高,TSG 和Emodin 可显著降低高糖条件下的细胞凋亡率(P<0.01),见图2。
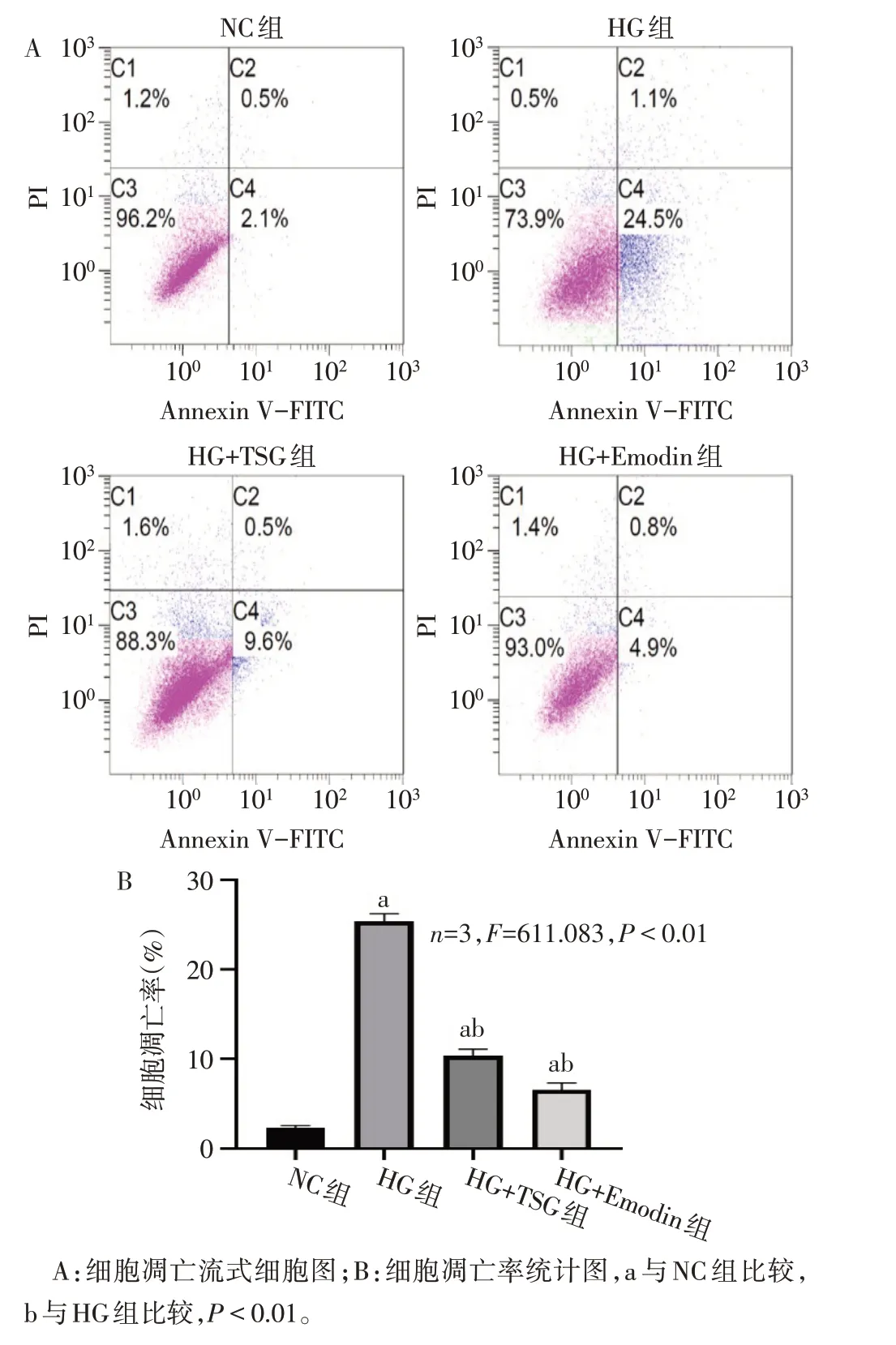
Fig.2 Apoptosis rates of HT-22 cells in different groups图2 不同组间HT-22细胞凋亡率
2.3 TSG 和Emodin 调控高糖诱导HAT 和HDAC 的表达 ELISA结果显示,与NC组相比,HG组的HAT和HDAC 活性上调(P<0.05),经过TSG 干预后,HAT 活性显著下调,HDAC 活性上调;经过Emodin干预后,HAT 和HDAC 活性均显著下调(P<0.05),见表1。
2.4 TSG 和Emodin 调控凋亡相关蛋白的表达 Western blot 结果显示,与NC 组相比,HG 组Bax、Caspase-3 的表达升高,Bcl-2 的表达降低,而HG+TSG组和HG+Emodin组可有效逆转高糖诱导的Bax、Caspase-3升高及Bcl-2的降低(P<0.01),HG+Emodin组Bax、Caspase-3及Bcl-2的表达与NC组相比差异无统计学意义(P>0.05),见图3、表2。
Tab.1 Comparison of HAT and HDAC activities in HT-22 cells between the different groups表1 各组间HT-22细胞HAT和HDAC活性比较(n=4,OD450,±s)

Tab.1 Comparison of HAT and HDAC activities in HT-22 cells between the different groups表1 各组间HT-22细胞HAT和HDAC活性比较(n=4,OD450,±s)
**P<0.01;a与NC组比较,b与HG组比较,P<0.05。
组别NC组HG组HG+TSG组HG+Emodin组F HAT 0.64±0.02 0.79±0.02a 0.68±0.03ab 0.46±0.02ab 158.140**HDAC 0.61±0.03 1.12±0.06a 1.18±0.02ab 0.74±0.04ab 227.551**
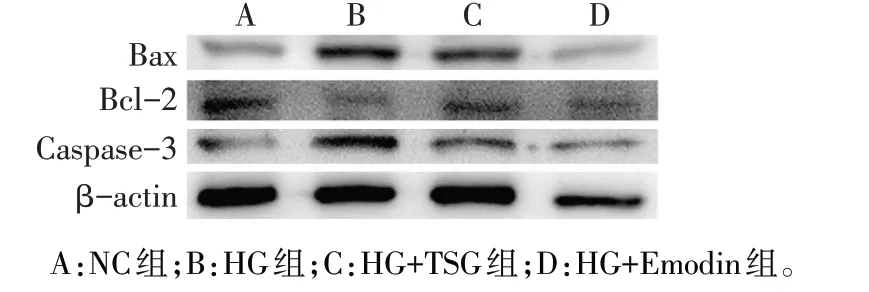
Fig.3 Expression levels of Bax,Bcl-2 and Caspase-3 protein detected by Western blot assay in the four groups图3 Western blot检测各组细胞Bax、Bcl-2和Caspase-3的蛋白表达
Tab.2 Comparison of expression levels of apoptosisrelated proteins between the four groups表2 各组细胞凋亡相关蛋白表达水平比较(n=3,±s)
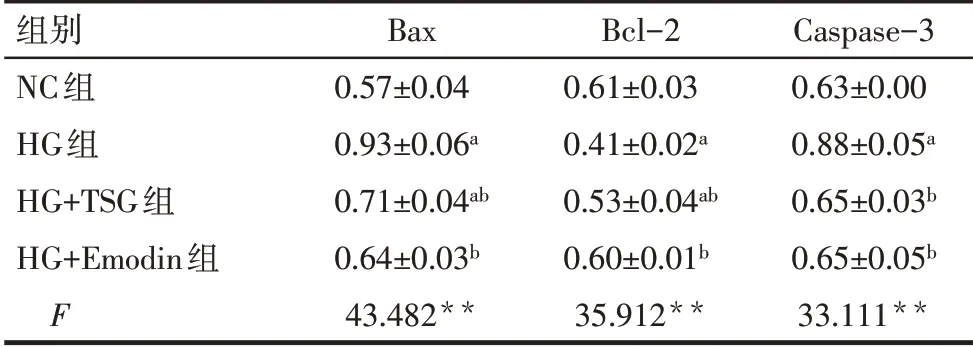
Tab.2 Comparison of expression levels of apoptosisrelated proteins between the four groups表2 各组细胞凋亡相关蛋白表达水平比较(n=3,±s)
**P<0.01;a与NC组比较,b与HG组比较,P<0.05。
组别NC组HG组HG+TSG组HG+Emodin组F Bax 0.57±0.04 0.93±0.06a 0.71±0.04ab 0.64±0.03b 43.482**Bcl-2 0.61±0.03 0.41±0.02a 0.53±0.04ab 0.60±0.01b 35.912**Caspase-3 0.63±0.00 0.88±0.05a 0.65±0.03b 0.65±0.05b 33.111**
3 讨论
目前,DE 的发病机制不明,且尚未找到有效的治疗靶点。课题组前期研究发现何首乌对DE 认知功能障碍具有预防和治疗作用[11]。本研究采用何首乌有效成分TSG和Emodin进行干预,发现两者可以调节HAT 及HDAC 的表达,改善高糖诱导的海马神经元细胞凋亡。
3.1 TSG 和Emodin 作用神经元细胞的最佳浓度和时间 尽管有文献报道了TSG作用于大肠癌细胞的最适药物浓度[12],但对于不同的细胞,最佳的药物作用浓度和时间不尽相同。陈素领等[13]采用1、10、20、50、100µmol/L 的Emodin 处理HT-22 细胞,但未对时间进行确定。本研究通过CCK-8 法检测细胞活性,筛选出TSG 和Emodin 作用HT-22 细胞的最佳浓度和时间,推荐作用浓度和时间分别为TSG 200µmol/L 48 h和Emodin 100µmol/L 48 h。
3.2 TSG 和Emodin 改善高糖诱导下神经元细胞凋亡 海马神经元凋亡导致认知功能障碍是DE 的重要发病机制之一。研究发现,海马神经元受线粒体凋亡通路、内质网凋亡通路和死亡受体通路的调控,最终影响认知功能障碍[14-15]。TSG和Emodin在改善神经元凋亡和神经退行性疾病中起到重要的作用。Lee 等[16]以HT-22 细胞为研究对象,以何首乌主要活性成分TSG 作用于氧化应激后的细胞,结果显示TSG可以通过减少活性氧(ROS)的产生减少海马神经元细胞凋亡。近期研究表明,Emodin可以通过抑制乳酸脱氢酶(LDH)活性和Caspase-3、-8、-9 的激活来抑制神经元细胞的凋亡,从而改善阿尔茨海默病小鼠的空间记忆和学习能力[17]。但是TSG 和Emodin 能否有效改善高糖所致的神经元细胞凋亡却少见报道。本研究显示,在高糖环境下HT-22 细胞凋亡率升高,经TSG 和Emodin 干预后,HT-22 细胞凋亡率下降;在蛋白水平上,Bax、Bcl-2、Caspase-3的表达得到恢复。这些结果表明TSG和Emodin可以改善高糖诱导的神经细胞凋亡。
3.3 TSG 和Emodin 通过调节HAT 和HDAC 活性改善高糖诱导下神经元细胞凋亡 神经元细胞凋亡与组蛋白乙酰化密切相关,而组蛋白乙酰化修饰受到HAT 和HDAC 的调控[18]。Wu 等[19]研究发现,神经元细胞凋亡受HAT 和HDAC 的动态调控。一般控制核苷酸合成5(GCN5)是组蛋白乙酰化转移酶,当GCN5失活时,导致Bcl-2相互作用细胞凋亡调节因子(Bim)转录上调,促进神经细胞凋亡,而抑制HDAC 后可以显著挽救GCN5 失活诱导的神经细胞凋亡。课题组前期研究发现,高糖作用下的HT-22神经元细胞HAT 和HDAC 表达升高,细胞凋亡增加,且抑制HDAC 后加剧了HT-22 细胞凋亡[4]。因此,在DE 的发生发展中,神经元细胞组蛋白乙酰化调控异常是导致神经元细胞凋亡的关键因素之一。本研究发现,在高糖条件下,TSG 和Emodin 可以调控HAT 和HDAC,且两者均能下调神经元细胞的凋亡率和改善神经元细胞中凋亡蛋白的表达,这些结果表明TSG 和Emodin 可能通过调节组蛋白乙酰化酶,从而减少神经元细胞凋亡。本研究或许可为将来DE的新药开发提供一定的理论支撑。然而,本研究未从体内实验证明TSG和Emodin在DE大鼠海马神经元细胞中的调控关系,这是后续研究的重点。
综上所述,在高糖环境下,海马神经元细胞组蛋白乙酰化酶失调,导致神经元细胞凋亡,而TSG 和Emodin可以改善这一过程,因此TSG和Emodin可能在调控DE 中的组蛋白乙酰化酶失调及减少神经元细胞凋亡方面具有较好的应用前景,为进一步开展体内实验奠定了基础。

