木瓜蛋白酶联合DNA酶法提取乳鼠原代皮层神经元及鉴定
廖益东,明江,张宇,廖一飞,徐卡娅,△
缺血性脑血管疾病可引起脑血管闭塞缺氧,致神经元损害,而原代神经元培养是神经科学体外研究的重要途径之一。近年研究表明,原代培养的大鼠皮层神经元可用于脑血管疾病体外模型研究,这种原代神经元细胞模型较贴近于人体自身神经元的病理生理特点,可模拟出脑卒中后神经元缺血再灌注损伤、糖尿病性脑病等神经系统疾病模型[1-3]。此外,体外培养原代提取的神经元有结果分析精确、易观察以及实验周期短等优势,已被越来越多地应用于神经科学研究[4-5]。此外,由于神经元提取细节繁多,细胞培养难度大,国内外相关研究中选取的消化酶及培养基配方亦不统一[1,6]。本研究采用出生24 h内的SD 大鼠进行神经元提取,选用木瓜蛋白酶与DNA 酶顺序消化方案,并对操作细节及接种后培养基选配进行多项改进,以期寻求一种更加简便易行的提取方法,为后续神经系统疾病研究建立良好的体外细胞模型。
1 材料与方法
1.1 实验动物 出生24 h内清洁级SD大鼠9只,雌雄不限,体质量20~35 g,购自浙江维通利华实验动物技术有限公司,动物生产许可证号:SCXK(浙)2019-0001;动物使用许可证号:SYXK(黔)2018-0001;动物质量合格证号:20211012Aazz0619000425。所有大鼠均在自然光照下自由饮食、饮水,温度25 ℃,动物房环境及鼠笼清洁、透气,由贵州医科大学附属医院实验动物学部饲养繁殖。本实验经贵州医科大学动物伦理委员会批准(批准文号:2101450)。
1.2 主要试剂及仪器 DMEM-F12 培养液、胎牛血清(FBS)、Neurobasal-A 无血清培养液、B27 购自美国Gibco 公司;马血清、木瓜蛋白酶粉购自索莱宝公司;L-多聚赖氨酸(1 g/L)购自武汉普诺赛生命科技有限公司;神经元微管相关蛋白2(MAP2)抗体、神经元特异性核蛋白(Neun)试剂盒、β-Tubulin 抗 体、Alexa Fluor®488 标 记 的 山 羊 抗 兔IgG 购 自Abcam 公司;DNA 酶粉购自赛国生物科技有限公司;DAB 辣根过氧化物酶(HRP)显示试剂盒购自碧云天生物技术有限公司;SABC-Cy3免疫荧光试剂盒购自博士德生物公司;青霉素及链霉素购自Hyclone公司。CO2恒温细胞培养箱、超净工作台、-80 ℃低温冰箱购自美国Thermo 公司;荧光倒置显微镜购自日本Nikon公司,共聚焦显微镜购自德国蔡司集团,正置荧光显微镜购自日本OLYMPUS公司。
1.3 方法
1.3.1 配制溶液 5 g/L DNA 酶:称取5 mg DNA 酶粉,加入1 mL 无菌水溶液,经0.22 µm 针式过滤器除菌后备用。将木瓜蛋白酶粉与DMEM-F12 培养基按2∶1 进行配制,经0.22 µm 针式过滤器除菌后备用。将1 g/L 的L-多聚赖氨酸用超纯水稀释10 倍,配制成0.1 g/L 的多聚赖氨酸。神经元接种液:DMEM-F12基础培养基+10%FBS+1%青霉素链霉素溶液。神经元培养液:Neurobasal-A培养基+2%B27+0.5%青霉素链霉素+0.5%谷氨酰胺。
1.3.2 包被培养板 使用0.1 g/L 的L-多聚赖氨酸溶液浸泡6孔板和细胞爬片,轻轻摇晃使孔底及爬片全部浸润,37 ℃温箱过夜,回收L-多聚赖氨酸溶液后,置超净台风干,稳定4 h备用。接种时用磷酸盐缓冲液(PBS)洗5 min,重复3次。
1.3.3 分离、消化新生SD 大鼠皮层神经元 取24 h 内新生SD大鼠,放入75%乙醇中浸泡2 min,取出后用预冷PBS冲洗干净。处死乳鼠,快速使脑组织温度降到0 ℃后迅速将头颅离断,放入盛有预冷DMEM-F12 培养基的烧杯中清洗,随后转移至另一盛有预冷10%马血清和DMEM-F12 培养基的无菌平皿内。解剖全程在冰上进行,用弯镊子、直显微镊分层剪开头皮和颅骨,暴露大脑组织,在显微镜下充分除去脑组织表面血管膜与嵌入小血管,分离出乳鼠大脑皮层组织,PBS洗涤2 次,转移入盛有DMEM-F12 培养基的10 cm 小皿中。将收集到的大脑皮层组织剪碎(大小为1~2 mm),吹打重悬混匀,顺序加入无血清培养基配制的适量木瓜蛋白酶及DNA酶(100~300µL),于37 ℃温箱里消化20 min,间隔5 min摇匀1次,消化完毕后,加入含有10%FBS的DMEM-F12溶液终止消化,并用巴氏吸管轻柔混匀,静置5 min。见图1。
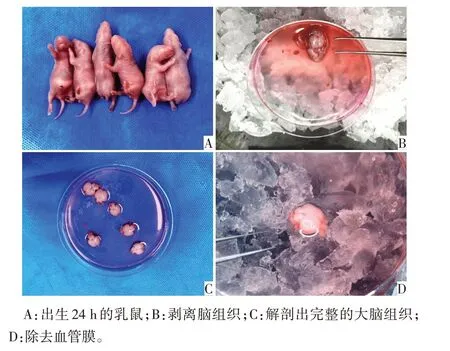
Fig.1 The anatomy process of SD rats图1 SD大鼠解剖过程
1.3.4 纯化、培养神经元单细胞 取上述消化后的细胞,加入适量DNA 酶,轻柔吹打10 次后静置2 min;吸取上层单细胞悬液,将上清液转移至离心管内备用,下层沉淀的细胞团块保留,再加入1~2 mL DMEM-F12 培养液,重复上述操作3次,分层分步吹打,收集细胞。将收集到的所有细胞悬液经100 目筛网过滤,1 000 r/min 离心5 min,弃上清液;用含10%FBS 的DMEM-F12 神经元接种液重悬细胞,随后,将细胞悬液接种至内含细胞爬片的6 孔板内,摇匀,置于37 ℃、5%CO2的培养箱内培养,4 h 后及时更换预热的含B27 的Neurobasal-A 神经元培养液,并在换液前使用DMEM-F12洗去细胞器碎片与杂质;首次换液为24 h 内进行全量换液,之后每隔2~3 d 半量换液,培养至7 d 后用于后续实验,并镜下观察,拍照记录细胞形态。
1.3.5 接种不同浓度神经元单细胞 将上述纯化的单细胞悬液,采用细胞计数板调整细胞浓度,经前期预实验将神经元细胞液分为3 种不同的细胞密度,分别为1×105、5×105、1×106细胞/mL,接种于6孔板内,每孔2 mL。置于37 ℃、5%CO2原代专用培养箱中进行培养,使神经元贴壁生长,24 h 后拍照记录并对比细胞形态,选择5×105细胞/mL进行后续实验。
1.3.6 β-Tubulin免疫荧光法鉴定皮层神经元 取培养7 d后的神经元单细胞经37 ℃复温后,使用预热的PBS洗涤5 min。采用4%多聚甲醛固定细胞15 min,PBS 洗涤3 次,每次5 min。0.25%TritonX-100 室温下处理细胞15 min,PBS 洗涤3次,每次5 min。10%山羊血清封闭30 min,吸去山羊血清,勿洗。滴加β-Tubulin抗体(1∶200)于盖玻片上,4 ℃孵育过夜,PBS洗涤3次,每次5 min。滴加Alexa Fluor®488标记的山羊抗兔IgG(1∶500)于盖玻片上,室温避光孵育2 h,PBS 洗涤3次,每次5 min,滴加适量的内含4,6-二氨基-2苯基吲哚二盐酸盐(DAPI)抗荧光萃灭剂封片。同时设置空白对照,用PBS代替一抗,其余方法同上,使用共聚焦显微镜观察并拍摄。
1.3.7 Neun 抗体免疫组织化学法鉴定皮层神经元 取培养7 d 后的神经元单细胞,使用预热的PBS 洗涤5 min,37 ℃温箱下4%多聚甲醛固定15 min,PBS洗涤3次,每次5 min。5%羊血清室温封闭45 min,加入Neun一抗(1∶200),4 ℃冰箱过夜,PBS洗3次,每次5 min,加入HRP标记的山羊抗兔IgG二抗,避光孵育1 h,加入DAB反应显色,梯度乙醇脱水,中性树胶封片,镜下观察染色部位。
1.3.8 MAP2 免疫荧光法鉴定皮层神经元纯度 提取培养7 d 后的神经元单细胞,使用预热的PBS 洗涤5 min,采用4%多聚甲醛固定15 min,PBS洗涤3次,每次5 min;室温下采用0.25%TritonX-100 破膜15 min,PBS 洗涤3 次,每次5 min;采用10%山羊血清室温封闭30 min,吸去山羊血清,勿洗。加入一抗MAP2(1∶100),4 ℃冰箱中孵育过夜,37 ℃复温10 min,PBS洗涤3次,每次5 min,加入二抗羊抗兔IgG(1∶100),避光37 ℃孵育30 min,PBS 洗涤3 次,每次5 min,加入SABC-Cy3避光37 ℃孵育45 min,PBS 洗涤3 次,每次5 min。将细胞爬片取出,固定于载玻片,并用含有DAPI 的封片液核染色10 min。用倒置荧光显微镜观察。红色荧光为神经元标志物,蓝色为细胞核,分别摄取神经元和细胞核的荧光图像,计算同一视野下神经元的数量占该视野中总细胞数的百分比,每张玻片随机读取3个视野观察,每次实验观察3个样本,实验重复3次,取百分比的平均数为神经元的纯度。
2 结果
2.1 不同接种密度对神经元生长状态的影响 密度为1×105细胞/mL孔内的神经元密度较小,突触相隔较远;5×105细胞/mL孔内的神经元仅有少数聚团,但胞体饱满、胞体间形成交联,突触生长均匀;1×106细胞/mL 孔内的神经元密度过大,神经元聚集成团明显,个别神经元出现挤压情况。见图2。
2.2 皮层神经元的生长形态学观察 以密度5×105细胞/mL细胞悬液接种24 h后,细胞部分贴壁,胞体胞核光晕明显,仅有少数树突生长,见图3A。接种3 d 后,贴壁细胞逐渐增多,神经元突触进一步生长并延长,交联成稀疏网络,见图3B。接种7 d 后,神经元仍大量生长,胞体丰满,并形成更为紧密的神经元网络系统,见图3C。
2.3 皮层神经元β-Tubulin免疫荧光鉴定 共聚焦显微镜下可见细胞胞体和突触均能被β-Tubulin 抗体所标记,证明此细胞为神经元,见图4。
2.4 皮层神经元Neun免疫组织化学染色 Neun免疫组化染色结果表明,培养细胞胞体和树突均显棕色,染色呈阳性,证明提取培养细胞是神经元,见图5。
2.5 MAP2免疫荧光法鉴定皮层神经元纯度 免疫荧光染色可见神经元胞体及树突着色,结果显示,经MAP2 鉴 定得到神 经 元 纯度为(91.06±1.51)%,见图6。

Fig.2 Growth status of neurons at different inoculation densities(×40)图2 不同接种密度神经元生长状态(×40)
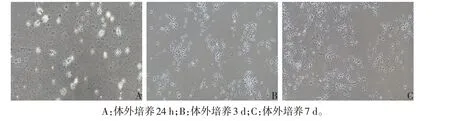
Fig.3 Image of SD rat cortical neurons under an inverted microscope(×100)图3 SD大鼠皮层神经元在倒置显微镜下图像(×100)
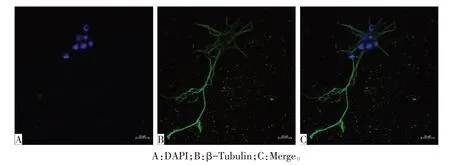
Fig.4 Cortex neurons identified by β-Tubulin immunofluorescence(×400)图4 皮层神经元β-Tubulin免疫荧光鉴定(×400)
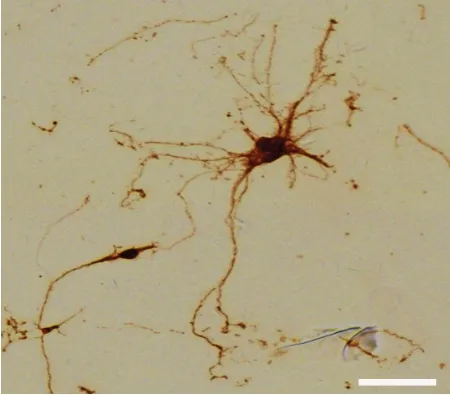
Fig.5 Neun staining of cortical neurons(×400)图5 皮层神经元Neun染色(×400)
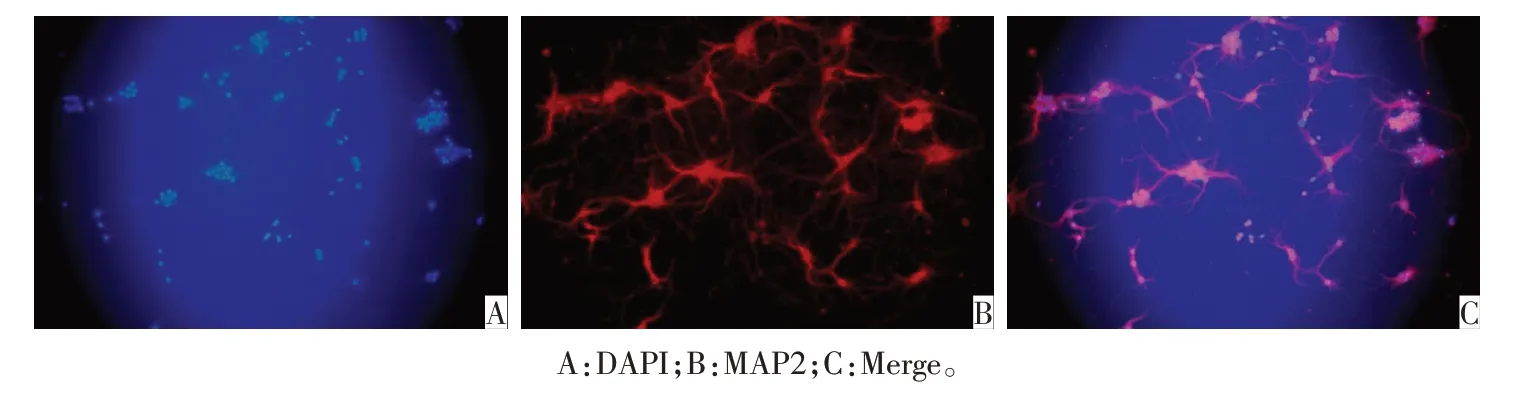
Fig.6 MAP2 immunofluorescence identification of cortex neurons图6 皮层神经元的MAP2免疫荧光鉴定
3 讨论
随着细胞技术的不断发展,原代神经元模型已被广泛应用于脑血管疾病及神经系统发育的研究中[7]。已有研究证实原代皮层神经元可作为体外研究神经疾病的模型,如在干细胞治疗缺血性脑卒中的研究中,通过缺血缺氧皮层神经元与人骨髓间充质干细胞共培养,发现间充质干细胞通过线粒体转移的方式发挥对受损神经元的修复作用[8-9]。同时根据原代神经元培养情况,可更加直观地研究每个阶段神经元的发育,且能够单独观察局部神经元可塑性[10-11]。目前,国内外提取神经元消化方案及培养步骤繁多复杂,方案也不统一,既往部分研究者选择胎鼠进行皮层神经元提取,但胎鼠的胎龄难以掌握,取材难度大,且增加了操作步骤,极易造成孕鼠死亡[1,12]。在消化酶选择方面,Brewer[6]比较了多种消化酶,发现木瓜酶用于原代神经元提取时具有保护神经细胞活性的显著优势。
本研究结合国内外皮层神经元的提取方法及自身的实验经验并加以改进,总结得到以下几点:(1)培养基的选择。可使用无血清培养基Neurobasal-A,同时添加B27和谷氨酰胺为神经元供能。此法配制的培养基可最大限度地抑制胶质细胞生长,得到状态稳定的神经元。(2)SD 乳鼠解剖。解剖全程需在冰上进行,处死乳鼠后,需快速使脑组织温度降到0 ℃,尽可能保证神经元的存活率。同时,为保证细胞代谢,解剖过程需浸泡在含有10%马血清和DMEM-F12 培养基中进行,因为血清可为离体的神经元提供代谢能量及营养物质。(3)剥离取材脑皮层段。应尽可能去除脑组织外包裹的血管膜和血管,如果去除不完全,会影响后续步骤。同时还会影响消化步骤,增加操作难度,降低细胞存活率,无法得到高质量的神经元。此外,乳鼠的出生时间越短,脑血管膜越容易剥离,血管膜剥离越干净,提取的皮层神经元纯度越高[13-15]。(4)消化步骤。本研究未采用胰酶消化,因为胰酶消化时间难以控制,且浓度过高会导致消化过度,本实验选取木瓜蛋白酶和适量DNA 酶混合消化,既保证细胞消化完全,又避免过度消化而损失。木瓜蛋白酶较为温和,消化效果良好,能柔和地处理皮层组织,得到纯度更高的神经元细胞[12]。(5)分步分层吹打。FBS 终止消化后,本研究对吹打方案进行改进,采用分步分层吹打法,此法的优势在于分步吹打的过程中,尽可能保证收获更多神经元单细胞,避免了细胞被过度吹打、损伤。经分层分步操作之后如还有团块沉淀,应果断丢弃,造成此原因可能是血管膜未剥离完全,同时为了防止细胞悬液结团和黏稠,还应该在操作前加入适量的DNA酶。(6)纯化神经元。需使用100目细胞过滤网滤除细胞杂质与未清除完全的血管膜组织,此法可最大限度地滤去剪碎的细胞器碎片,减少影响神经元纯度的因素[16]。(7)接种细胞密度的选择。经前期实验经验,采用L-多聚赖氨酸过夜浸泡细胞爬片,PBS 清洗后滴加适合密度的细胞悬液,此方案可有效避免神经元后期的聚集现象。细胞密度在实验中较为重要。首先,种板密度低,神经元较难存活和成熟,细胞间难以形成交联。其次,胶质细胞及杂细胞会大量分裂,导致神经元存活率降低,实验失败。本研究发现每孔为5×105细胞/mL 最为适宜,接种7 d后,得到的神经元生长状态稳定。原代细胞液中混有的细胞器碎片和杂质超过12 h 会贴壁牢固,且在后续换液中难以清除,细胞器碎片及杂质将直接影响神经元存活和正常代谢,因而种板4~6 h后需及时进行换液。种植细胞12 h后,胶质细胞也开始分裂,需及时更换预热37 ℃的无血清培养基来抑制胶质细胞生长。此外,本研究在操作过程中发现,冰冷的培养基可能会影响皮层神经元,导致贴壁神经元脱落,因此预热培养基尤为重要。种植细胞完成后的换液,禁止使用PBS 清洗,需用DMEM 清洗,既能除去杂质和细胞碎片,也可减少细胞脱落,得到贴壁更加牢固的神经元。随后,本研究采用β-Tubulin免疫荧光法和Neun 抗体免疫组化法鉴定细胞为神经元且接种7 d,MAP2免疫荧光法鉴定神经元纯度较高,为(91.06±1.51)%。
综上所述,采用24 h内新生SD大鼠大脑经木瓜蛋白酶与DNA 酶顺序消化可得到优质皮层神经元单细胞悬液。以5×105细胞/mL/孔密度接种7 d 后,得到的神经元生长状态稳定、纯度高,可作为研究各类神经疾病的细胞模型,为神经元的提取及原代培养提供了切实可行的方案。

