子痫前期患者血清CXCR4表达及与炎性因子相关性
王 婷 李爱萍 周莎莎
郑州大学第二附属医院(450014)
子痫前期(PE)妊娠期特有疾病,也是导致孕产妇和新生儿发病及死亡的主要原因之一[1-2]。特异性趋化因子受体4(CXCR4)在调节胎儿-母体微环境的免疫炎症反应中起重要作用[3]。 核转录因子-κB(NF-κB)可调节炎症免疫应答,p65亚基在经典的炎症激活途径中起关键作用[4]。因此,p65的表达水平可以反映出NF-κB的转录活性。在病理妊娠状态下,NF-κB p65高表达可引起子宫螺旋动脉重铸障碍,导致胎盘缺血、缺氧,释放多种炎性因子(如IL-6、TNF-a、hsCRP)进入母体血液循环,导致氧化应激及内皮细胞损伤[5]。笔者检测了子痫前期患者血清中CXCR4、NF-κB p65的表达,以及血清炎症因子(IL-6、TNF-a、hsCRP)水平,同时分析其相关性,旨在探讨SDF-1/CXCR4轴在子痫前期炎症机制中的作用。
1 对象与方法
1.1 对象
选择2020年1-10月在本院剖宫产孕妇60例,30例重度子痫前期孕妇作为观察组,30例健康孕妇为对照组。子痫前期诊断及分类标准参照第9版《妇产科学》[6]和《妊娠期高血压疾病诊治指南(2020)》[7],两组孕妇均为单胎妊娠、剖宫产术分娩。无慢性高血压、糖尿病、心脏疾病、肾病等病史。本研究经本院伦理委员会批准,并取得研究对象知情同意。
1.2 方法
1.2.1标本收集抽取空腹静脉血,留取1ml血清,2~8℃冰箱保存7d,长期保存置于-20℃。
1.2.2主要试剂与仪器RNA逆转录试剂盒(Toyobo,美国ABI 7500 Fast),引物(上海生工生物有限公司),紫外分光光度计(美国Thermo Nano Drop 1000),酶联免疫吸附试验试剂盒(武汉赛培生物科技有限公司)、酶标仪(Thermo Fishers)。
1.2.3总RNA提取、反转录及扩增提取观察组和对照组血清中CXCR4、NF-κBp65的总RNA,并使用紫外分光光度计测定RNA的纯度及水平。RNA反转录为cDNA并进行扩增,每组设置3个复孔,操作方法按试剂盒说明书。以目的基因的相对表达量作为判断标准,采用2-△△Ct的方法计算CXCR4、NF-κBp65 mRNA的相对表达量。引物序列见表1。
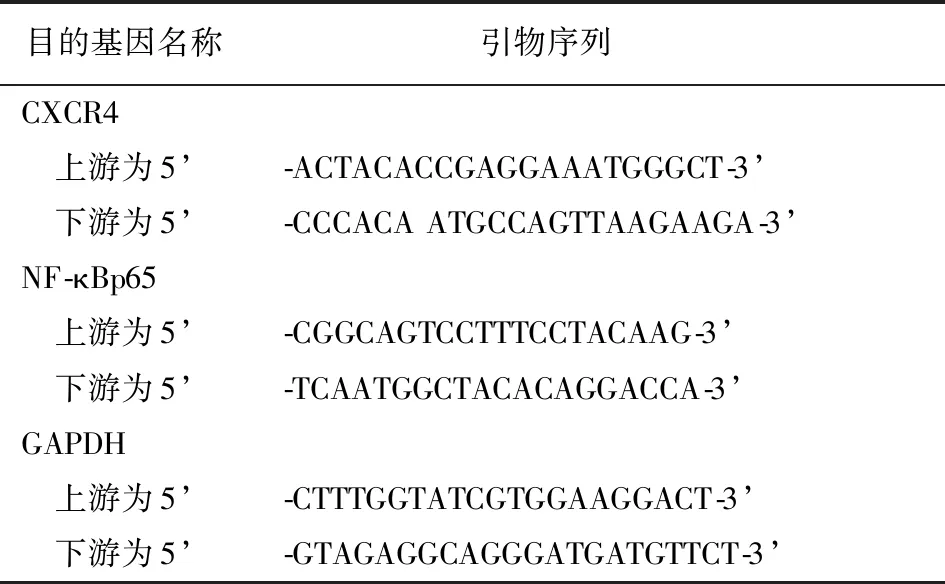
表1 目的基因及引物序列
1.2.4血清中炎症因子(IL-6、TNF-a、hsCRP)测定酶联免疫吸附实验检测血清中炎性因子水平。
1.3 统计学分析

2 结果
2.1 一般资料
两组对象年龄、分娩时体质指数(BMI)及分娩孕周均无差异(P>0.05)。观察组孕妇收缩压、舒张压及尿蛋白水平均高于对照组(P<0.05)。见表2。
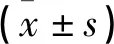
表2 两组对象一般资料比较
2.2 CXCR4、NF-κBp65 mRNA表达水平
观察组血清中CXCR4mRNA表达低于对照组,而NF-κBp65 mRNA的表达高于对照组(均P<0.05)。见表3。
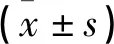
表3 两组血清CXCR4、NF-κBp65 mRNA表达
2.3 IL-6、TNF-a、hsCRP水平
观察组血清中IL-6、TNF-a、hsCRP水平均高于对照组(P<0.05)。见表4。
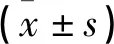
表4 两组血清炎症因子水平比较
2.4 相关性分析
观察组血清CXCR4mRNA与NF-κBp65 mRNA、IL-6、TNF-a、hsCRP呈显著负相关关系。见表5。对照组则无明显相关性。
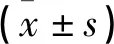
表5 观察组各指标相关性分析
3 讨论
研究认为PE是一种全身炎症性疾病,而且临床上尚缺乏有效的治疗手段[8]。早期妊娠时,滋养层细胞分泌的趋化因子和细胞因子可促进母胎界面的免疫炎症微环境,利于正常妊娠的进行,但过度的炎症反应会导致母胎界面免疫失衡,使滋养细胞功能紊乱、子宫螺旋动脉重铸障碍、血管内皮损伤,引起胎盘和胎儿缺氧及全身炎症[9-10]。
有研究发现,CXCR4与其配体基质细胞衍生因子-1(SDF-1)结合之后,可影响妊娠早期人绒毛组织中滋养细胞的侵袭和迁移功能,说明了SDF-1/CXCR4生物轴在母-胎界面的重要性[11-12]。CXCR4 也是一种小分子炎性细胞因子,与细胞表面的相关受体结合后引起免疫炎症反应[13]。与母胎界面的炎症反应一样,妊娠期孕妇血清中也会出现炎症反应。有研究通过构建小鼠模型发现,在妊娠早期,抑制CXCR4的表达会减少树突状细胞向母胎界面募集,同时可能会影响外周血中的免疫细胞的功能[14]。虽然SDF-1/CXCR4轴具有免疫调节功能,但在子痫前期患者中,SDF-1/CXCR4是如何参与炎症反应的发生发展,还鲜有报道,其具体细节尚需要进一步研究。笔者前期的实验发现与正常妊娠孕妇相比,子痫前期孕妇胎盘组织中CXCR4 表达水平明显下降[15],同时也在细胞水平进行了相应的验证实验,结论一致[16]。为了探讨PE患者血清中CXCR4的表达情况,本实验检测了子痫前期患者及正常孕妇血清中的CXCR4 mRNA的表达水平,发现其明显下降。
NF-κB是由五个亚基(p65、cRel、RelB、p50和p52)组成的转录因子家族[4,17],是多种炎症反应的上游调节因子。NF-κB信号通路的经典激活机制涉及p65亚基,通路激活后,p65亚基会转移到细胞核上,调节各种炎症基因的表达,最终可刺激细胞产生大量的炎性因子(IL-6、TNF-a、hsCRP等),这些炎性因子可作为配体增加NF-κB的活性,从而引发促炎级联反应,导致组织损伤[18-21]。本实验通过检测PE血清NF-κB p65 mRNA的表达水平,发现PE患者明显升高,同时检测了血清中炎性因子IL-6、TNF-a、hsCRP的水平,发现PE患者也有明显升高。因此,推测在PE的发生过程中,CXCR4与炎症反应的途径中相关的炎性因子可能有一定的相关性。为了验证这一推测,本实验又进行了CXCR4 mRNA与NF-κB p65 mRNA、炎性因子(IL-6、TNF-a、hsCRP)的相关性分析,发现子痫前期组孕妇血清CXCR4 mRNA与NF-κBp65mRNA、炎症因子(IL-6、TNF-a、hsCRP)均呈显著负相关关系。因此,推测CXCR4可能通过负向调控炎症反应的上游调节因子NF-κB p65的激活,从而激活机体的炎症免疫应答,释放大量的炎性因子(IL-6、TNF-a、hsCRP),参与子痫前期的发生、发展。
综上所述,CXCR4在PE发生的炎症机制中可能起到一个负向调控的作用。但SDF-1/ CXCR4轴是如何调控NF-κB信号通路对全身的循环或组织进行免疫调节的,还需要通过构建动物模型进行补充实验,同时在细胞水平进行验证。

