应用5%果糖饮水联合链脲佐菌素建立妊娠期糖尿病大鼠模型
刁天,姚灿灿,徐祥波,陈西华,贺斌*
(1.国家卫生健康委科学技术研究所,国家卫生健康委员会生殖健康工程技术研究中心,北京 100081;2.北京协和医学院研究生院,北京 100730)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一类最初诊断于妊娠中晚期(第二或第三阶段)的糖尿病,且孕妇之前并不存在明确的1型或2型糖尿病[1]。GDM的定义强调两点:一是糖尿病的症状于妊娠期(中或后期)出现;二是糖尿病的症状仅限于妊娠期,分娩后大多数恢复正常。近年来,随着人们生活方式的改变,GDM的发病率逐年上升,并成为妊娠期最常伴发的代谢紊乱性疾病[2]。2019年的一项系统回顾和荟萃分析研究显示,根据IADPSG标准,中国大陆GDM的总患病率为14.8%[3]。尽管GDM的患病率因诊断标准的不同而有所不同,但在最近几年中仍呈上升趋势,且随着中国三胎政策的放开,GDM的发病率在未来几年内很可能会持续增加[4]。GDM对母亲以及发育中的胎儿造成严重的不良影响,并对母亲以及婴儿以后的生活造成长远的不良影响,如患过GDM的母亲在以后的生活中罹患2型糖尿病的概率会大大增加,且其后代在儿童期及成年后罹患代谢性疾病的风险要高于正常母亲的后代[2,5]。
建立契合人类GDM主要特征的实验动物模型对于揭示GDM的发病机制及其对母亲及胎儿的影响机制、寻找干预靶点等至关重要。然而,GDM不是由单一的环境或遗传因素造成的,其风险因素包括肥胖、种族、遗传和家族史等[6],这使得建立完全重现该疾病的动物模型变得十分困难。目前常见的GDM建模方法有胰腺切除手术建模、药物诱导建模如链脲佐菌素(Streptozotocin,STZ)[7]和四氧嘧啶(Alloxan)、饮食诱导建模、基因编辑及转基因技术建模以及饮食合并STZ注射诱导建模等[8-10]。但现有的建模方法多数只能通过各种干预手段使实验动物在妊娠中后期出现高血糖,而这并不符合GDM妊娠中后期自发的出现血糖升高及糖耐量异常的主要特征,因此这些模型更适用于研究GDM对妊娠及胎儿的影响。因人类GDM绝大多数符合2型糖尿病特征[5],啮齿类动物中应用饮食合并注射STZ作为2型糖尿病常用的建模方法[11],已成为GDM最常用的建模方式[8-10]。该方法在妊娠前给予大鼠5周左右的高热量饮食并在妊娠期给予小剂量STZ,通常为25 mg/kg[10]。然而,这种建模方法在妊娠期给予STZ后,大鼠多出现血糖过高的情况,餐后血糖达到450~540 mg/dL(25~30 mmol/L),空腹血糖达到270~360 mg/dL(15~20 mmol/L)[9-10],且由于STZ的促进胰腺β细胞损伤作用,导致大鼠体内发生强烈的蛋白质水解和脂肪分解,因此体重会相对下降[11-12]。而在人类GDM时,血糖升高及糖耐量异常症状多数较轻,加上医疗以及药物的干预,严重的高血糖情况很少发生,实验动物过高血糖的表型也限制了这类模型在研究GDM中的应用。
因此,本研究给予雌性Wistar大鼠5周果糖饮水代替高热量饮食,并在妊娠期腹腔注射给予STZ,探索更符合人类GDM特征且均一性更好的实验动物GDM模型建模方法。
资料与方法
一、实验动物
雌性Wistar大鼠(8~9周龄,SPF Ⅱ级,北京维通利华实验动物技术有限公司)50只;雄性Wistar大鼠(8~9周龄,SPF Ⅱ级,北京维通利华实验动物技术有限公司)15只。饲养于国家卫生健康委科学技术研究所实验动物中心,环境温度20~22℃,相对湿度65%~85%,光照/黑暗12 h循环,所有大鼠均自由进食和饮水。
所有实验相关操作都遵循国家卫生健康委科学技术研究所动物伦理委员会的相关规定。
二、研究方法
1.GDM实验动物模型的建立:50只雌性Wistar大鼠适应一周后,随机分为5组:正常饮食+正常饮水合并溶剂注射(NC组,n=10);正常饮食+正常饮水合并STZ注射(STZ组,n=10);高热量饮食+正常饮水合并STZ注射(HDSTZ组,n=10);正常饮食+5%(5 g/100 ml)果糖(Sigma-Aldrich,美国)饮水合并STZ注射(F5STZ组,n=10);正常饮食+10%(10 g/100 ml)果糖饮水合并STZ注射(F10STZ组,n=10)。不同的饮食饮水持续5周后,雌雄大鼠按照1:1的比例于20:00 pm合笼,次日上午见阴栓则记为妊娠第0.5天(GD0.5)。GD6.5晚20:00 pm禁食,禁食期间自由饮水,GD7.5上午10:00 am,NC组雌性大鼠按照25 mg/kg体重腹腔注射溶剂(0.1 mol/L,pH4.5的柠檬酸钠缓冲液无菌溶液),其余各组雌性大鼠按照25 mg/kg体重腹腔注射STZ[9-10]。
北京科澳协力饲料有限公司的大/小鼠生长维持饲料和2型糖尿病饲料分别作为正常饲料和高热量饲料。2型糖尿病饲料含有10%猪油、20%蔗糖、2.5%胆固醇、0.5%胆酸钠和67%的大/小鼠生长维持饲料。5%和10%的果糖饮水每日配制。
腹腔注射用STZ(Sigma-Aldrich,美国)溶液现用现配:用0.1 mol/L 的柠檬酸钠缓冲液(pH4.5)无菌溶液配制1%(1 g/100 ml)的STZ溶液,溶液配制完成到注射前避光保存。
2.体重监测:分别在适应1周后的基线时(W0)、饮食/饮水干预1周后(W1)、2周后(W2)、3周后(W3)、4周后(W4)、5周后(W5)、GD7.5和GD19.5测量每组雌性大鼠的体重。
3.血糖水平及葡萄糖糖耐量检测:用罗氏血糖仪(Accu-Chek Active[型号GB],德国)分别在W0、W5、GD7.5、GD10.5、GD15.5和GD19.5检测各组雌性大鼠的空腹血糖(fasting blood glucose,FBG);在GD6.5、GD9.5、GD13.5、GD16.5、GD20.5测量各组大鼠的餐后血糖(postprandial blood glucose,PBG)。将雌性大鼠禁食10 h(9:00 am至19:00 pm)后测量FBG,禁食期间自由饮水,并将F5STZ组和F10STZ组的果糖饮水更换为正常饮用水;在非禁食状态下当日14:00 pm测量PBG。分别在W0、W5和GD19.5对各组雌性大鼠进行口服葡萄糖耐量试验(OGTT)。实验前将雌性大鼠禁食10 h(9:00 am至19:00 pm),禁食期间自由饮水,并将F5STZ组和F10STZ组的果糖饮水更换为正常饮用水。在用50%(0.5 g/1 ml)葡萄糖(北京索莱宝)溶液(用蒸馏水配置)灌胃之前,测量大鼠的FBG,并通过尾静脉采集空腹外周血于离心管中,用于后续生化分析。将50%的葡萄糖溶液按2 g/kg体重的剂量对大鼠进行灌胃,分别在0、10、15、30、45、60、90、120 min后测量血糖,并计算曲线下面积(AUC)。
4.血生化分析:将上述采集的空腹外周血于4℃、3 000 r/min离心15 min,收集血清。采用酶联免疫吸附试验(ELISA)测定空腹血清中胰岛素的浓度(Mercodia Rat insulin ELISA kit,瑞典);采用比色法(南京建成生物工程研究所)测定空腹血清中甘油三酯(TGs)的浓度。
5.胎盘及胎儿的数量和重量:于GD20.5处死大鼠,小心剥离胎盘及胎儿,拍照记录胎盘形态并称重,记录胎儿数量并称重。
三、统计学分析
结 果
一、各组大鼠的体重变化比较
在饮食/饮水干预5周(W5)时,与NC组[(268.00±4.234)g]比较,HDSTZ组[(283.40±4.372)g]和F10STZ组[(291.98±5.518)g]的体重均显著增加(P<0.05),而F5STZ组体重接近NC组(P>0.05)。GD7.5时,与NC组比较,F10STZ组的体重显著升高(P<0.05)(图1A)。在GD7.5给予STZ后,至GD19.5时各组的体重增幅结果显示,与对照组比较,除HDSTZ组体重增幅显著减少(P<0.05),其他各组尽管增幅有所下降,但差异无统计学意义(P>0.05)(图1B)。
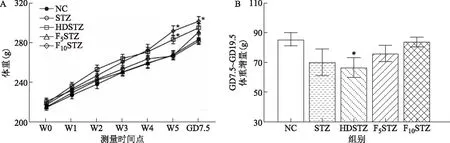
A:各组大鼠体重变化。与相同时间点NC组比较,*P<0.05;B:GD7.5~GD19.5体重增量。与NC组比较,*P<0.05。图1 各组大鼠的体重变化结果
二、各组大鼠的血糖检测结果
经过5周不同的饮食或饮水干预后,与NC组相比,F10STZ组的空腹血糖(FBG)水平显著升高(P<0.05),其余各组FBG水平尽管略有上升,但差异无统计学意义(P>0.05)(图2A);各组的餐后血糖(PBG)差异无统计学意义(P>0.05)(图2B)。
当给予STZ注射后,STZ组的血糖在GD9.5时有所升高(150 mg/dL左右),GD13.5后恢复至NC组水平;HDSTZ组血糖则剧烈升高,PBG水平高达350~400 mg/dL,FBG也达到250~300 mg/dL;F5STZ组和F10STZ组的PBG波动在250~300 mg/dL,FBG波动在150~200 mg/dL,介于NC组与HDSTZ组之间(图2C)。由各组大鼠GD16.5时PBG分布情况可以看出,HDSTZ组、F5STZ组和F10STZ组分别有60%(n=6)、10%(n=1)和30%(n=3)的大鼠出现严重的高血糖(PBG>360 mg/dL)(图2D)。至妊娠末期(GD19.5和GD20.5)各组的FBG和PBG均有所降低(图2C)。
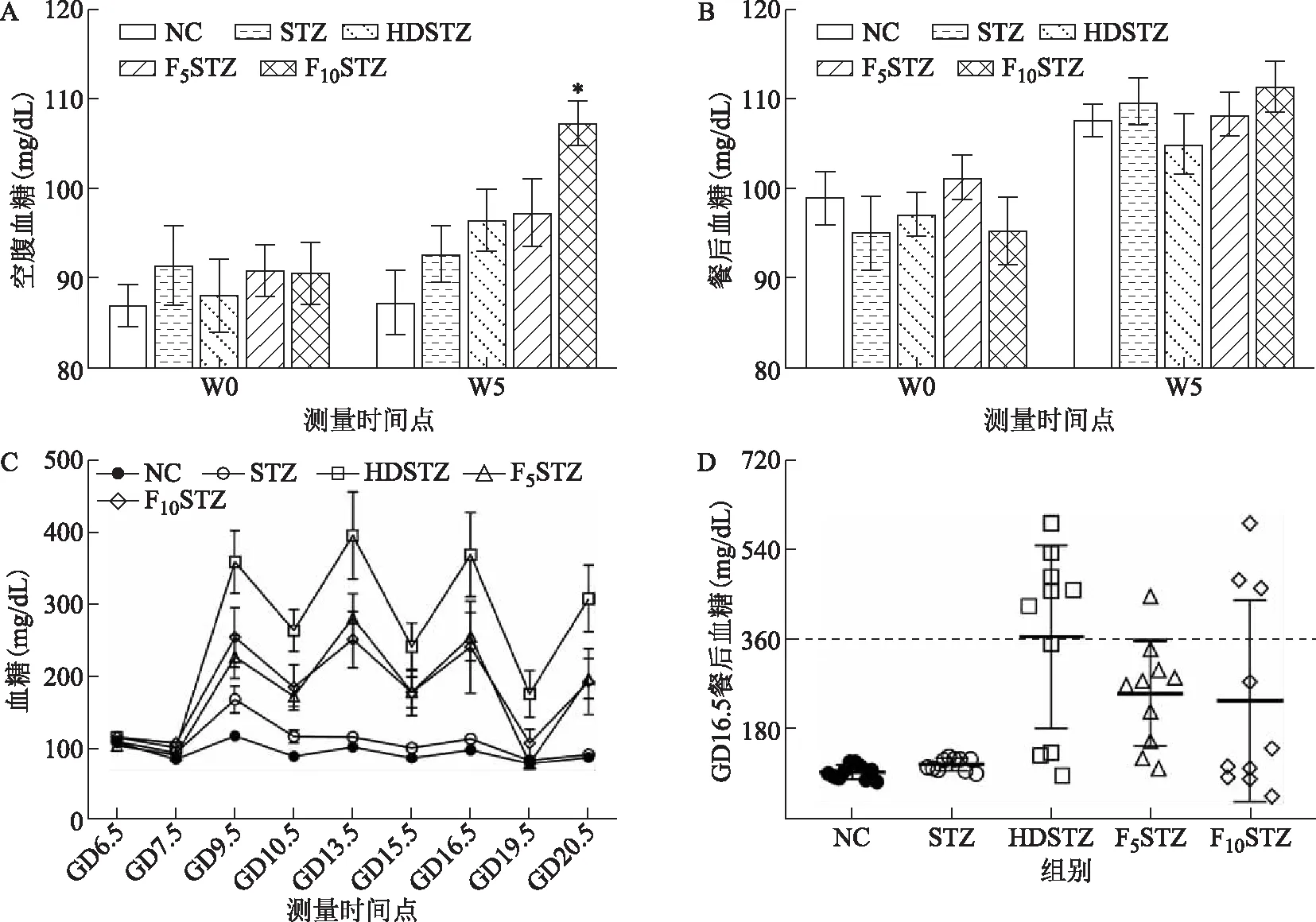
A:饮食或饮水干预5周前后各组大鼠FBG水平的变化;B:饮食或饮水干预5周前后各组大鼠PBG水平的变化;C:妊娠期间各组大鼠的FBG及PBG水平变化,其中GD6.5、9.5、13.5、16.5和20.5为PBG水平;GD7.5、10.5、15.5和19.5为FBG水平;D:各组大鼠GD16.5时PBG散点图。与相同时间点NC组比较,*P<0.05。图2 各组大鼠的血糖水平变化结果
三、各组大鼠口服葡萄糖耐量试验(OGTT)结果比较
口服葡萄糖耐量试验结果显示:在W0时,各组的糖耐量水平相当(图3A、D);在W5时,与NC组相比,F5STZ组和F10STZ组的大鼠在被给予50%葡萄糖溶液灌胃后,血糖峰值明显升高且2 h血糖仍高于NC组(图3B),AUC显著增加(P<0.01)(图3D);在GD19.5时,与NC组相比,HDSTZ组、F5STZ组和F10STZ组的大鼠在被给予50%葡萄糖溶液灌胃后,血糖峰值明显升高,HDSTZ组和F10STZ组2 h后血糖仍分别高达约330 mg/dL和240 mg/dL,F5STZ组2 h后血糖约为180 mg/dL,仍高于空腹时水平(图3C),3组的AUC显著增加(P<0.01),且以HDSTZ组最为显著(图3D)。
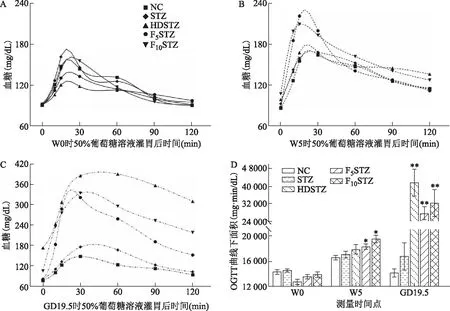
A:基线时(W0)各组大鼠在50%葡萄糖溶液灌胃后血糖水平随时间的变化;B:饮食或饮水干预5周后(W5)各组大鼠在50%葡萄糖溶液灌胃后血糖水平随时间的变化;C:GD19.5各组大鼠在50%葡萄糖溶液灌胃后血糖水平随时间的变化;D:3次OGTT试验结果的AUC统计。图B、C图例同图A;与相同时间点NC组比较,*P<0.05,**P<0.01。图3 各组大鼠的葡萄糖耐量变化结果
四、各组大鼠空腹血清胰岛素和甘油三酯浓度变化比较
在W5时,与NC组相比,HDSTZ组和F10STZ组的空腹血清胰岛素浓度均显著升高(P<0.05);在GD19.5时,与NC组相比,其余4组的空腹血清胰岛素浓度均显著升高(P<0.05)(图4A)。在W5时,与NC组相比,F5STZ组和F10STZ组的空腹血清甘油三酯浓度均显著升高(P<0.05);在GD19.5时,与NC组相比,其余4组的空腹血清甘油三酯浓度均显著升高(P<0.05)(图4B)。
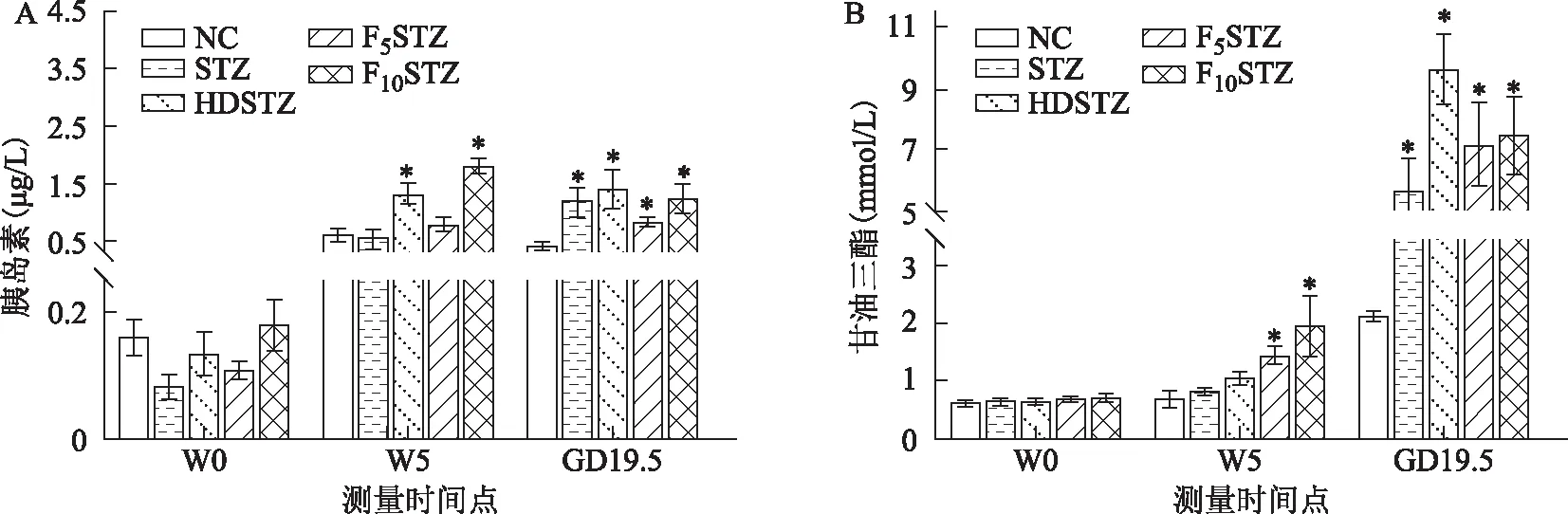
A:基线时(W0)、饮食或饮水干预5周后(W5)和GD19.5各组大鼠空腹血清中的胰岛素浓度;B:基线时(W0)、饮食或饮水干预5周后(W5)和GD19.5各组大鼠空腹血清中的甘油三酯浓度。与相同时间点NC组比较,*P<0.05。图4 各组大鼠空腹血清胰岛素和甘油三酯浓度变化结果
五、各组大鼠胎盘大体形态学比较
与NC组(PBG稳定在90~180 mg/dL)比较,F5STZ组(PBG波动在270~360 mg/dL)大鼠的胎盘体积略增大,颜色无明显变化;HDSTZ组(PBG波动在450~540 mg/dL)大鼠的胎盘体积略增大,表面颜色更深,呈暗红色(图5)。

图5 NC组、F5STZ组和HDSTZ组大鼠的胎盘大体形态学改变
六、各组大鼠妊娠结局比较
从表1中可以看出,与NC组比较,HDSTZ组的平均胎鼠数量显著降低(P<0.05),与取材时该组部分孕鼠可见1~3个吸收胎相一致;F5STZ组的平均胎鼠数量无显著改变(P>0.05)。HDSTZ组和F5STZ组的胎鼠重量均显著高于NC组(P<0.05)。STZ组、HDSTZ组、F5STZ组和F10STZ组的胎盘重量相对于NC组均显著升高(P<0.05)。
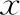
表1 各组大鼠胎鼠数量及重量和胎盘重量结果比较(-±s)
讨 论
本研究应用5周正常饮食合并5%果糖饮水并于GD 7.5 按25 mg/kg体重腹腔注射STZ建立妊娠期糖尿病实验动物模型,与常用的5周高热量饮食并于妊娠期按25 mg/kg体重注射STZ相比,妊娠期大鼠高血糖症状较轻,且妊娠末期葡萄糖耐量异常程度较轻,更加契合人类GDM特征。
目前GDM实验动物模型最常用的建模方法为5周高热量饮食,并于妊娠期给予小剂量STZ[8-10]。经过5周的饮食诱导,大鼠出现肥胖、糖耐量异常、高脂血症等病理现象;在给予STZ后,大鼠出现高血糖[9-10],符合GDM慢性胰岛素抵抗背景下的葡萄糖耐受不良的主要特征。然而,这种方法诱导的高血糖大鼠的PBG高达450~540 mg/dL(25~30 mmol/L),已达到正常Wistar大鼠PBG[(101.7±29.34)mg/dL,(5.65±1.63)mmol/L][13]的5倍左右;FBG达到270~360 mg/dL(15~20 mmol/L)[9-10],也高达正常Wistar大鼠FBG[(71.1±23.58)mg/dL,(3.95±1.31)mmol/L][13]的4倍左右,表明此类建模方法诱导的GDM大鼠妊娠期的血糖明显过高。推测可能的原因为高热量饮食诱导了肥胖表型,因此当妊娠期按照25 mg/kg体重注射STZ时,STZ的实际注射量是比较高的,可能过度损伤了胰岛β细胞,故出现了严重的血糖升高,过高的血糖水平还会导致吸收胎的比率增加[14]。而在人类GDM时,由于医疗和药物等的干预,这种严重高血糖的情况很少出现,因此这种模型可能更适用于研究妊娠期严重的高血糖对妊娠及胎儿等的影响。此外,GD7.5给予STZ后,HDSTZ组GD7.5至GD19.5的体重增幅显著减少,提示可能与HDSTZ组的胚胎数量减少有关(表1)。
鉴于果糖在诱导胰岛素抵抗方面的能力[15]以及10%果糖饮水已成为诱导大鼠代谢综合征常用的建模方法[16],本研究尝试给予雌性大鼠5周正常饮食及5%或10%果糖饮水(F5STZ组、F10STZ组)。处理5周后(W5),与其他3组相比,F5STZ组和F10STZ组大鼠即出现了糖耐量异常(图3B、D),表明果糖诱导大鼠出现糖耐量异常的能力要强于单纯的高热量饮食。至GD7.5时,与正常饮食饮水对照组(NC组)相比,F5STZ组和F10STZ组的体重也呈现升高趋势,但未及高热量饮食组(HDSTZ组)明显(图1A)。在给予STZ后,妊娠期HDSTZ组、F5STZ组和F10STZ组均表现明显的高血糖及葡萄糖耐受不良,其中分别有60%、10%和30%的大鼠出现严重的高血糖(PBG>360 mg/dL)(图2C),以F5STZ组出现严重高血糖的比例最低,且F5STZ组血糖的一致性更佳。鉴于GD7.5时F5STZ组的体重与HDSTZ组相比无明显差异,但注射STZ后,F5STZ组的血糖升高得更加温和(图1B);且F10STZ组的体重要高于HDSTZ组,但其出现严重高血糖的比例要低于HDSTZ组,表明大量的果糖摄入可能通过某种作用机制缓解了STZ对大鼠胰岛β细胞的破坏,或者诱导了某种代偿性机制以拮抗血糖异常。OGTT结果提示HDSTZ、F5STZ和F10STZ组在GD19.5时表现出明显的葡萄糖耐受不良,且HDSTZ、F10STZ组较F5STZ组尤为显著(图3C、D)。另外,实验各组(STZ组、HDSTZ组、F5STZ组和F10STZ组)在GD19.5时均出现了脂代谢异常,以HDSTZ组最为显著(图4B)。因此,5周5%果糖饮水并于GD7.5腹腔注射STZ这种建模方法诱导的高血糖、糖耐量异常及血脂异常表型均较轻,更符合人GDM 的特征。
此外,尽管肥胖是GDM最大的诱因,临床上仍有相当一部分GDM患者的体重在正常范围内[17],因此联合应用正常饮食+5%果糖饮水和妊娠期STZ注射更适用于研究这类情况。同时,F5STZ组的胚胎数量未受到影响,且与NC组相比,F5STZ组的胎鼠体重、胎盘重量也显著增加(P<0.05)(表1),符合妊娠期糖尿病伴随出现“大胎儿”和“大胎盘”的特点[18-19]。而HDSTZ组大鼠妊娠期血糖过高,并呈现暗红色,很可能已经严重影响了胎盘的血管发育(图5)。
综上所述,本研究探索出了一种新的大鼠GDM模型建模方法,该方法大鼠血糖升高及糖耐量异常均较温和,更加契合人GDM特征,因此应用这种建模方法建立GDM动物模型对于揭示GDM对妊娠、胎盘及胎儿等的影响及其机制更有意义。

