高雄激素血症对PCOS小鼠卵巢中非钠依赖性葡萄糖转运蛋白的影响
陈田,孙镠佳,项雨,丁慧敏,葛红山*
(1.南京中医药大学,南京 210023;2.泰州市人民医院,泰州 225300)
多囊卵巢综合征(PCOS)是育龄女性最常见的内分泌紊乱疾病,以高雄激素、胰岛素抵抗、囊性卵巢和不孕症为主要特征[1-2]。其病因至今尚未阐明,可能涉及遗传、神经内分泌、环境等多方面因素。高雄激素血症(HA)是PCOS的主要特征之一,在临床上可表现为多毛症、脂溢症、痤疮、雄激素性脱发等[3-4]。既往多个临床研究发现,HA与PCOS患者的糖代谢紊乱有关[5-7],但其影响PCOS患者糖代谢的具体机制及通路仍不明确。
葡萄糖是哺乳动物细胞能量代谢的主要来源,葡萄糖转运主要由细胞膜上的葡萄糖转运蛋白家族来完成[8]。哺乳动物主要存在两种葡萄糖转运蛋白家族:非钠依赖的葡萄糖转运蛋白(GLUTs)家族和钠依赖的葡萄糖转运蛋白(SGLTs)家族[9]。SGLTs家族有12个成员,仅SGLT1、2在转运葡萄糖方面发挥重要作用,且SGLT1主要在肠中表达,SGLT2主要在肾脏中表达;而GLUTs家族的14个成员中有11个参与葡萄糖的运输,它们具有不同的组织表达特异性、底物特异性和动力学特异性[10]。在正常生理状态下,卵巢的葡萄糖转运主要是依靠GLUTs家族[11]。本研究重点聚焦于几个关键的GLUTs成员:GLUT1、3、4、8、12,其中GLUT4、8、12也被认为是胰岛素依赖性糖转运蛋白,即上游胰岛素信号通路的改变会影响它们的易位及转运能力[12-13]。已有研究表明,GLUTs在PCOS患者各组织中的表达会发生改变,例如,在PCOS患者的脂肪细胞中GLUT4的表达降低,而GLUT1没有代偿性增加[14]。但对于PCOS卵巢中GLUTs表达模式和功能的研究目前相对较少。对于PCOS糖代谢异常机制的研究主要集中在胰岛素抵抗对糖代谢的影响上,HA作为PCOS的决定性特征之一[15],当前关于其影响PCOS糖代谢受损机制的研究较少。此外,颗粒细胞状况是决定卵母细胞质量的关键[11,16],高雄状态是否会直接影响颗粒细胞的葡萄糖转运能力,进而影响其能量代谢目前仍不清楚。因此,本研究将通过建立PCOS模型和体外颗粒细胞培养模型,探讨HA环境对整个卵巢及对颗粒细胞GLUTs表达模式的影响,以期为探讨PCOS的发病机制以及寻找潜在的治疗靶点提供实验和理论依据。
材料和方法
一、实验动物
3周龄ICR小鼠购自扬州大学动物实验中心(许可证号:SCXK(苏)2017-0007),适应性喂养4 d后,随机分成2组:对照组8只、脱氢表雄酮(DHEA)组16只。饲养条件:环境温度20~23℃,湿度40%~60%,自由进水饮食,每日光照12 h。普通生长繁殖饲料(货号:1010002)购于江苏省协同医药生物有限公司。
二、主要试剂和仪器
DHEA、睾酮购于上海源叶生物科技有限公司;芝麻油购于上海麦克林生化科技有限公司;BCA试剂盒购于上海碧云天生物技术有限公司;重组兔抗GLUT1抗体(ab115730)、兔抗GLUT4抗体(ab33780)、重组兔抗GLUT8抗体(ab169779)购于美国Abcam公司;重组兔抗GLUT3多克隆抗体(JA50-31)购于美国赛默飞公司;兔抗GLUT12抗体购于北京博奥森生物技术有限公司;兔抗β-actin多克隆抗体购于美国Bioworld公司;HRP标记的山羊抗兔二抗购自武汉爱博泰克生物科技有限公司;KGN人卵巢颗粒细胞(货号:ZQ0916)购于上海中乔新舟生物科技有限公司;胎牛血清购自美国Sigma-Aldrich公司;细胞培养专用青链霉素混合液(100×)、二甲基亚砜(DMSO,细胞培养级)、1×PBS缓冲液(pH 7.2~7.4)等购于北京索莱宝科技有限公司;血糖仪购自瑞士罗氏公司;XD-202倒置生物显微镜购自南京江南永新光学有限公司。
三、实验方法
1.PCOS动物模型建立:按小鼠体重排序,采用随机数字表法进行随机分组后,每日称量小鼠体重,DHEA组小鼠连续21 d每日固定时间段颈部皮下注射0.1 ml浓度为60 mg/kg的DHEA(溶剂为含95%乙醇的芝麻油,芝麻油和乙醇的体积比9∶1),对照组每日颈部皮下注射0.1 ml含95%乙醇的芝麻油(体积比同前)。
2.血糖测定及糖耐量测定:提前15 h禁食不禁水,然后进行腹腔内注射葡萄糖耐量试验(IPGTT)。根据小鼠体重以2 g/kg注射葡萄糖溶液(浓度为400 mg/ml),例如,体重20 g的小鼠注射剂量为0.1 ml,并分别于0、15、30、60和120 min采集尾静脉血,并用血糖仪测量血糖。
3.血清睾酮水平测定:腹腔注射水合氯醛麻醉后眼球取血,3 000g离心10 min,吸取上清,采用化学发光免疫法检测血清睾酮水平。使用美国Beckman Dxi800仪器及配套试剂盒进行检测。
4.卵巢组织HE染色及卵泡计数:颈部脱臼法处死小鼠后,取双侧卵巢组织,在解剖显微镜下去除其表面的脂肪组织及覆盖包膜,完整剥离卵巢。对照组取6颗,DHEA组取9颗分别置于4%多聚甲醛中固定。其余卵巢组织置于-80℃冰箱冻存备用。固定后的卵巢经常规脱水,石蜡包埋,5 μm厚度切片,常规脱蜡,水化,苏木精染色5 min,伊红衬染2 min,脱水,透明,封片,显微镜下观察各组小鼠的卵巢形态学变化。采用双人盲法阅片,取卵巢最大横截面,分别计数生长卵泡、小卵泡和闭锁卵泡、囊状卵泡及黄体数目。
5.人KGN细胞培养及睾酮干预:人KGN细胞系在37℃水浴中快速解冻,严格按照无菌操作转入细胞培养瓶中,用含10%胎牛血清(FBS)的高糖培养基在37℃、5%CO2培养箱中培养。根据细胞的生长状态,每2 d更换培养基1次,待细胞融合度为80%时,用胰蛋白酶消化液将细胞进行传代培养,当细胞传代培养3代以上时,选取细胞状态最好的一代贴壁细胞加入不同浓度(0、1、10 μmol/L)的睾酮培养24 h,收集细胞进行后续实验。
6.蛋白免疫印迹(Western Blot)实验:将对照组和DHEA组小鼠的卵巢组织及不同睾酮浓度处理组的KGN细胞,分批提取总蛋白,使用BCA试剂盒测量各组蛋白浓度;提取后的蛋白行12%SDS-PAGE电泳,将分离的目的蛋白转至PVDF膜上,置入5%脱脂奶粉-TBST中摇床上室温封闭2 h,TBST洗涤3次,每次10 min,分别加入对应的一抗[GLUT1抗体(1∶1 000)、GLUT3抗体(1∶1 000)、GLUT4抗体(1∶1 000)、GLUT8抗体(1∶1 000)、GLUT12抗体(1∶1 000)、β-actin抗体(1∶4 000)],4℃摇床孵育过夜;次日,PVDF膜用TBST洗涤3次,每次10 min,分别加入HRP标记的山羊抗兔IgG(1∶5 000)二抗室温摇床孵育2 h,TBST洗涤3次,每次10 min。目的蛋白条带应用化学发光法进行检测,将每次实验中目的蛋白的灰度值与内参β-actin比较,使用Image J软件进行半定量分析。
三、统计学分析

结 果
一、建模后小鼠体重、血清睾酮水平及脂肪分布变化
两组小鼠给药前体重无显著性差异(P>0.05)。经过21 d干预,DHEA组和对照组小鼠体重均有所增加;DHEA组小鼠给药后体重较对照组略增加,差异尚无统计学意义(P>0.05);但DHEA组小鼠体重增重率显著高于对照组(P<0.05)(表1)。每组随机取3只小鼠进行血清睾酮检测,DHEA组小鼠血清睾酮水平(均>55.4 nmol/L),显著高于对照组[(40.9±4.9)nmol/L][P<0.05;因DHEA组测量值超出了检测范围,统计学分析时以(55.48±0.0)nmol/L计算]。解剖发现,DHEA组小鼠腹部脂肪明显增厚,且卵巢、子宫周围也包绕着更多的脂肪组织(图1A~D)。小鼠体重增长情况、血清睾酮水平及脂肪分布特点均符合建模预期,认为PCOS小鼠模型建立成功。
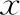
表1 两组小鼠体重变化情况(-±s)
A:对照组小鼠腹部脂肪;B:DHEA组小鼠腹部脂肪;C:对照组小鼠子宫及卵巢;D:DHEA组小鼠子宫及卵巢。蓝色箭头示子宫,红色箭头示卵巢。图1 各组小鼠腹部解剖图
二、小鼠卵巢形态学变化
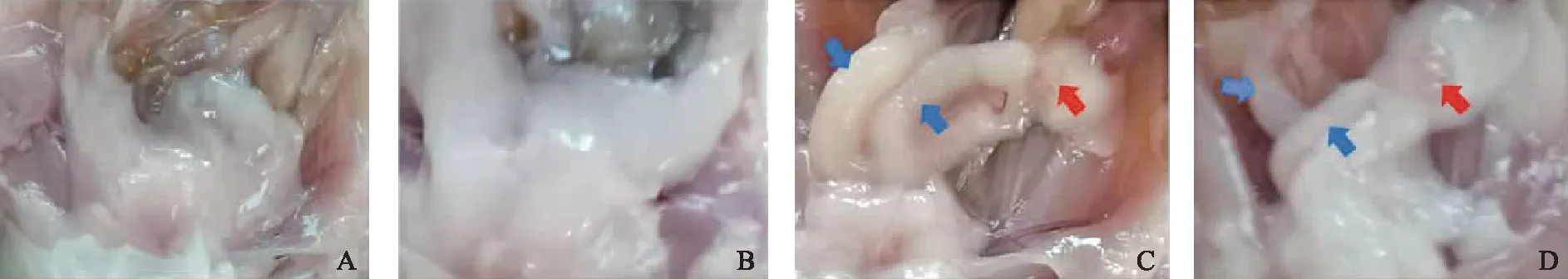
对照组取6张小鼠卵巢切片,DHEA组取9张切片,分别取卵巢的最大横截面全视野进行观察和计数。对照组卵巢形态正常、色泽红润,在光镜下可见不同发育阶段的卵泡,颗粒细胞层排列整齐且致密,多为8~9层(图2A)。与对照组相比,DHEA组小鼠卵巢呈多囊样改变,出现囊性卵泡,该卵泡内卵母细胞消失,颗粒细胞层数量减少至2~4层(图2B)。进行细胞计数发现,DHEA组小鼠卵巢内总卵泡数、闭锁卵泡和小卵泡数较对照组显著增加(P<0.01),生长卵泡数显著减少(P<0.05),黄体数量呈减少趋势,囊状卵泡数量呈增多趋势(表2)。DHEA组小鼠卵巢的形态学变化与PCOS小鼠卵巢相符,再次验证了建模成功。
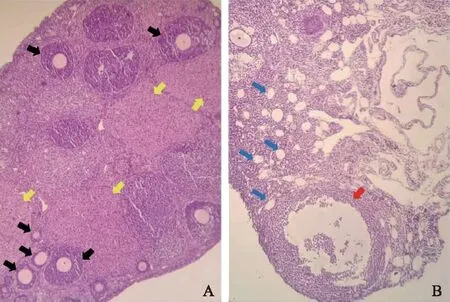
A:对照组卵巢组织:黑色箭头示生长卵泡,黄色箭头示黄体;B:DHEA组卵巢组织:红色箭头示囊状卵泡,蓝色箭头示闭锁卵泡和小卵泡。图2 两组小鼠的卵巢组织(HE染色,×200)
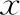
表2 两组小鼠卵巢组织中各级卵泡及黄体数量比较(-±s)
三、两组小鼠糖耐量情况比较
DHEA组的空腹血糖水平[(6.6±0.2)mmol/L]显著高于对照组[(5.3±0.2)mmol/L](P<0.01)。IPGTT实验结果显示:DHEA组在葡萄糖腹腔注射给药15 min后血清葡萄糖水平较对照组略增加,差异尚无统计学意义(P>0.05);给药30、60、120 min后血清葡萄糖水平较对照组显著增加[分别为(7.8±1.1) vs.(12.8±1.4) mmol/L、(6.5±1.2) vs.(9.5±0.9) mmol/L和(4.5±0.4) vs.(6.4±0.6) mmol/L](P<0.01)(图3)。提示DHEA组小鼠存在糖耐量异常、糖代谢异常情况。
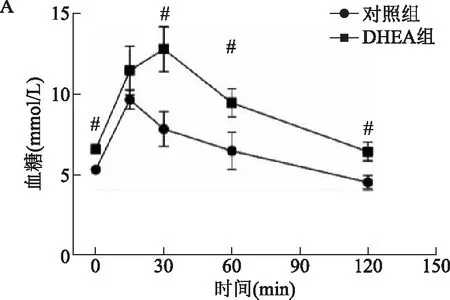
与对照组比较,#P<0.01。图3 两组小鼠IPGTT实验中不同时间节点的血糖水平比较
四、卵巢中GLUTs蛋白的表达
通过Western Blot法分别检测GLUT1、3、4、8、12在小鼠卵巢中的表达,结果显示,GLUT1和GLUT12在对照组和DHEA组中的蛋白表达水平变化不大(P>0.05);与对照组相比,GLUT3、GLUT4、GLUT8在DHEA组的蛋白表达水平均显著下降(P<0.05)(图4)。
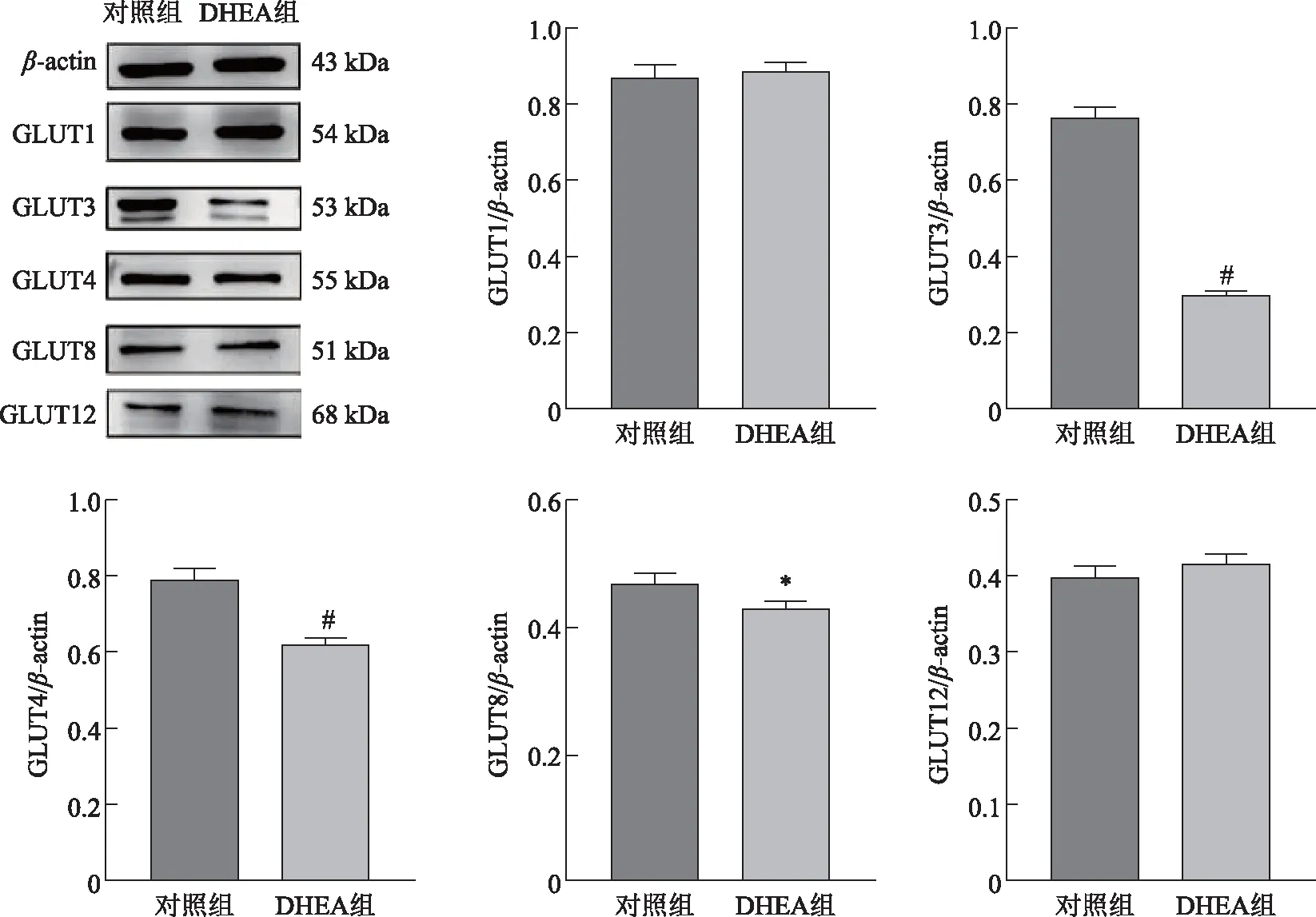
注:与对照组比较,*P<0.05,#P<0.01。图4 Western Blot法检测两组小鼠卵巢组织中GLUTs蛋白表达的条带图及灰度值分析
五、睾酮干预的人KGN细胞系中GLUTs蛋白表达
为了进一步探讨HA对人KGN细胞中GLUTs表达的影响,分别以睾酮浓度0、1、10 μmol/L处理人KGN细胞,观察不同浓度下细胞的生长情况发现,各组细胞均形态正常,睾酮干预对KGN细胞的增殖效应无明显影响(图5)。并通过Western Blot法检测3组中GLUTs蛋白表达水平的变化,结果显示:GLUT1在10 μmol/L睾酮组中表达显著低于对照组(P<0.05),但在0 μmol/L睾酮组和1 μmol/L睾酮组中的表达水平变化不大;与睾酮0 μmol/L组相比,GLUT4在睾酮1 μmol/L组中的表达有下降趋势,但尚无显著性差异(P>0.05),而在睾酮10 μmol/L组中GLUT4蛋白表达显著减少(P<0.05);GLUT8对睾酮最敏感,1 μmol/L睾酮就会引起GLUT8蛋白表达的显著降低(P<0.01);GLUT3、GLUT12在不同睾酮浓度的3组中表达水平变化不大,无显著性差异(P>0.05)(图6)。

图5 不同睾酮浓度处理0 h和24 h时人KGN细胞的增殖情况(×200)

注:与对照组比较,*P<0.05,**P<0.01。图6 Western Blot法检测不同睾酮浓度下人KGN细胞中GLUTs蛋白表达条带图及灰度值分析
讨 论
PCOS作为女性最常见的内分泌紊乱疾病,会导致一系列代谢问题,例如肥胖症、代谢综合征、高胰岛素血症、胰岛素抵抗、肝脂肪变性和血脂异常等,还会增加Ⅱ型糖尿病和心血管疾病的风险[17]。HA作为PCOS的决定性特征之一[15],目前许多临床研究发现其与PCOS的代谢紊乱相关,例如:女性体内过量的雄激素可以通过肝脏雄激素受体破坏代谢功能[18];成年早期HA与中年葡萄糖代谢异常呈正相关[19]等,但具体机制尚未阐明。
葡萄糖作为亲水分子,无法自由通过疏水的生物膜,其进出细胞主要依靠膜上的GLUTs运载。迄今,已知的GLUTs家族有14位成员,根据序列相似性,GLUT家族被分为3类:I类(GLUT1~4和14)、Ⅱ类(GLUT5、7、9和11)和Ⅲ类[GLUT6、8、10、12和氢离子(H+)/肌醇协同转运体(HMIT)][20]。关于PCOS糖代谢异常的可能机制,目前研究最多的是胰岛素抵抗通过PI3K-AKT通路对GLUT4产生影响,造成GLUT4表达下调、易位障碍,导致其葡萄糖转运能力减弱,从而损伤糖代谢[21]。有学者对GLUT1、4在PCOS脂肪细胞中的表达与胰岛素介导和非胰岛素介导的全身葡萄糖摄取关系进行研究,他们认为因胰岛素介导的葡萄糖摄取降低和胰岛素分泌增加继发的胰岛素抵抗部分归因于脂肪细胞中GLUT4表达的减少,且不伴非胰岛素介导的GLUT1葡萄糖转运代偿性增加[14]。这一发现引起我们的思考,当以GLUT4为代表的胰岛素介导的葡萄糖转运受损时,同为胰岛素依赖性糖转运蛋白的GLUT8和12的表达和转运功能会发生怎样的变化?是否存在一些“躲避”机制?那么非胰岛素介导的GLUT1和GLUT3能否发挥代偿作用,弥补受损的胰岛素介导的葡萄糖转运?这些问题都值得进一步探究。
GLUT1负责“基础”葡萄糖摄取,是在机体所有器官中普遍存在的糖转运蛋白[22]。本研究发现,GLUT1在睾酮干预的人KGN细胞中表达较稳定,但随着睾酮浓度的升高,其表达也会下调。GLUT3主要在对葡萄糖有高需求的组织中表达,例如大脑、精子、胎盘滋养细胞等[23]。本研究发现,DHEA建模成功的PCOS小鼠中GLUT3蛋白表达显著降低,而仅用睾酮对人KGN细胞进行干预时,GLUT3表达却没有明显变化。GLUT4作为胰岛素反应性葡萄糖转运蛋白,主要存在于脂肪、心脏和骨骼肌等胰岛素敏感性组织中,GLUT4在全身葡萄糖稳态和Ⅱ型糖尿病的发病机制中起重要作用[10]。本研究结果显示,高浓度(10 μmol/L)睾酮干预时人KGN细胞中GLUT4表达会显著降低。提示PCOS状态下,HA可能通过影响GLUT4的表达,加重糖代谢的紊乱,继而导致胰岛素抵抗的加重。GLUT8在睾丸中高水平表达,在子宫、卵巢和脂肪中低表达[24],本研究结果显示GLUT8在DHEA建模成功的PCOS 小鼠卵巢和睾酮干预的人KGN细胞中均表达下调,提示它是对睾酮影响最敏感的糖转运蛋白。GLUT12主要在小肠、胎盘、骨骼肌和脂肪组织中表达[25],但本研究中它在PCOS模型小鼠的卵巢和睾酮干预的人KGN细胞中表达水平变化都不大,其中是否存在了一些“躲避”机制值得进一步探索。
本研究参照之前文献方法及判断标准[26-27],通过对小鼠体重变化、血清睾酮水平、空腹血糖值、糖耐量变化以及卵巢形态学改变等的分析来验证DHEA组小鼠PCOS建模成功。通过Western Blot实验证实了PCOS模型小鼠卵巢、人KGN细胞中存在GLUT1、3、4、8、12蛋白的表达,且PCOS小鼠卵巢中多个GLUTs蛋白的表达会发生变化。并首次运用细胞实验,探讨单一高雄环境对人KGN细胞中GLUTs蛋白表达的影响,发现HA影响了多个GLUTs蛋白的表达,并且对不同的GLUTs产生的作用不同。
综上,本研究通过动物模型和细胞学实验发现PCOS小鼠卵巢中的多个GLUTs的表达发生了改变;HA状态会显著影响小鼠卵巢和KGN细胞中GLUTs的表达模式,加剧PCOS卵巢中糖代谢的紊乱;HA对GLUTs蛋白的影响可能是其引起PCOS糖代谢异常的重要机制。有研究认为,通过控制糖转运蛋白来遏制肿瘤的生长是肿瘤治疗的一个机会[28];同理,对于PCOS患者而言,对个别重要的GLUTs进行靶向治疗或许也具有重大意义,希望本研究结果能为探讨PCOS的发病机制以及寻找潜在的治疗靶点提供一定的实验和理论依据。但本研究采用动物模型模拟PCOS患者的生殖与代谢特征,与更为复杂且精密的人体之间仍存在差距;且关于KGN细胞实验中一些糖代谢指标的变化情况仍有待完善,后续还需要进一步研究HA影响PCOS患者糖代谢的具体机制。

