GnRH-a降调节在整倍体单囊胚解冻移植中的临床应用分析
贾博钦,蒋彦,宋歌,朱玉林,吴小华
(石家庄市妇产医院,石家庄 050011)
胚胎植入前遗传学检测(PGT)后整倍体冻融胚胎移植(FET)成功的关键因素之一是选择恰当的内膜准备方案。常用的内膜准备方案有自然周期方案、人工周期方案,自然周期方案适用于月经周期规律者,但需要患者连续监测卵泡,且经常由于卵泡发育异常而取消周期可能性较大[1]。人工周期方案具有给药方便、复诊次数少和周期取消率低等优点,临床应用较自然周期更加广泛,包括单纯激素替代方案及加用促性腺激素释放激素激动剂(GnRH-a)的降调节联合激素替代方案,加用GnRH-a预处理可实现垂体下调,更好地避免自发排卵和周期取消[2]。目前大量研究认为,降调节联合激素替代方案较单纯激素替代方案能明显改善子宫内膜异位症、多囊卵巢综合征(PCOS)等人群的妊娠结局[3-4]。但这两种人工周期内膜准备方案在无明显合并症的普通人群中研究较少。有研究显示,在普通人群中GnRH-a降调节联合激素替代内膜准备方案较单纯激素替代方案的冻融胚胎移植的妊娠结局没有明显差别[5-6];但也有研究显示,普通人群在解冻移植前应用GnRH-a降调节联合激素替代内膜准备方案较单纯激素替代方案获得更高的临床妊娠率[7-9]。目前关于PGT后解冻移植更适于采用哪种人工周期内膜准备方案尚缺乏相关研究,而PGT助孕人群中无明显合并症的普通人群居多,故研究PGT助孕普通人群对指导PGT临床更有意义。本研究回顾性分析本院应用PGT后行GnRH-a降调节联合激素替代方案及单纯激素替代方案FET的临床结局,探讨GnRH-a降调节联合激素替代内膜准备方法对整倍体单囊胚解冻移植妊娠结局的影响。
材料与方法
一、研究对象
回顾性分析2019年3月至2021年6月在本院生殖医学中心PGT检测后应用人工周期内膜准备方案的解冻移植周期103例。纳入标准:PGT后解冻移植采用两种人工周期方案进行内膜准备;夫妇需有合理、充分的PGT助孕临床指征,且进行了充分的遗传咨询;以上持续妊娠患者的产前诊断结果符合PGT胚胎遗传学诊断结果。排除标准:合并有子宫内膜异位症(Ⅲ-Ⅳ期)、PCOS、中重度输卵管积水、子宫肌瘤(粘膜下)、严重的子宫畸形、宫腔粘连病史。
二、研究方法
1.胚胎培养及胚胎活检:PGT周期常规采用卵胞浆内单精子显微注射(ICSI)受精,受精后16~18 h观察原核,37℃三气培养箱(5% CO2、5% O2和90% N2)中G系列序贯培养培养至囊胚活检,每枚囊胚活检3~7个细胞,进行MALBAC全基因组扩增,二代测序技术检测[10]。优质囊胚为囊胚扩张程度≥3期且≥BB级[11],将移植囊胚分为优质囊胚和非优质囊胚。囊胚活检后单管玻璃化冷冻,待胚胎遗传学分析完成后择期对可移植胚胎进行复苏移植,复苏采用梯度置换后37℃、5% CO2培养箱培养2 h。
2.内膜准备方法:将研究对象根据在内膜准备过程中是否注射GnRH-a进行预处理分为两组,GnRH-a降调节联合激素替代组(研究组)为53例,单纯激素替代组(对照组)为50例。(1)研究组处理方法:月经2~3 d时,彩超检查子宫附件无异常,给予肌肉注射GnRH-a(贝依,上海丽珠)3.75 mg,28 d后复诊进行激素替代。患者每日口服戊酸雌二醇(补佳乐,拜耳药业,德国)6~8 mg,6~8 d后超声检测子宫内膜厚度,适时调整用药剂量;药物应用14~16 d后行超声检查并对雌二醇(E2)及孕酮(P)水平进行检测;超声显示子宫内膜厚度≥0.8 cm[12],则开始进行内膜转化,即每日口服地屈孕酮(达芙通,雅培,荷兰)20 mg及肌肉注射黄体酮(浙江仙琚)60 mg;囊胚解冻移植在转化6 d后进行,移植后继续以上用药。(2)对照组处理方法:月经2~5 d时,彩超检查子宫附件无异常,开始激素替代,其内膜准备、内膜转化及黄体支持药物的用法用量同降调节联合激素替代组。临床妊娠者于孕8周起逐步减药,孕12周时停药物支持,孕16~20周的持续妊娠者需在本院产前诊断中心行产前诊断。
3.妊娠判断标准:我中心PGT解冻移植采用单囊胚移植,均为整倍体胚胎。移植后28~35 d彩超提示宫内探及孕囊回声定义为临床妊娠。持续妊娠为孕16周及以上者通过超声监测提示宫内活胎[13]。
4.观察指标:患者基础临床资料,包括女方年龄、体质量指数(BMI)、基础卵泡刺激素(bFSH)、窦卵泡数(AFC)、转化日内膜厚度、转化日E2及P水平等;临床结局包括临床妊娠率、持续妊娠率、优质囊胚移植率、优质囊胚妊娠率和非优质囊胚妊娠率。临床妊娠率=临床妊娠周期数/移植周期数×100%,持续妊娠率=持续妊娠周期数(包括已活产者)/移植周期数×100%,优质囊胚移植率=优质囊胚移植周期数/移植周期数×100%,优质囊胚妊娠率=优质囊胚移植妊娠周期数/优质囊胚移植周期数×100%,非优质囊胚妊娠率=非优质囊胚移植妊娠周期数/非优质囊胚移植周期数×100%。
三、统计学分析

结 果
一、一般情况比较
本研究共纳入PGT后应用人工周期准备内膜的103例患者、103个FET周期,其中GnRH-a降调节联合激素替代组(研究组)53例,单纯激素替代组(对照组)50例。两组患者的女方年龄、BMI、基础FSH、AFC、转化日内膜厚度、转化日E2水平及P水平比较均无统计学差异(P>0.05)(表1)。
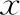
表1 两组患者一般情况比较(-±s)
二、两组患者妊娠结局比较
两组患者共获得临床妊娠65例,早期流产2例,目前共获得43例健康新生儿,均无明显出生缺陷发生,尚有20例妊娠中。研究组的临床妊娠率和持续妊娠率均显著高于对照组(P<0.05);两组患者优质囊胚移植率比较无显著性差异(P>0.05);研究组的优质囊胚妊娠率显著高于对照组(P<0.05),研究组的非优质囊胚妊娠率虽高于对照组,但差异无统计学意义(P>0.05)(表2)。

表2 两组患者妊娠结局比较(%)
三、Logistic回归分析临床妊娠率的影响因素
校正了两组患者一般临床资料及是否优胚移植的混杂因素后,研究组相对于对照组的临床妊娠率校正OR值为 3.788,95%CI(1.522,9.431),最终模型的 Hosmer-Lemeshow检验结果表明模型拟合较好,表明GnRH-a降调节联合激素替代内膜准备方案较单纯激素替代方案可以提高PGT后整倍体单囊胚解冻移植的临床妊娠率(表3)。

表3 二元Logistic回归分析临床妊娠率的影响因素
校正了两组患者一般临床资料及是否优胚移植的混杂因素后,研究组相对于对照组的持续妊娠率校正OR值为2.974,95%CI(1.232,7.180)。最终模型的Hosmer-Lemeshow 检验结果表明模型拟合较好,表明GnRH-a降调节联合激素替代内膜准备方案较单纯激素替代方案可以提高PGT后整倍体单囊胚解冻移植的持续妊娠率(表4)。

表4 Logistic回归分析持续妊娠率的影响因素
讨 论
由于获得胚胎遗传学检测结果需要一定时间,PGT助孕患者胚胎需全胚冷冻,故解冻移植成为PGT助孕的关键步骤。随着PGT技术的发展应用,经PGT技术筛选的整倍体胚胎可排除胚胎异常因素对妊娠结局造成的影响,在这一前提下,本研究中PGT后解冻移植前两种内膜准备方法比较得出的结果更准确。同时研究结果也可对经过层层筛选,获得珍贵胚胎的PGT助孕人群选择解冻移植内膜准备方案起到一定的指导作用。
本研究回顾了本院生殖中心近2年PGT应用人工周期内膜准备的103例解冻移植周期,研究对象为无子宫内膜异位症(Ⅲ-Ⅳ期)、PCOS、中重度输卵管积水、粘膜下子宫肌瘤等合并症的人群,将研究对象内膜准备根据是否进行GnRH-a预处理分为GnRH-a降调节联合激素替代方案组和单纯激素替代方案组;将两组患者的一般情况及妊娠结局进行了组间比较,结果表明GnRH-a降调节联合激素替代组临床妊娠率及持续妊娠率均显著高于单纯激素替代组,且在两组优质囊胚移植率无显著差异情况下,GnRH-a降调节联合激素替代组不论优质还是非优质囊胚其临床妊娠率均高于单纯激素替代组,且前者有统计学意义;二元Logistic回归分析结果显示,在校正了女方年龄、BMI等一般情况及是否优胚移植的差异因素后,GnRH-a降调节联合激素替代组相比于单纯激素替代组的临床妊娠率校正OR值为3.788,95%CI(1.522,9.431),持续妊娠率校正OR值为2.974,95%CI(1.232,7.180)。表明在整倍体囊胚移植时,排除其他因素后,GnRH-a降调节联合激素替代较单纯替代周期进行内膜准备可获得更高的临床妊娠率及持续妊娠率。相似的,国外一项研究表明,与单纯激素替代周期(n=100)相比,GnRH-a降调节联合激素替代周期(n=110)具有更高的种植率和妊娠率[7]。Kang等[8]在排除了PCOS和子宫内膜异位症(Ⅳ期)的人群中对单纯激素替代周期FET(n=88)与GnRH-a降调节联合激素替代周期FET(n=181)的临床结局进行比较,结果表明,妊娠率在GnRH-a降调节联合激素替代周期中较高,但活产率无显著差异。国内一项对非子宫内膜异位症人群中解冻移植研究中,对GnRH-a降调节后激素替代内膜准备组(试验组)807个周期及单纯激素替代内膜准备组(对照组)2 755个周期进行妊娠结局比较,揭示在校正了混杂因素的多因素后也验证了前者较后者能获得更高的临床妊娠率与活产率[9],但以上研究均未排除胚胎异常因素对妊娠结局的影响。
GnRH-a降调节联合激素替代方案较单纯激素替代方案能够获得更高的临床妊娠率,考虑可能的相关因素如下:(1)单纯激素替代方案子宫内膜可在外源性雌激素的作用下有效生长,之后在外源性孕酮的作用下子宫内膜种植窗的开放得以启动,从而有效把握胚胎移植的时机,但外源的E2仍可直接或间接作用于下丘脑GnRH 神经元,增加 GnRH 释放脉冲的幅度,促使 GnRH 受体增多和垂体对其敏感性增强,可能会引起早发性的LH峰,从而影响子宫内膜的微环境,干扰胚胎着床[14]。长效GnRH-a的作用原理是持续应用后垂体的GnRH受体被耗尽,降低了垂体分泌促性腺激素,从而导致卵巢无卵泡周期性发育,有效抑制内源性LH峰,弥补单纯激素替代方案无法保证完全垂体抑制的缺陷,同时GnRH-a可提高内膜对外源性E2敏感性,改善子宫内膜分型[15]。(2)长效GnRH-a的应用可以减少内源性雌激素的释放,血清雌激素水平的降低可能会改变后期子宫内膜上种植窗的形成,亦有利于胚胎早期种植[16-17];同时GnRH-a抑制HPO轴,降低卵泡期孕酮水平,防止种植窗提前开放,提高子宫内膜容受性,从而改善妊娠结局[18]。(3)研究发现,GnRH 受体不仅存在于垂体,同时也存在于子宫内膜组织[19]。有动物实验表明,围种植期间的胚胎发育与GnRH-a 的增加呈正相关性,围种植期的胚胎表面存在GnRH-a受体,提示GnRH-a的长时间作用对子宫内膜容受性和胚胎发育都有获益[20]。研究推测,GnRH-a预处理后GnRHa 可能通过结合于胚胎及子宫内膜上的GnRH受体,抑制胚胎毒性自身抗体的产生、增加子宫内膜细胞黏附分子整合素avβ3的表达,从而改善内膜容受性[21]。这与国内的一项研究结论一致,后者还提出长效GnRH-a还可以提高种植窗期子宫内膜表面的白血病抑制因子、血管内皮生长因子、胞饮突的表达,降低腹腔中白细胞介素-1、肿瘤坏死因子等胚胎毒性因子的浓度,明显改善盆腔及子宫内膜局部微环境,利于胚胎着床,提高临床妊娠率[22]。
综上所述,在应用GnRH-a进行降调节后,子宫内膜的容受性可能通过以上途径得到改善,从而更有利于胚胎着床。且目前从本研究统计差异结果来看,经PGT筛选的整倍体单囊胚进行解冻移植时,GnRH-a降调节联合激素替代内膜准备方案可能优于单纯激素替代方案。但近两年受新冠肺炎疫情影响,我中心经PGT检测后冻融胚胎移植周期尚少,故需继续累积周期数,同时需大样本量进行前瞻性的研究,并对以上标记物进行检测,以期得出更为有意义、更具统计说服力的结果来更好的指导临床。

