miR-124-3p对口腔鳞状细胞癌细胞增殖和侵袭的抑制作用及其机制
吴壮志,贺小宁,陈思祺
(海南医学院第二附属医院口腔科,海南 海口 570100)
口腔鳞状细胞癌 (oral squamous cell carcinoma,OSCC)是最常见的口腔恶性肿瘤,近年来发病率呈上升趋势[1]。微小RNA(microRNA,miRNA)是一种小的非编码RNA,在转录后水平调控靶基因的表达[2]。研究[3-5]显示:miRNA表达失调与OSCC细胞生物学行为及其恶性进展有关。微小RNA-124-3p(microRNA-124-3p,miR-124-3p)在乳腺癌和膀胱癌组织中低表达,过表达miR-124-3p能抑制癌细胞增殖和侵袭[6-7]。而miR-124-3p在OSCC中的作用尚未见报道。脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)在宫颈癌和OSCC等多种肿瘤组织中高表达[8-9]。靶基因预测结果显示:BDNF与miR-124-3p存在结合位点,但miR-124-3p是否靶向BDNF调控OSCC进展尚未清楚。本研究探讨miR-124-3p对OSCC HSC2和KON细胞增殖和侵袭的影响及其与BDNF之间的靶向关系。
1 材料与方法
1.1 标本来源收集2017年3月—2018年6月本科进行手术切除的OSCC患者的癌组织标本39例和正常口腔黏膜组织标本39例,置于-80℃保存。本研究经本医院医学伦理委员会批准(批准号为LW2020015),所有患者及其家属均签署知情同意书。
1.2 动物、主要试剂和仪器SPF级BALB/c雄性裸鼠10只,体质量18~20 g,购自湖南省斯莱克实验生物有限公司,动物生产许可证号:SCXK(湘)2019-0004。按照实验动物管理和伦理委员会制度对裸鼠进行饲养和相关实验。OSCC、HSC2和KON细胞及人永生化口腔上皮细胞HIOEC细胞(美国Scien Cell公司),引物(上海生工公司),Defined Keratinocyte培养基、DMEM培养基、胎牛血清、CCK-8试剂盒和胰蛋白酶(美国Gibco公司),Western blotting检测相关试剂(广州碧云天公司),BDNF单克隆抗体及IgG二抗(美国CST公司),双荧光素酶报告基因检测试剂盒(美国Promega公司),Transwell小室(美国Coming公司),miR-124-5p inhibitor、inhibitor-NC和siBDNF均由上海吉玛公司合成。ABI 7500实时荧光定量PCR仪(美国Bio-Rad公司),酶标仪(美国Bio-Tek公司)。
1.3 细胞培养采用含10%胎牛血清的DMEM培养液培养口腔上皮HIOEC细胞,含15%胎牛血清的DMEM培养液培养OSCCHSC2细胞,口腔底部癌KON细胞,置于37℃、5%CO2培养箱中培养。
1.4 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)法检测组织和细胞中miR-124-3p和BDNF mRNA表达水平TRIzol法提取OSCC和正常口腔组织样本或对数生长期的细胞样本总RNA,合成模板链cDNA。RT-qPCR的反应条件:95℃预变性30 min,95℃变性12 s,60℃退火、延伸12 s,共40个循环。反应结束后分析Ct值,采用2-△△Ct法计算细胞中miR-124-3p和BDNF mRNA表达水平,并采用生存分析曲线分析miR-124-3p表达与患者生存率的关系。
1.5 裸鼠成瘤实验检测各组裸鼠体内肿瘤的质量将裸鼠分为miR-NC组和miR-124-3p组,每组5只。取0.2 mL密度为1×106mL-1的癌细胞,裸鼠右前肢接种肿瘤,SPF环境下继续饲养。接种后每隔10 d,固定时间测量肿瘤的最长直径a(mm)和最短直径b(mm),计算肿瘤体积(mm3),肿瘤体积V=a×b2×0.52,同时绘制移植瘤的生长曲线图。约第60天,裸鼠皮下形成较大肿瘤,断颈法处死裸鼠,取出皮下肿瘤组织,称瘤体质量。
1.6 Western blotting法检测细胞中BDNF蛋白表达水平RIPA蛋白裂解液细胞提取总蛋白,采用BCA法测定样品蛋白的浓度。取60μg变性处理的目的蛋白和蛋白Marker进行SDS-PAGE蛋白电泳。然后转至PVDF膜,随后封闭1 h,4℃条件下,将封闭后的PVDF膜置入1∶1 000倍稀释的一抗中反应过夜,37℃下将PVDF膜转入1∶2 000倍稀释的二抗中反应2 h。显色并采集图像,以β-actin为内参,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 细胞转染和分组收集对数生长期的HIOEC、HSC2和KON细胞,以105个/孔的密度接种于6孔板,细胞融合度约为60%时,根据预实验结果,按照慢病毒转染说明书步骤操作,将miR-124-3p、miR-NC、inhibitor-NC、miR-124-3p inhibitor、siBDNF、BDNF和miR-124-3p+BDNF分别转染至HSC2及KON细胞,作为miR-124-3p组、miR-NC组、inhibitor-NC组、miR-124-3p inhibitor组、siBDNF组、BDNF组及miR-124-3p+BDNF组。制备稳定转染miR-124-3p和BDNF的细胞株,收集各组细胞。
1.8 CCK-8法检测各组细胞存活率按上述方法转染细胞,取对数生长期的各组HSC2和KON细胞,以100μL/孔的密度接种至96孔板,每组设6个重复,分别转染48、72和96 h时加入CCK-8溶液20μL,采用酶标仪于450 nm波长处检测吸光度(A)值,以A值代表细胞存活率。
1.9 Transwell实验检测各组细胞侵袭率先将稳定转染的各组细胞以106个/孔的密度接种于细胞6孔板,细胞融合度达到70%,无血清培养基调整细胞密度为105mL-1,取100μL加入上室中,取600μL含血清培养基加入下室中,细胞常规培养过夜。取出小室,擦去上室内细胞,甲醇固定30 min,0.1%结晶紫染色20 min,显微镜下观察小室下表面附着的侵袭细胞数,随机取5个视野拍照计数,取平均数即为侵袭细胞数,计算细胞侵袭率。细胞侵袭率=侵袭细胞数/总细胞数×100%。
1.10 双荧光素酶报告基因检测实验检测miR-124-3p与BDNF的靶向关系采用在线软件Target Scan(http://www.targetscan.org/)预测miR-124-3p与BDNF3′UTR存在的结合位点,采用LipofectamineTM2000 将 BDNF 3′UTR-WT 和BDNF 3′UTR-MUT荧光素酶报告载体分别与miR-124-3p、miR-NC、inhibitor-NC和miR-124-3p inhibitor共转染HSC2和KON细胞,24 h后收获细胞,按照双荧光素酶报告基因检测试剂盒技术手册操作,计算细胞荧光素酶活性。细胞荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.11 RNA免疫沉淀实验检测miR-124-3p与BDNF的靶向关系按照Magna RIP RNA-Binding Protein试剂盒说明书要求进行RIP实验。具体操作见使用说明书。
1.12 统计学分析采用SPSS 13.0统计软件进行统计学分析。miR-124-3p表达水平、细胞存活率、细胞侵袭率、细胞中miR-124-3p和BDNF mRNA表达水平及BDNF蛋白表达水平、肿瘤体积和质量均满足正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 OSCC组织和HSC2及KON细胞中miR-124-3p表达水平以及患者生存率OSCC组织中miR-124-3p表达水平低于正常口腔黏膜组织(P<0.05),HSC2和KON细胞中miR-124-3p表达水平明显低于HIOEC细胞(P<0.05)。低表达miR-124-3p患者生存率明显低于高表达miR-124-3p患者(P<0.05)。见图1。

图1 各种组织和细胞中miR-124-3p表达水平及2组患者生存率Fig.1 Expression levels of miR-124-3p in different kinds of tissues and cells and survival rate of patients in two groups
2.2 2组细胞中miR-124-3p表达水平、HSC2和KON细胞存活率及细胞侵袭率miR-124-3p组HSC2和KON细胞中miR-124-3p表达水平高于miR-NC组(P<0.05),见图2。48、72和96 h时,miR-124-3p组HSC2及KON细胞存活率均明显低于miR-NC组(P<0.05),见图3和4。miR-124-3p组HSC2和KON细胞的细胞侵袭率较miR-NC组均明显降低(P<0.05)。见图5和6。

图2 miR-124-3p组和miR-NC组细胞中miR-124-3p的表达水平Fig.2 Expression levels of MiR-124-3p in cells in miR-124-3p group and miR-NC group

图3 miR-124-3p组和miR-NC组HSC2细胞存活率Fig.3 Survival rates of HSC2 cells in miR-124-3p group and miR-NC group

图5 2组HSC2和KON细胞侵袭形态(结晶紫,×200)Fig.5 Invasion morphology of HSC2 and KON cells in two groups(Crystal violet,×200)
2.3 各组裸鼠肿瘤质量、体积和肿瘤组织中BDNF蛋白表达水平裸鼠成瘤实验中接种部位10 d后均长出肿瘤,成瘤率为100%,miR-124-3p组裸鼠肿瘤质量(0.43 g±0.05 g)较miR-NC组(0.74 g±0.06 g)明显降低,且肿瘤体积在第40、50和60天时较miR-NC组明显缩小(P<0.05)。miR-124-3p组裸鼠肿瘤组织中BDNF蛋白表达水平(1.00±0.07)明显低于miR-NC组(0.46±0.06)(P<0.05)。见图7和8。

图4 miR-124-3p组和miR-NC组KON细胞存活率Fig.4 Survival rates of KON cells in miR-124-3p group and miR-NC group

图6 2组HSC2和KON细胞的细胞侵袭率Fig.6 Invasion rates of HSC2 and KON cells in two groups

图7 2组裸鼠移植瘤形态表现Fig.7 Morphology of transplanted tumor of nude mice in two groups

图8 不同时间2组裸鼠移植瘤体积Fig.8 Volumes of transplanted tumor of nude mice in two groups at different time points
2.4 miR-124-3p与BDNF的靶向关系及HSC2和KON细胞中荧光素酶活性miRcode数据库预测发现:miR-124-3p与BDNF 3′UTR存在结合位点,见图9。过表达miR-124-3p后转染BDNF 3′UTRWT的HSC2和KON细胞中双荧光素酶活性均明显低于转染BDNF 3′UTR-WT的HSC2和KON细胞,抑制miR-124-3p后转染BDNF 3′UTR-MUT的HSC2和KON细胞中双荧光素酶活性均明显高于转染BDNF 3′UTR-MUT的HSC2和KON细胞,见图10;HSC2和KON细胞中miR-124-3p组BDNF的富集率均明显高于miR-NC组(P<0.05),见图11。Spearman相关分析发现:BDNF表达水平与miR-124-3p表达水平呈负相关关系(r2=-0.561,P<0.01)。见图12。

图9 互补序列Fig.9 Complementary sequences

图10 各组HSC2和KON细胞中荧光素酶活性Fig.10 Luciferase activities in HSC2 and KON cells in various groups

图11 RNA免疫沉淀检测结果Fig.11 RNA immunoprecipitiotation detection results
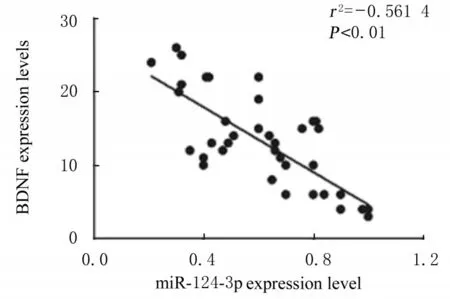
图12 OSCC组织中miR-124-3p与BDNF表达水平相关性Fig.12 Correlation between expression levels of miR-124-3p and BDNF in OSCC tissue
2.5 各组HSC2和KON细胞中BDNF mRNA和蛋白表达水平、细胞存活率及细胞侵袭率OSCC组织中BDNF mRNA表达水平(2.01±0.08)高于正常口腔组织(1.00±0.04)(P<0.05)。siBDNF组HSC2和KON细胞中BDNF mRNA表达水平均明显 低 于inhibitor-NC组(P<0.05),BDNF组HSC2和KON细胞中BDNF mRNA表达水平均明显 高 于inhibitor-NC组(P<0.05);BDNF组HSC2和KON细胞中BDNF蛋白表达水平明显高于inhibitor-NC组(P<0.05),siBDNF组HSC2和KON细胞中BDNF蛋白表达水平明显低于inhibitor-NC组(P<0.05)。作用48、72和96 h时,siBDNF组细胞存活率均明显低于inhibitor-NC组(P<0.05),BDNF组细胞存活率均明显高于inhibitor-NC组(P<0.05)。BDNF组细胞侵袭率明显高于inhibitor-NC组(P<0.05),siBDNF组细胞侵袭率明显低于inhibitor-NC组(P<0.05)。见图13~16。

图13 各组HSC2和KON细胞中BDNF mRNA表达水平Fig.13 Expression levels of BDNF mRNA in HSC2 and KON cells in various groups
2.6 miR-124-3p作用后各组HSC2和KON细胞中BDNF蛋白表达水平、细胞存活率及细胞侵袭率miR-124-3p组HSC2和KON细胞中BDNF蛋白表达水平明显低于miR-NC组(P<0.05),miR-124-3p+BDNF组HSC2和KON细胞中BDNF蛋白表达水平明显高于miR-124-3p组(P<0.05)。作用48、72和96 h时,miR-124-3p+BDNF组HSC2和KON细胞存活率均明显高于miR-124-3p组(P<0.05)。miR-124-3p+BDNF组细胞侵袭率明显高于miR-124-3p组(P<0.05)。见图17~19。

图17 miR-124-3p作用后各组HSC2和KON细胞中BDNF蛋白表达电泳图(A)和直条图(B)Fig.17 Electrophoregram(A)and histogram(B)of expressions of BDNF protein in HSC2 and KON cells in various groups after treated with miR-124-3p
3 讨 论
鳞状细胞癌是指癌细胞以鳞状细胞为主,根据显微镜下的表现结果诊断为鳞状细胞癌,鳞状细胞癌多见于头颈部肿瘤和肺部肿瘤。OSCC是指发生于口腔内,以鳞状细胞为主的恶性肿瘤,癌细胞可以发生于牙龈、硬腭、舌体、颊黏膜和嘴唇等多种器官,属于头颈部恶性程度最高、危害性最大的肿瘤,约占头颈部鳞状细胞癌的50%。根据组织来源的不同可以分为颊癌和舌癌等,其中舌癌在临床上最为常见,约占50%,其活动度比较好,血运丰富,淋巴转运率也比较高,预后效果较差。OSCC容易出现远处转移,如肺转移、骨转移、淋巴道转移和血运转移等;另外其可以造成口腔功能的损失,如长在舌头会影响语言和吞咽功能,当进一步发展,还可引起远处转移,导致局部溃烂,影响患者的生活质量,危害患者的生命。局部活检和术后病理诊断可以确诊OSCC,同时根据肿瘤的分化程度和病理类型,可以选择合适的治疗方式来控制肿瘤,明确病理类型。

图14 各组HSC2和KON细胞中BDNF蛋白表达电泳图(A)和直条图(B)Fig.14 Electrophoregram(A)and histogram(B)of expressions of BDNF protein in HSC2 and KON cells in various groups

图15 不同时间点各组HSC2(A)和KON(B)细胞存活率Fig.15 Survival rates of HSC2(A)and KON(B)cells in various groups at different time points
图16 各组HSC2和KON细胞的侵袭细胞率Fig.16 Invasion rates of HSC2 and KON cells in various groups
OSCC是世界公认的卫生难题,在世界范围内其 发 病 率 逐 年 升 高[9]。近 几 年 研 究[10]显 示:miRNA在肿瘤的形成、生长和转移中均发挥重要作用,还可作为肿瘤的标志物。研究[11]显示:miR-124-3p低表达参与诱导胃癌细胞的侵袭和上皮间质转化,促进胃癌发生。沉默circ_0026123通过上调miR-124-3p表达来抑制卵巢癌进展[12]。miR-124-3p可通过靶向STAT 3抑制鼻咽癌细胞的增殖和侵袭[13]。此外,miR-124-3p表达上调对星形胶质瘤的增殖侵袭和有氧酵解均有抑制作用[14]。本研究结果显示:miR-124-3p在OSCC组织和细胞中呈低表达,提示miR-124-3p参与调控OSCC细胞恶性行为,过表达miR-124-3p可以抑制HSC2和KON细胞增殖及侵袭能力,既往研究[15-16]显示miR-124-3p在胃癌和肝癌中的抑癌作用相似,此外,过表达miR-124-3p对裸鼠体内肿瘤生长具有抑制作用。本课题组进一步研究过表达miR-124-3p对细胞和裸鼠成瘤的影响发现:过表达miR-124-3p可以抑制HSC2和KON细胞的增殖及侵袭,抑制裸鼠体内肿瘤的生长。

图18 miR-124-3p作用后不同时间点各组HSC2(A)和KON(B)细胞存活率Fig.18 Survival rates of HSC2(A)and KON(B)cells in various groups at different time points

图19 miR-124-3p作用后各组HSC2和KON细胞的细胞侵袭率Fig.19 Invasion rates of HSC2 and KON cells in various groups after treated with miR-124-3p
BDNF首次是从猪脑中分离纯化出的具有促进神经生长活性的一种蛋白,可起到调节痛苦和恐惧感觉的作用[17]。BDNF能促进运动神经元和多巴胺能神经元等神经元的存活,刺激神经细胞突起的生长和长芽,诱导合成神经元表型的蛋白质,增加神经递质的合成,改变细胞膜上离子通道活性。有研究[18-20]显示:BDNF在胰腺导管癌和膀胱癌组织中表达增加。BDNF表达上调促进宫颈癌细胞增殖[8],并诱导卵巢癌 细胞迁移及侵袭[21]。miR-15a-5p通过靶向BDNF抑制人肝癌细胞[22]。本研究结果显示:过表达miR-124-3p后移植瘤组织中BDNF表达水平低于过表达miR-124-3p前,抑制BDNF表达导致HSC2和KON细胞的增殖侵袭能力降低,这与过表达miR-124-3p的抗癌作用吻合,而上调BDNF则促进HSC2和KON细胞增殖进而提高细胞侵袭力。双荧光素酶结合实验和RIP实验证实:BDNF是miR-124-3p的靶基因,同时BDNF可逆转miR-124-3p抑制HSC2和KON细胞的增殖及侵袭的作用,表明miR-124-3p可通过调控BDNF在OSCC组织中发挥抑癌作用,为miR-124-3p作为OSCC治疗靶点提供理论依据和实验基础。综上所述,miR-124-3p能够抑制促癌因子BDNF表达,抑制OSCC细胞增殖、侵袭和肿瘤生长。本研究结果不仅阐明了miR-124-3p对OSCC的功能及其作用机制,也为OSCC的治疗提供了新的靶点。

