贝母素乙对肺癌A549细胞凋亡的诱导作用及其机制
杨明星,董 文,李 冀
(海南省肿瘤医院呼吸内科,海南 海口 570312)
肺癌是世界上最常见的癌症类型,其发病率在全球范围内不断升高,且预后较差[1]。抗凋亡是肿瘤细胞的重要特征,也是导致抗肿瘤治疗失败的主要原因之一[2]。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)是MAPK超家族中的重要成员,属于应激激活蛋白激酶,可参与细胞增殖、凋亡和分化等过程的调控。有研究[3-4]显示:激活p38 MAPK通路可抑制肺癌细胞增殖并诱导其凋亡,而抑制p38 MAPK通路活化可促进非小细胞肺癌细胞的干性维持,表明p38 MAPK可能是治疗肺癌的关键靶点。贝母素乙(peiminine,PMI)是由贝母鳞茎中提取的一种天然化合物,不仅具有清热散结和化痰止咳的功效,还具有抗肿瘤作用。研究[5-6]显示:PMI不仅具有抑制肿瘤细胞增殖和诱导其凋亡的作用,还具有化疗增敏作用。PMI在肺癌中的抗肿瘤作用及其相关分子机制尚不清楚。本研究采用不同浓度PMI联合p38 MAPK抑制剂SB203580处理肺癌A 549细胞,探讨PMI对A 549细胞凋亡的影响,并阐述其可能的分子机制,为治疗肺癌提供可靠的新药靶点。
1 材料与方法
1.1 细胞、主要试剂和仪器人肺癌A 549细胞购自中国科学院上海细胞库。PMI(纯度≥98%,批号:SPB150)购自上海恒斐生物科技有限公司。p38 MAPK抑制剂 SB203580购自美国MedChemExpress公司,胎牛血清和PRMI1640购自美国Hyclone公司,MTT试剂盒购自上海碧云天生物技术有限公司,AnnexinⅤ-FITC/PI试剂盒购自北京索莱宝科技有限公司,兔抗p53、B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和cleaved-caspase-3购自美国Cell Signaling Technology公司,p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)、磷酸 化p38 MAPK(phosphorylated p38 MAPK,p-p38 MAPK)(Thr180/Thr182)、小鼠双微体2(murine double minute 2,MDM 2)、p-p53(ser15)、p53上凋凋亡调节因子(p53 up-regulated modulator of apoptosis,PUMA)和β-actin抗体均购自英国Abcam公司。FC500流式细胞仪购自美国Beckman-Coulter公司,CX-21荧光显微镜购自日本Olympus公司,Tanon2500凝胶成像仪和蛋白电泳仪购自上海天能科技有限公司。
1.2 细胞培养将人肺癌A 549细胞接种至含10%胎牛血清的DMEM培养基中,置于5%CO2、37℃恒温培养箱中培养。严格观察细胞生长情况,当观察到细胞生长汇合度达80%时,加入胰蛋白酶消化,按1∶3进行细胞传代培养。
1.3 MTT实验检测各组A 549细胞存活率取对数生长期人肺癌A 549细胞,以每孔4×103个细胞的密度接种至96孔培养板中,待细胞完全贴壁后加入不同浓度(0.025、0.050、0.100、0.200和0.400 mmol·L-1)PMI分 别 处 理24、48和72 h。距离药物处理时间结束前4 h,每孔加入5 g·L-1MTT溶液10μL继续培养4 h,弃培养基后每孔加入150μL DMSO,避光低速振荡10 min,于酶标仪490 nm处检测各组细胞吸光度(A)值,计算细胞存活率。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%[7],并计算各组的半数抑制浓度(half inhibitory concentration,IC50)值。IC50=lg-1[Xm-i(ΣP-0.5)],Xm:设计的最大浓度的对数值;i:各浓度倍比浓度的对数值;ΣP:各组细胞生长抑制率之和。
1.4 实验分组取对数生长期A 549细胞,以0、0.050、0.100和 0.200 mmol·L-1PMI或0.200 mmol·L-1PMI联 合SB203580(20μmol·L-1)处理A 549细胞48 h,分为空白对照组、不同浓度(0.050、0.100和0.200 mmol·L-1)PMI组 和联 合 组(0.200 mmol·L-1PMI+20μmol·L-1SB203580)。根据细胞分组进行后续实验检测。
1.5 AnnexinⅤ-FITC/PI法检测各组细胞凋亡率细胞分组处理后培养48 h,加入0.25%胰蛋白酶消化并收集细胞,采用预冷的PBS洗涤后,加入Binding Buffer悬浮细胞,调整细胞密度至1×106mL-1。取100μL细胞悬浮液,加入5μL AnnexinⅤ-FITC,室温避光孵育10 min后,再加入5μL PI室温避光孵育5 min,采用PBS定量至500μL,采用流式细胞术检测各组A 549细胞凋亡率。
1.6 Western blotting法检测各组A549细胞中凋亡相关蛋白和p38 MAPK/p53信号通路相关蛋白表达水平分组处理后培养48 h,弃培养液,加入预冷的PBS洗涤3次,加入0.25%胰蛋白酶消化并收集细胞沉淀,加入含磷酸酶抑制剂的RIPA裂解液,4℃、12 000 r·min-1离心15 min,取上清,然后采用BCA法测定蛋白浓度。制备10%SDSPAGE胶,每孔30μg蛋白,95℃变性5 min后上样电泳。完成电泳后,将目的蛋白电转至PVDF膜上,加入含5%脱脂奶粉的封闭液,室温摇床封闭2 h。采用含0.05%吐温-20的Tris缓冲盐溶液(Tris buffered saline with Tween,TBST)洗涤3次,每次5 min。滴加相应一抗Bax(1∶1 000)、Bcl-2(1∶2 000)和cleaved-caspase-3(1∶500);p38MAPK(1∶1 000)、p-p38MAPK(Thr180/Thr182)(1∶1 000)、MDM 2(1∶1 000)、p53(1∶1 000)、p-p53(ser15)(1∶500)、PUMA(1∶1 000)和β-actin(1∶2 000),4℃孵育过夜。TBST洗涤3次,每次5 min,再加入辣根过氧化物酶标记的二抗稀释液,室温孵育1 h,TBST室温摇床脱色洗涤3次,每次5 min。ECL发光显影后,采用Image J扫描并分析目的蛋白灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.7 免疫荧光实验检测各组A549细胞中p53蛋白定位情况取对数期A 549细胞,接种至内含无菌载玻片的6孔板中,分组处理并继续培养48 h。弃培养基,加入4%多聚甲醛固定15 min,PBS洗涤3次,加入0.5%聚乙二醇辛基苯基醚室温通透细胞10 min,PBS洗涤3次,加入含5%脱脂奶粉的封闭液室温封闭1 h,滴加一抗p53(1∶100)4℃孵育过夜。PBS洗涤3次,再加入荧光标记的二抗,室温孵育1 h,PBS洗涤3次,避光滴加适量DAPI染液,PBS洗涤3次,最后采用抗荧光淬灭试剂封片,荧光显微镜下观察p53蛋白定位情况。
1.8 统计学分析采用SPSS 21.0统计软件对数据进行统计学分析。人肺癌A 549细胞存活率,细胞凋亡率,细胞中Bax、cleaved-caspase-3、Bcl-2、p-p38MAPK(Thr180/Thr182)、p-p53(ser15)、p53、PUMA和MDM 2蛋白表达水平均符合正态分布,以±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNKq检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组人肺癌A 549细胞存活率和IC 50值和细胞中凋亡相关蛋白表达水平与对照组比较,不同浓度PMI处理均能有效降低肺癌A 549细胞存活率,且与时间和浓度呈依赖性。不同浓度(0、0.025、0.050、0.100、0.200和0.400 mmol·L-1)PMI处理A 549细胞24、48和72 h,其IC50值分别为(0.53±0.028)、(0.29±0.025)和(0.12±0.011)mmol·L-1,后 续 选 择PMI的 处 理 浓 度 为0.05、0.10和0.20 mmol·L-1,处理时间为48 h。见图1。

图1 MTT法检测各组人肺癌A549细胞存活率Fig.1 Survival rates of human lung cancer A 549 cells in various groups detected by MTT assay
2.2 各组人肺癌A 549细胞中凋亡率和细胞凋亡相关蛋白表达水平与对照组比较,不同浓度(0.05、0.10和0.20 mmol·L-1)PMI处理48 h后,A 549细胞凋亡率呈浓度依赖性升高(P<0.05),且促凋亡蛋白Bax和cleaved-caspase-3蛋白表达水平明显升高,而抗凋亡蛋白Bcl-2蛋白表达水平明显降低(P<0.05)。与0.20 mmol·L-1PMI组比较,联合组A 549细胞凋亡率明显降低(P<0.05),细胞中促凋亡蛋白Bax和cleaved-caspase-3蛋白表达水平明显降低(P<0.05),而抗凋亡蛋白Bcl-2蛋白表达水平明显升高(P<0.05)。见图2~4。

图2 流式细胞术检测各组人肺癌A549细胞凋亡率Fig.2 Apoptotic rates of human lung cancer A 549 cells in various groups detected by flow cytometry
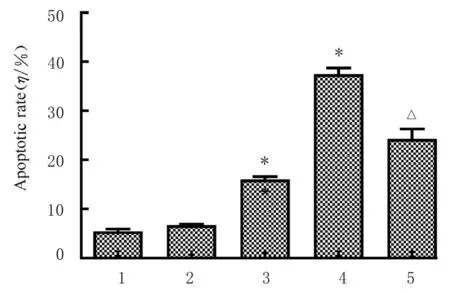
图3 各组人肺癌A549细胞凋亡率Fig.3 Apoptotic rates of human lung cancer A 549 cells in various groups
2.3 各组人肺癌A 549细胞中p38 MAPK/p53信号通路相关蛋白表达水平与对照组比较,处理48 h后,不 同 浓 度(0.05、0.10和0.20 mmol·L-1)PMI组A 549细胞中p-p38MAPK、p-p53(ser15)、p53和PUMA蛋白表达水平升高(P<0.05),而MDM 2蛋白表达水平降低(P<0.05)。与0.20 mmol·L-1PMI组比较,联合组A 549细胞中p-p38MAPK、p-p53(ser15)、p53和PUMA蛋白表达水平明显降低(P<0.05),而MDM 2蛋白表达水平明显升高(P<0.05)。见图5。

图5 Western blotting法检测人肺癌A 549细胞p38 MAPK/p53信号通路相关蛋白的表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A)and histogram(B)of expressions of p38 MAPK/p53 signaling pathway related proteins in human lung cancer A 549 cells detected by Western blotting method
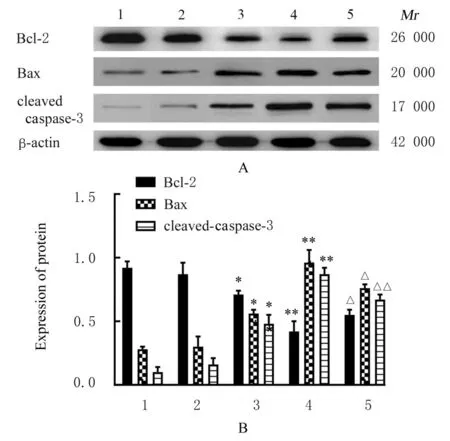
图4 各组人肺癌A549细胞中凋亡相关蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram (A) and histogram(B) of expressions of apoptosis-related proteins in human lung cancer A 549 cells in various groups detected by Western blotting method
2.4 各组人肺癌A 549细胞中p53蛋白核转位情况免疫荧光检测结果显示:各组A 549细胞均表达p53蛋白,其中对照组和0.05 mmol·L-1PMI组A 549细胞中p53蛋白绿色荧光较弱,其他3组A 549细胞中p53蛋白绿色荧光较强;与对照组比较,处理48 h后,不同浓度(0.05、0.10和0.20 mmol·L-1)PMI组A 549细胞中p53蛋白表达水平有升高趋势,且有p53蛋白由细胞质向细胞核转移的现象。与0.20 mmol·L-1PMI组比较,联合组A 549细胞中p53蛋白在细胞质和细胞核均有表达。见图6。
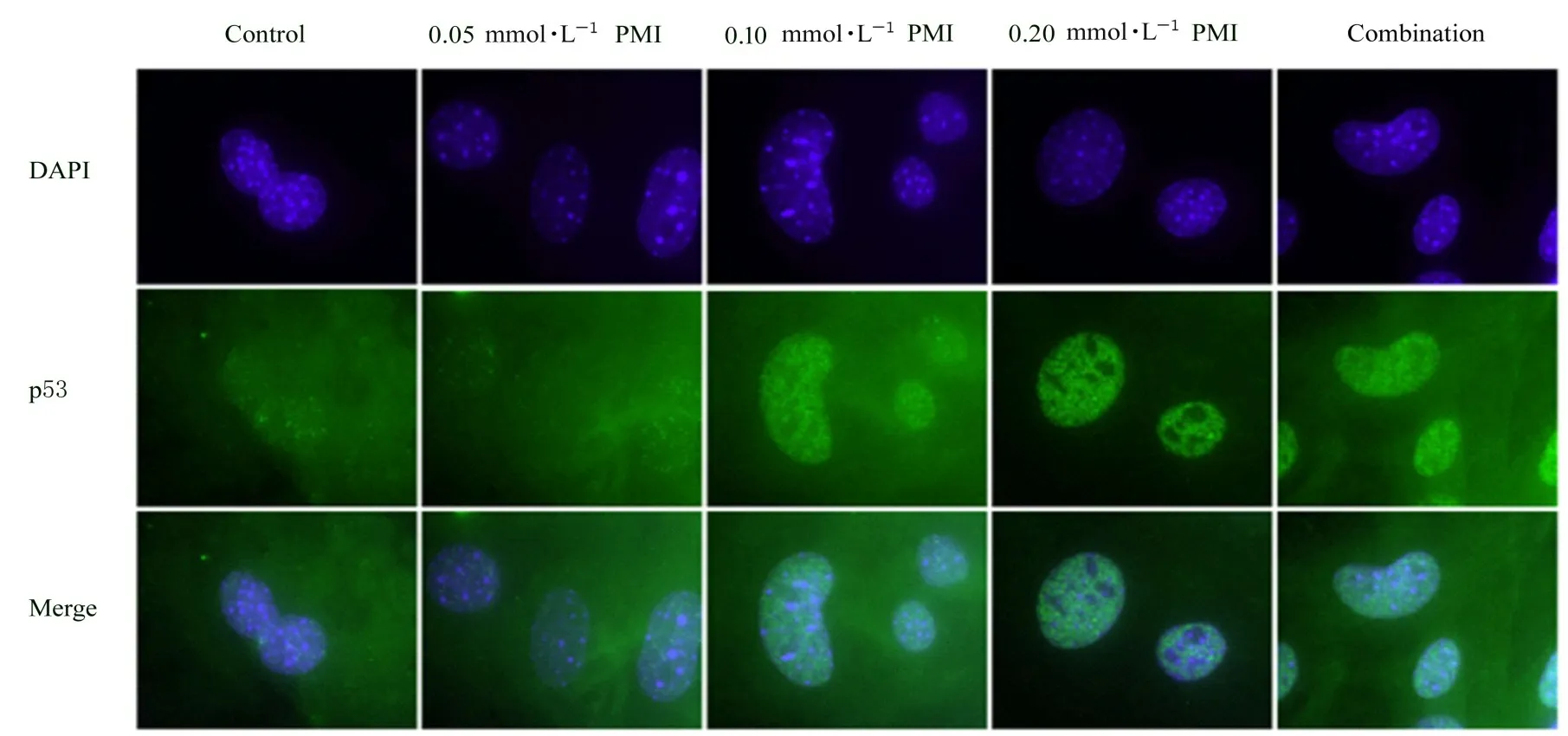
图6 各组A549细胞中p53蛋白定位情况(免疫荧光,×400)Fig.6 Localization of p53 protein in A 549 cells in various groups(Immunofluorescence,×400)
3 讨 论
PMI是从中药贝母中提取的生物碱,具有镇咳祛痰和镇痛抗炎等多种药理作用[8]。研究[9-10]显示:PMI对肿瘤细胞的生长具有抑制作用,还可通过抑制MEK/ERK的磷酸化水平,抑制柯萨奇B病毒性心肌炎小鼠心肌细胞的凋亡和缓解细胞炎症水平。PMI通过调控EGFR/FAK通路活性,抑制阿霉素处理的胃癌细胞增殖,诱导细胞凋亡,提高其对化疗药物的敏感性[11]。PMI通过LINC00659/miR-760轴抑制结直肠癌细胞的存活、集落形成和转移,从而抑制结直肠癌的发生[12]。上述研究结果均提示:PMI对肿瘤细胞的增殖具有一定的抑制作用,能促进肿瘤细胞凋亡,进而影响肿瘤的发生发展。本研究结果显示:PMI可以明显抑制人肺癌A 549细胞增殖活性,且呈浓度依赖性。根据各组细胞的IC50值,选择0.05、0.10和0.20 mmol·L-1和48 h作为PMI处理浓度和时间。
细胞凋亡是细胞程序性死亡的一种基本机制,可被多种细胞外和细胞内损伤激活。诱导细胞凋亡是抗肿瘤药物的重要标志之一,抗癌药物通常经诱导细胞凋亡来抑制肿瘤发展[13-15]。研究[16]显示:白藜芦醇通过阻滞细胞周期、调控相关基因和蛋白的表达及线粒体细胞凋亡途径,影响肿瘤细胞的凋亡水平,是临床抗肿瘤的潜在应用药物。迷迭香酸衍生物RAD-9通过调控p38 MAPK信号通路活性诱导胃癌细胞凋亡[17]。大黄活性成分Danthron可通过抑制自噬增强阿霉素对胰腺癌细胞的毒性,提高药物敏感性[18]。上述研究结果说明:抗肿瘤药物通过调控多种信号途径,影响肿瘤细胞的凋亡水平,进而达到抗肿瘤的效果。本研究结果显示:PMI通过上调促凋亡蛋白表达和抑制抗凋亡蛋白表达水平,促进人肺癌A 549细胞的凋亡;说明PMI可能是治疗肺癌的有效抗癌药物,但PMI促进肺癌A 549细胞凋亡的相关分子机制尚不明确。MAPK是细胞信号传递者,将信号由细胞表面传递至细胞核内,具有三级激酶模式,调节细胞生长、分化、应激和炎症反应等一系列生理病理过程。p38作为MAPK的4大亚族之一,参与调节多种 肿 瘤 细 胞 凋 亡 过 程[19-20]。研 究[21]显 示:RND2作为p38 MAPK磷酸化复合物的内源性阻遏物,抑制p38 MAPK信号通路活性,进而抑制胶质母细胞瘤细胞自噬和凋亡,诱导异种移植小鼠肿瘤生长。维生素E衍生的生育三烯酚通过调控内质网应激和自噬途径促进前列腺癌细胞凋亡,且该抗肿瘤效用与JNK和p38信号通路活性相关[22],但p38 MAPK信号通路是否参与了PMI对人肺癌A 549细胞凋亡的促进作用尚未知。本研究结果表明:p38 MAPK抑制剂SB203580能明显抵抗PMI对人肺癌A 549细胞的促凋亡作用,说明PMI对A 549细胞的促凋亡作用与p38 MAPK信号转导途径的激活相关。
促凋亡的p53信号在肿瘤的发生发展中起关键作用,参与血管生成、转移和细胞存活[23]。研究[24]显示:白桑椹抗氧化成分的抑瘤作用可能是通过激活p53信号,进而介导肿瘤细胞凋亡。细胞能否发生凋亡,部分取决于介导细胞凋亡相关蛋白质(p53和Bax)与抗凋亡的蛋白质(Bcl-2)之间的平衡。研究[25]显示:在肺癌A 549细胞中p53表达上凋,p53的上调导致细胞Bcl-2表达下调,降低Bcl-2/Bax比值,促进细胞凋亡。此外,p53作为p38 MAPK信号通路下游的重要因子,对细胞凋亡具有决定作用。MDM 2属于泛肽连接酶,可将p53泛肽化,促使p53被蛋白酶降解,与肿瘤的发展密切相关。本研究结果表明:PMI通过激活p38 MAPK信号通路,加速MDM 2蛋白降解,促进p53蛋白的表达,导致p53蛋白发生核转位,激活下游p53介导的凋亡途径,诱导细胞发生凋亡。
综上所述,PMI通过激活p38 MAPK信号通路的转导促进p53的表达及核转位,最终导致p53介导的细胞凋亡途径被激活,诱导A 549细胞凋亡。

