丙戊酸联合X射线照射对乳腺癌MDA-MB-231细胞增殖的抑制作用及其机制
李官虎,郎庆旭,刘纯岩,刘 沁,耿梦柔,李晓倩,王珍琦
(1.吉林大学公共卫生学院 国家卫健委放射生物学重点实验室,吉林 长春 130021;2.吉林大学第二医院放射线科,吉林 长春 130041)
三阴性乳腺癌(triple-negative breast cancer,TNBC)是由缺乏雌激素受体、孕激素受体或人类表 皮 生 长 因 子 受 体2引 起[1]。研 究[2-3]显 示:TNBC预后不良。放射治疗是TNBC的主要治疗方法之一,然而由于TNBC转移潜能和放射敏感性的个体差异,许多患者出现放射治疗失败,从而导致癌症复发和转移[4]。因此,有必要制订新的策略,以加强放射治疗的有效性。
组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)是一类可有效抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)活性的化合物,具有抗癌活性[5-7]。几种HDACi已被美国食品和药物管理局批准用于治疗T细胞淋巴瘤[8]。
丙戊酸(valproic acid,VPA)是Ⅰ和Ⅱ类HDAC的有效抑制剂。由于人体对VPA有耐受性且其不良反应较少,因此VPA很可能是一类具有广泛应用前景的化疗新药[9],但其作用机制尚未完全阐明。HDACi单独应用活性相对有限,但HDACi可使肿瘤细胞对细胞毒性药物和辐射获得性抗性重新致敏[10]。
本研究检测VPA与X射线联合对TNBC MDA-MB-231细胞增殖、凋亡和自噬的影响,验证VPA是否可以增强其辐射敏感性,并探讨潜在的作用机制,为VPA介导的放射增敏机制研究和提高TNBC对放射治疗的有效率提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人TNBC MDA-MB-231细胞购自中国科学院上海细胞库,采用常规培养,培养条件:含10%胎牛血清的高糖DMEM,37℃、5%CO2和100%饱和湿度,细胞每3~4 d(即细胞铺满皿底70%~80%时)传代1次。VPA(美国Sigma公司),胎牛血清(浙江杭州四季青生物制品分公司),高糖DMEM(美国Gibco公司),胰蛋白酶(上海生物技术有限公司),PBS(美国Solarbi公司),DMSO(重庆东方试剂厂),CCK-8试剂盒(美国Bimake公司),FITC偶联Annexin-Ⅴ凋亡检测试剂盒(美国BD公司),细胞自噬检测试剂盒(北京百奥莱博科技有限公司)。TDZ5台式低速离心机(湖南赫西仪器装备有限公司),Pico&Fresco台式离心机(德国Heraeus公司),X射线深部辐照仪(型号X-RAD 320 ix,德国PXI公司),高压锅(日本Yamato公司),GAX-9240干燥箱(上海博讯公司),CelCulture细胞培养箱(新加坡ESCO科技有限公司),Epoch酶标仪(美国BioTek公司),FACSCalibur流式细胞仪(美国BD公司)。
1.2 照射条件采用X射线深部辐照仪照射,电压180 kV,电流20 mA,单次源靶距70 cm,剂量率1.0 Gy·min-1,照射时间4 min,照射剂量4 Gy。
1.3 CCK-8法检测各组细胞增殖率将细胞接种于96孔培养板,每孔3×103个细胞,共8复孔。分为对照组、不同浓度(2.5、5.0、10.0、20.0和40.0 mmol·L-1)VPA处理组、4 Gy X射线照射组和不同浓度(2.5、5.0、10.0、20.0和40.0 mmol·L-1)VPA联合4 Gy X射线照射组。继续培养细胞24、48和72 h后,采用CCK-8法检测各组细胞增殖率,将每孔中的培养液吸出,加入100μL新鲜培养液,再向每孔加入10μL CCK-8溶液,继续孵育3 h,采用酶标仪在450 nm处检测吸光度(A)值,计算细胞增殖率。细胞增殖率=(加药组A值-对照组A值)/对照组A值×100%。
1.4 流式细胞术检测各组细胞凋亡率和自噬率将处于指数生长期的MDA-MB-231细胞种植于6孔板中,培养24 h,加入VPA(10和25 mmol·L-1)24 h后给予4 Gy X射线照射,细胞分为对照组、VPA组、4 Gy X射线照射组、VPA联合4 Gy X射线照射组。24和48 h后收集细胞,采用0.25%胰酶消化为单细胞悬液后,1 000 r·min-1离心5 min,弃上清,加入1 mL预冷的PBS洗涤2次。细胞凋亡率检测:AnnexinⅤ/PI双染色,加入AnnexinⅤ-FITC 5μL,室温避光孵育10 min,加入PI(20 mg·L-1)10μL,室温避光孵育5 min,尼龙网过滤,吹打混匀后采用流式细胞仪检测细胞凋亡率。细胞自噬率检测:加入10 mL丹酰尸胺(monodansylcadavrine,MDC)(50 mmol·L-1),37℃静置30 min后,1 000 r·min-1离心5 min,弃废液,加入4%多聚甲醛1 mL避光条件下固定15 min,离心后加入PBS洗涤1次,尼龙网过滤后上机检测。采用CellQuest软件收集细胞,ModFit软件分析结果,至少收集1×104个细胞,计算细胞凋亡率和自噬率。细胞凋亡率=凋亡细胞数/细胞总数×100%,细胞自噬率=自噬细胞数/细胞总数×100%。
1.5 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组细胞增殖率、凋亡率和自噬率经正态性检验均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Students’st检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞增殖率不同浓度VPA单独或联合4 Gy X射线作用MDA-MB-231细胞24、48和72 h后,与对照组比较,2.5、5.0、10.0、20.0和40.0 mmol·L-1VPA组及2.5、5.0、10.0、20.0和40.0 mmol·L-1VPA联合4 Gy X射线照射组细胞增殖率均明显降低(P<0.01),并呈浓度和时间依赖性。与4 Gy X射线照射组比较,2.5、5.0、10.0、20.0和40.0 mmol·L-1VPA组及2.5、5.0、10.0、20.0和40.0 mmol·L-1VPA联合4 Gy X射线照射组细胞增殖率均明显降低(P<0.01),并呈浓度和时间依赖性。
作用24 h后,2.5 mmol·L-1VPA联合4 Gy X射线照射组细胞增殖率低于2.5 mmol·L-1VPA组(P<0.05)。作用72 h后,2.5和10.0 mmol·L-1VPA联合4 Gy X射线照射组细胞增殖率低于2.5和10.0 mmol·L-1VPA组(P<0.05)。表明VPA有助于提高MDA-MB-231细胞的辐射敏感性,但二者的联合作用并未明显优于VPA单独作用。见表1。
表1 4 Gy X线照射不同时间后各组MDA-MB-231细胞增殖率Tab.1 Proliferation rates of MDA-MB-231 cells in various groups after treated with 4 Gy X-ray irradiation for different time points (n=8,±s,η/%)
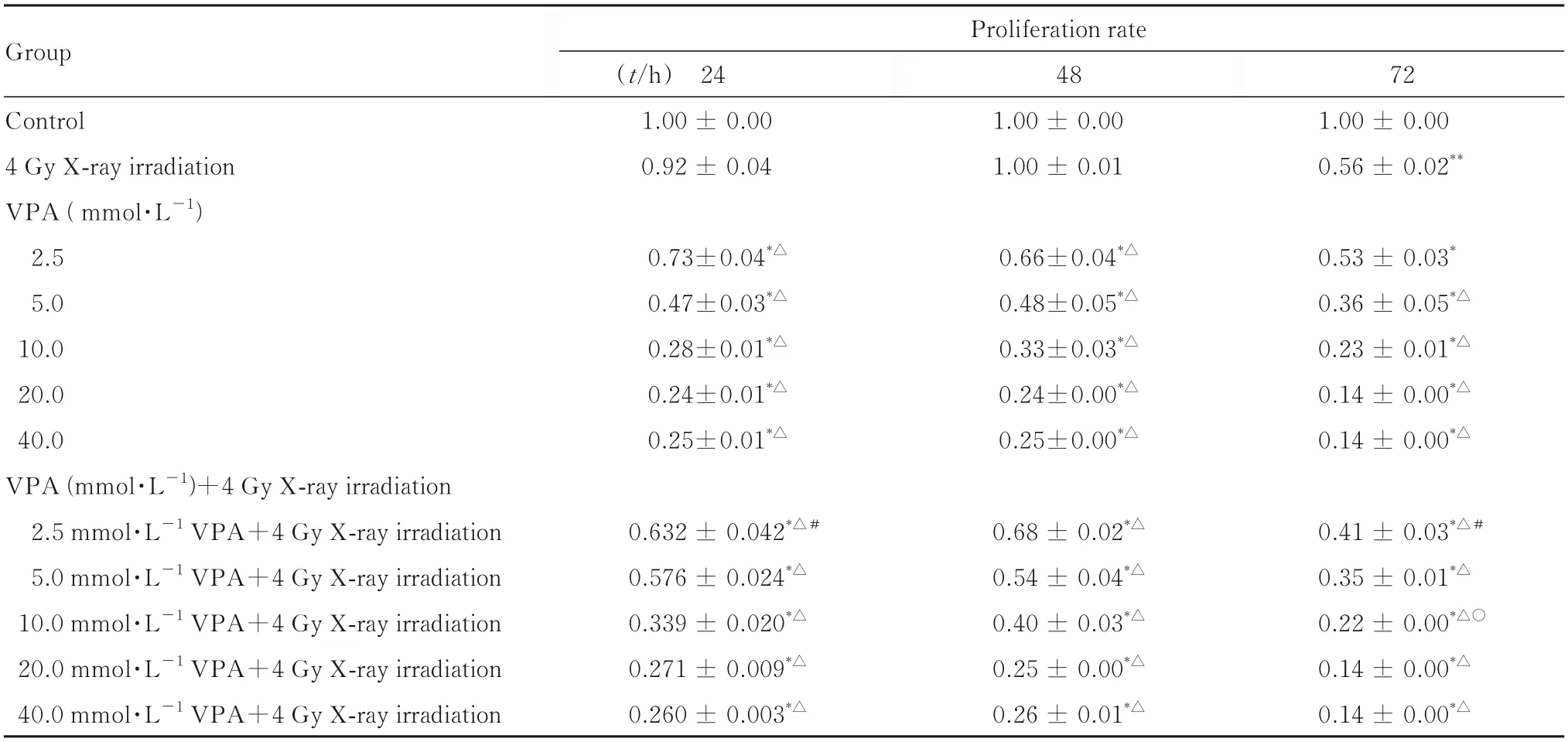
表1 4 Gy X线照射不同时间后各组MDA-MB-231细胞增殖率Tab.1 Proliferation rates of MDA-MB-231 cells in various groups after treated with 4 Gy X-ray irradiation for different time points (n=8,±s,η/%)
*P<0.01 vs control group;△P<0.01 and vs 4 Gy X-ray irradiation group;#P<0.05 vs 2.5 mmol·L-1 VPA group;○P<0.05 vs 10.0 mmol·L-1 VPA group.
Group Proliferation rate Control 4 Gy X-ray irradiation VPA(mmol·L-1)2.5 5.0 10.0 20.0 40.0 VPA(mmol·L-1)+4 Gy X-ray irradiation 2.5 mmol·L-1 VPA+4 Gy X-ray irradiation 5.0 mmol·L-1 VPA+4 Gy X-ray irradiation 10.0 mmol·L-1 VPA+4 Gy X-ray irradiation 20.0 mmol·L-1 VPA+4 Gy X-ray irradiation 40.0 mmol·L-1 VPA+4 Gy X-ray irradiation(t/h) 24 1.00±0.00 0.92±0.04 48 1.00±0.00 1.00±0.01 72 1.00±0.00 0.56±0.02**0.73±0.04*△0.47±0.03*△0.28±0.01*△0.24±0.01*△0.25±0.01*△0.66±0.04*△0.48±0.05*△0.33±0.03*△0.24±0.00*△0.25±0.00*△0.53±0.03*0.36±0.05*△0.23±0.01*△0.14±0.00*△0.14±0.00*△0.41±0.03*△#0.35±0.01*△0.22±0.00*△○0.14±0.00*△0.14±0.00*△0.632±0.042*△#0.576±0.024*△0.339±0.020*△0.271±0.009*△0.260±0.003*△0.68±0.02*△0.54±0.04*△0.40±0.03*△0.25±0.00*△0.26±0.01*△
2.2 各组细胞凋亡率5 mmol·L-1VPA单独或联合4 Gy X射线作用MDA-MB-231细胞24和48 h后,与对照组比较,4 Gy X射线照射组、5 mmol·L-1VPA组和5 mmol·L-1VPA联 合4 Gy X射线照射组细胞凋亡率均明显升高(P<0.05或P<0.01)。与4 Gy X射线照射组比较,5 mmol·L-1VPA联合4 Gy X射线照射组细胞凋亡率均明显升高(P<0.01)。见图1和表2。
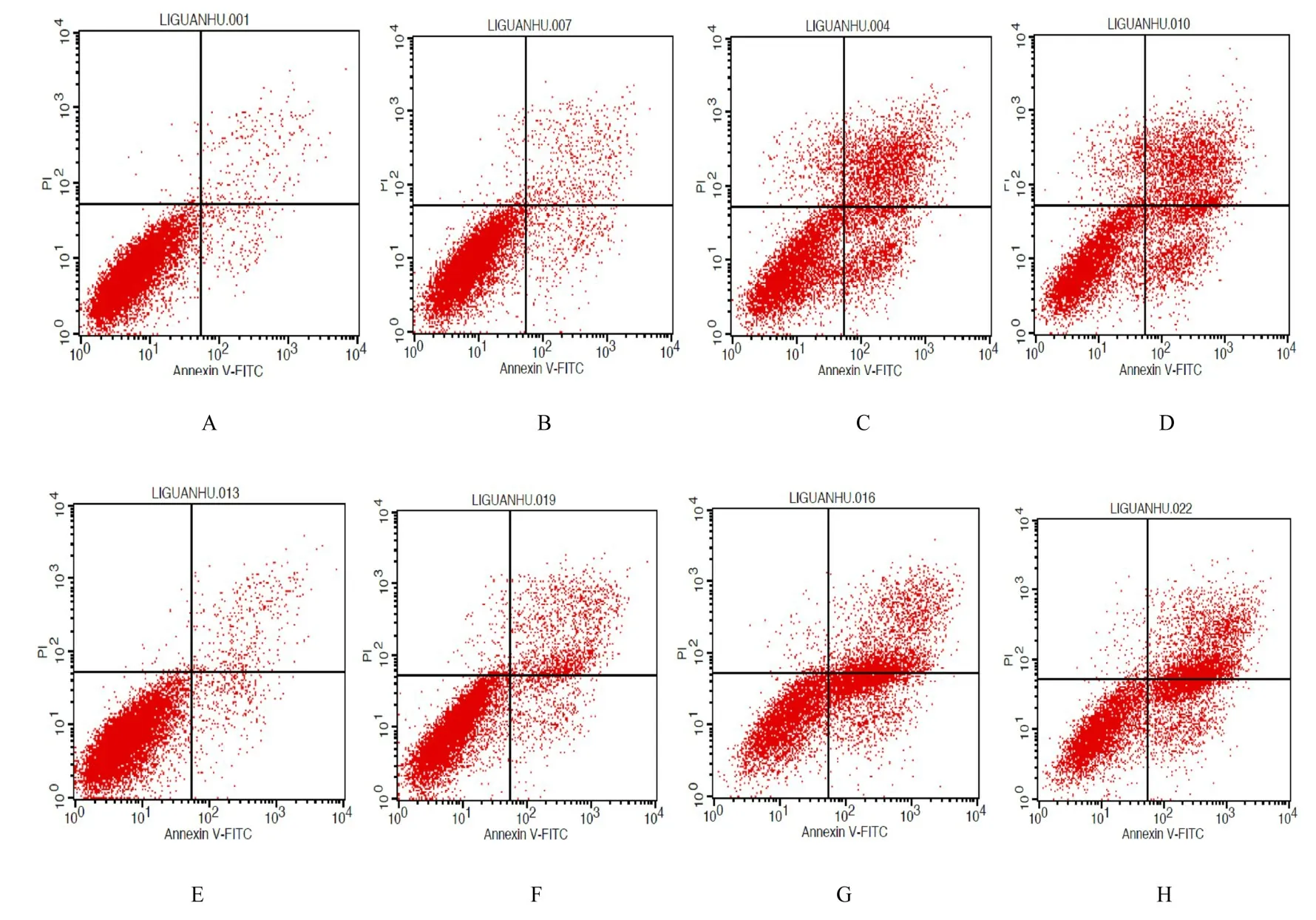
图1 流式细胞术检测照射24和48后各组MDA-MB-231细胞凋亡率Fig.1 Apoptotic rates of MDA-MB-231cellsin variousgroupsafter irradiated for 24and 48 h detected by flow cytometry
2.3 各组细胞自噬率5 mmol·L-1VPA单独或联合4 Gy X射线作用MDA-MB-231细胞24 h后,与对照组和4 Gy X射线照射组比较,5 mmol·L-1VPA组和5 mmol·L-1VPA联合4 Gy X射线照射组细胞自噬率均明显升高(P<0.05或P<0.01)。作用48 h后,与对照组比较,4 Gy X射线照射组、5 mmol·L-1VPA组和5 mmol·L-1VPA联合4 Gy X射线照射组细胞自噬率均明显升高(P<0.01)。与4 Gy X射线照射组和5 mmol·L-1VPA组比较,5 mmol·L-1VPA联合4 Gy X射线照射组细胞自噬率升高(P<0.05)。见图2和表2。
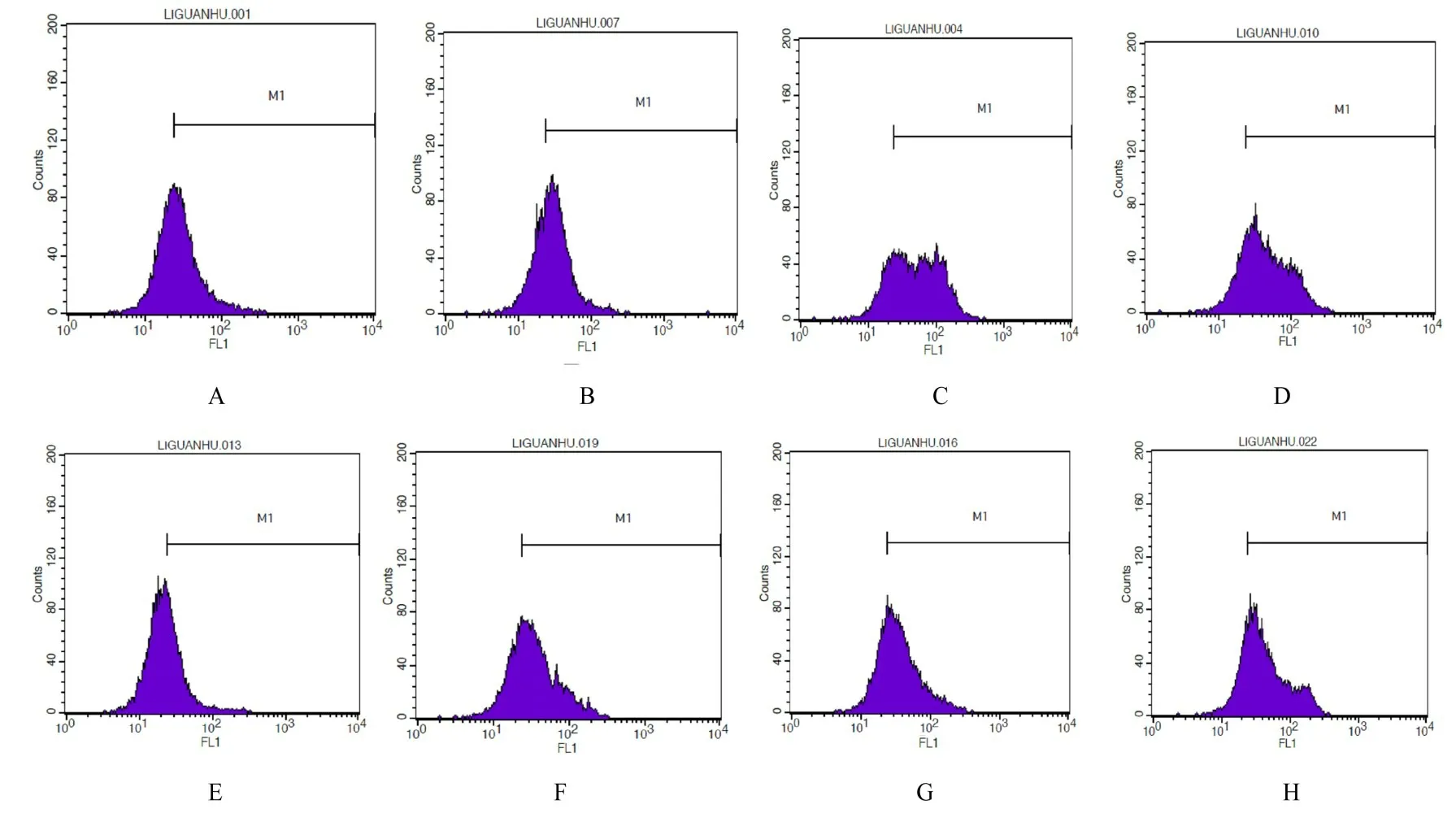
图2 照射24和48 h后各组MDA-MB-231细胞自噬率Fig.2 Autophagy rates of MDA-MB-231 cells in various groups after irradiated for 24 and 48 h
表2 照射24和48 h后各组MDA-MB-231细胞凋亡率和自噬率Tab.2 Apoptotic rates and autophagy rates of MDA-MB-231 cells in various groups after irradiated for 24 and 48 h(n=3,,±s,η/%)

表2 照射24和48 h后各组MDA-MB-231细胞凋亡率和自噬率Tab.2 Apoptotic rates and autophagy rates of MDA-MB-231 cells in various groups after irradiated for 24 and 48 h(n=3,,±s,η/%)
*P<0.05,**P<0.01 vs control group;△P<0.05,△△P<0.01 and vs 4 Gy X-ray irradiation group;#P<0.05 vs 5.0 mmol·L-1 VPA group.
Group Control 4 Gy X-ray irradiation 5.0 mmol·L-1 VPA 5.0 mmol·L-1 VPA+4 Gy X-ray irradiation Apoptotic rate 24 h 6.27.±0.53 10.73±0.81**41.24±6.22*△48 h 6.46±1.26 22.50±2.27**57.91±12.03*△Autophagy rate 24 h 8.17±0.74 8.56±0.49 42.17±3.23**△△48 h 7.73±0.62 32.60±2.43**30.27±1.70**42.39±4.15**△△58.24±3.88**△△38.60±5.49*△40.63±0.65**△#
3 讨 论
乳腺癌是世界范围内确诊最多的癌症,也是女性癌症相关死亡的第二大原因,仅次于肺癌[11]。尽管乳腺癌在诊断和治疗上取得了一定的进展,但其异质性使得治疗这种疾病成为全球性的挑战,需要采取更有效的治疗策略[12]。表观遗传失调在肿瘤的发生和发展中起关键作用,因此,以表观遗传调控因子为靶点为肿瘤治疗开拓了新的视野[13]。
表观遗传类药物HDACi是一类很有前途的抗肿瘤药物,因为其在许多肿瘤中(包括乳腺癌)中具有抑制细胞增殖、诱导细胞凋亡和阻滞细胞周期的作用[14]。尽管在临床试验中,HDACi作为单一药剂在乳腺癌治疗中并未表现出惊人的效果,但有研究[15-16]证明HDACi可提高乳腺癌对化疗和放疗的敏感性。以往研究[14,17-19]显示:HDACi VPA在体外抑制不同类型肿瘤细胞的增殖,包括乳腺癌细胞,表现出与其他化疗药物的协同或加强作用,如与顺铂等药物联合。
本研究结果显示:VPA单独作用TNBC MDA-MB-231细胞后,细胞增殖明显受抑,并呈浓度和时间依赖性。最近也有研究[19-21]报道了VPA以剂量和时间依赖的方式抑制乳腺癌细胞增殖和迁移,与本研究结果一致。本研究结果显示:VPA作用后,MDA-MB-231细胞凋亡率和自噬率均明显升高,表明VPA通过诱导TNBC细胞的凋亡和自噬从而抑制其增殖。以往研究[22-23]显示:VPA主要通过改变肿瘤细胞组蛋白乙酰化状态来改变不同基因的转录水平,从而引起广泛的抗肿瘤效应,包括抑制多种肿瘤细胞的增生,促进分化和诱导凋亡,增强化疗敏感性及逆转肿瘤转移等,本研究在MDA-MB-231细胞中进一步证实了VPA的抗肿瘤作用,并揭示其机制是通过诱导凋亡和自噬导致细胞增殖受抑。
本研究同时检测了VPA联合4 Gy X射线照射对MDA-MB-231细胞的作用,结果显示:细胞增殖明显受抑,细胞凋亡率和细胞自噬率均明显升高,且效果优于二者单独应用。表明VPA加强了X射线照射肿瘤生长抑制作用,揭示其机制是通过诱导MDA-MB-231细胞发生凋亡和自噬。通过VPA的预先作用,使原本辐射抗性的MDA-MB-231细胞对辐射致敏,即可能增强了其辐射敏感性。最近有研究[24]显示:HDAC活性升高和组蛋白磷酸乙酰化的变化会导致乳腺癌细胞辐射抗性增加。
自噬信号是提高肿瘤治疗效果的重要靶点。研究[25]显 示:HDACi辛 二 酰 苯 胺 异 羟 肟 酸(suberanilohydroxamic acid,SAHA)通 过 抑 制TNBC中蛋白激酶(proteinase B,Akt)/哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)途径刺激自噬。SAHA通过降低人乳腺癌细胞中survivin和X连锁凋亡抑制蛋白(X linked inhibitors of apoptosis protein,XIAP)蛋白的稳定性诱导细胞自噬和抑制细胞活力[26]。此外,电离辐射通过调节DNA损伤修复相关蛋白PARP-1诱导细胞自噬[27]。本研究结果显示:单纯VPA组、单纯4 Gy X射线照射组和VPA联合4 Gy X射线照射组细胞自噬率均明显升高,表明联合治疗引起MDA-MB-231细胞发生自噬。然而,自噬在控制癌症存活或细胞死亡中的作用尚存争议。本研究结果显示:联合组细胞增殖率明显降低,提示自噬对受到电离辐射和VPA联合作用的MDA-MB-231细胞具有细胞毒性作用。ZHOU等[28]发现:抑制自噬可以明显提高鼻咽癌细胞的放射敏感性。而CHAACHOUAY等[29]报道:辐射抗性乳腺癌细胞照射后显示出强烈的自噬诱导,然后起到保护作用。因此,抑制或过度激活自噬是否更有益,仍有待进一步研究。
综上所述,VPA对MDA-MB-231细胞具有生长抑制作用,并可能有助于提高其辐射敏感性,其机制涉及VPA诱导细胞发生凋亡和自噬。本课题组下一步工作应在动物模型中进一步对该结论加以证实。

