金钗石斛多糖提取分离、结构解析及生物活性研究进展
代国娜,尚明越,王嘉乐,郑加梅,徐福荣,宋经元,段宝忠*
1.大理大学药学院,云南 大理 671000
2.云南中医药大学中药学院,云南 昆明 650504
3.中国医学科学院 北京协和医学院药用植物研究所,北京 100193
金钗石斛Dendrobium nobileLindl.是名贵药材石斛的基原植物之一,药用部位为新鲜或干燥茎,具有益胃生津、滋阴清热的功效,用于热病津伤、口干烦渴、胃阴不足、食少干呕、病后虚热不退、阴虚火旺、骨蒸劳热、目暗不明、筋骨痿软[1]。现代研究表明金钗石斛含有多糖、生物碱等多种化合物[2],其中生物大分子多糖也是金钗石斛的主要生物活性分子之一,具有免疫调节、抗氧化、抗衰老、抗肿瘤等药理活性[3-6]。近年来,已有学者对金钗石斛的化学成分和药理作用进行了相关报道[7-9],但尚未见对其多糖的提取分离、结构解析和生物活性进行系统报道。鉴于此,本文对近年来国内外金钗石斛多糖提取分离、结构特征和生物活性及其作用机制的研究进行了系统综述,以期为金钗石斛资源的开发利用提供科学参考。
1 金钗石斛多糖的提取和分离纯化
1.1 金钗石斛多糖的提取
金钗石斛多糖的提取方法主要有水提取法、有机溶剂提取法、超声波辅助提取法、微波辅助提取法和酶提取法等[8]。基于上述提取工艺,多位学者采用单因素与正交试验或响应面法结合的方式,以苯酚硫酸法检测多糖得率,对金钗石斛多糖的提取工艺进行了优化[10-13]。研究显示,微波辅助提取法提取率高、提取时间短、耗能小、成本低,更合适广泛推广和普及,该法与传统水提醇沉法相比可显著提高金钗石斛多糖的提取率,影响金钗石斛多糖得率的因素依次为料液比、提取时间、微波时间[11];水提取法操作简单,成本低,应用广泛,一般考察料液比、提取时间、提取温度和提取次数等因素,多采用料液比1∶10~1∶52,温度在59~100 ℃,提取时间1~2.5 h,反复提取后,得粗多糖[14-18]。有机溶剂提取法中多以乙醚为提取剂,60~100 ℃加热回流2~3 h进行提取[13,19]。超声波辅助提取法利用超声振动的空化、机械粉碎以及热学等作用,破坏药材细胞,加快药材有效成分的溶出,进而达到高效提取的目的[20]。余芳等[10]通过正交试验考察超声辅助提取法各因素对金钗石斛多糖得率的影响,明确影响大小依次为料液比、超声时间、温度,并建立了最佳工艺。酶提取法利用酶水解或降解植物细胞壁,增强细胞通透性,从而提高有效成分的提取率[21]。张晓敏等[22]对金钗石斛多糖纤维素酶提取工艺进行优化,发现该法的多糖得率比热回流提取法高43.84%。金钗石斛多糖提取方法的相关参数见表1。

表1 金钗石斛多糖提取方法Table 1 Extraction methods of polysaccharides from D.nobile
1.2 金钗石斛多糖的分离纯化
金钗石斛粗多糖样品中一般含有低聚糖、蛋白质、色素和脂质等杂质,需分离去除杂质后,再进行纯化方可获得均一多糖[28]。金钗石斛粗多糖中的小分子物质通常采用多次醇沉去除[29];蛋白多采用Savage法和冻融法去除[26,30-31],脱色方法常采用活性炭吸附法、双氧水氧化法、吸附树脂法[30,32]。金钗石斛多糖的分离纯化主要采用柱色谱法、分步沉淀法和超滤法等[33];其中以柱色谱法应用最为广泛,通常采用二乙氨基乙基(diethylaminoethyl,DEAE)纤维柱联合葡聚糖凝胶柱进行分离,首先采用DEAE-52纤维柱按极性大小进行分离,再根据相对分子质量大小,用Sephacryl S和Sephadex G系列柱进行纯化[34]。除此之外,还有少数采用AB-8大孔树脂吸附法或乙醇梯度醇沉法[17,26];金钗石斛多糖的相关纯化方法见表2。
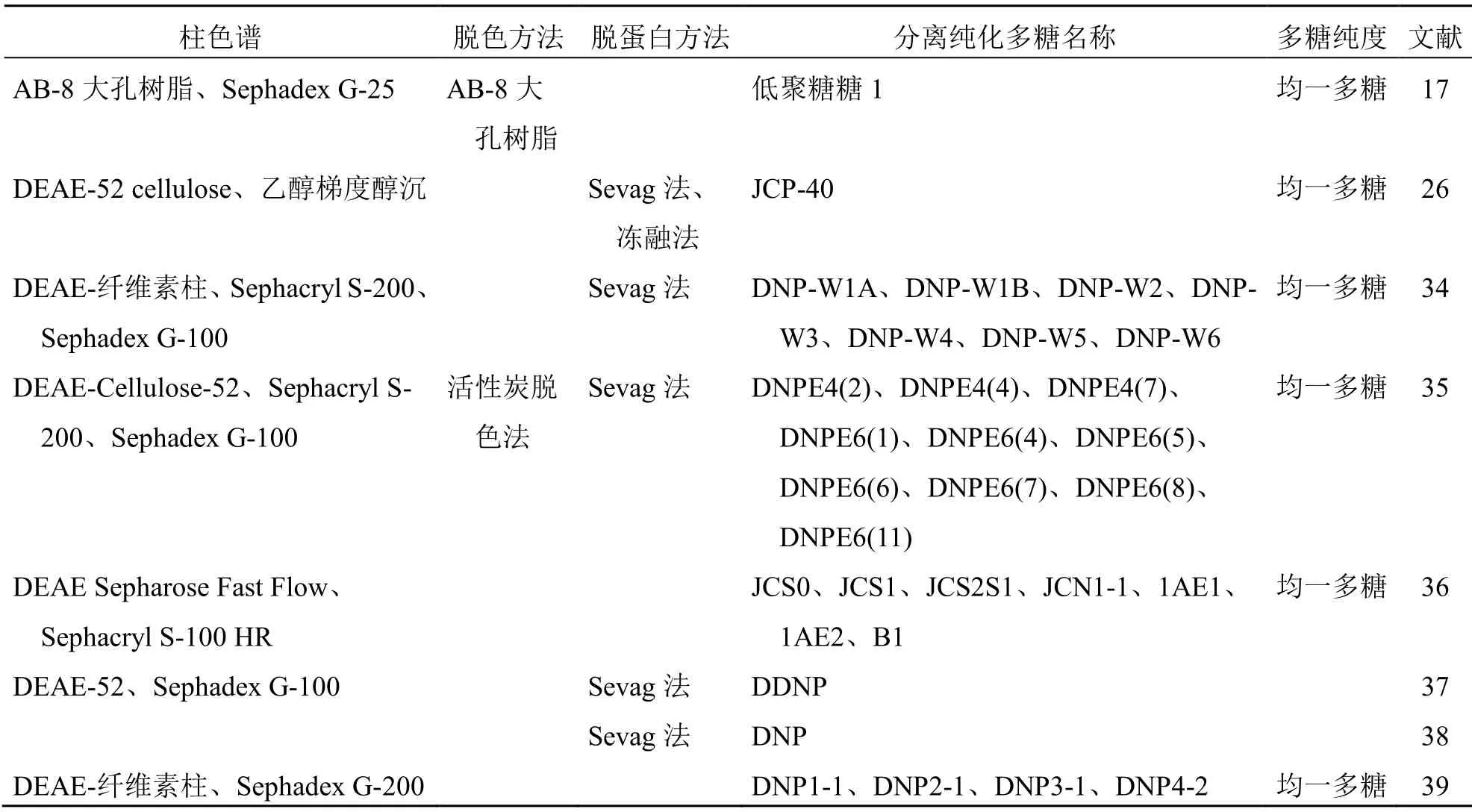
表2 金钗石斛多糖的分离纯化过程及结果Table 2 Separation and purification of polysaccharides from D.nobile
2 金钗石斛多糖的结构研究
2.1 金钗石斛多糖相对分子质量
相对分子质量是多糖重要物理特征之一,可间接反映其纯度[40]。多位学者均采用高效凝胶渗透色谱法对金钗石斛中多糖的相对分子质量进行了测定,分离得到均一多糖的相对分子质量主要分布范围为817~770 000[17,34-35,39],见表3。
2.2 金钗石斛多糖的单糖组成
单糖组成通常先通过酸水解的方法将多糖水解成单糖,以标准单糖为对照,水解产物采用柱前衍生高效液相色谱法[46]、阴离子交换色谱安培法[47]、糖醇乙酸酯衍生化后联合气相色谱法[31,36]和1-苯基-3-甲基-5-吡唑啉酮柱前衍生化-高效液相色谱(PMP-HPLC)法[36,41]等进行定性、定量分析。研究结果显示,金钗石斛多糖的单糖组成丰富,但主要由阿拉伯糖、葡萄糖、半乳糖和甘露糖组成,此外还含有鼠李糖、甘露糖、木糖、半乳糖醛酸和葡萄糖醛酸等,见表3。
2.3 金钗石斛多糖的结构特征
金钗石斛多糖精细结构的研究甚少,仍处于起步阶段,目前,有关其化学结构解析主要通过甲基化、高碘酸盐氧化、Smith降解及1D/2D核磁共振谱(NMR、COSY、HSQC、HMBC和TOCSY)分析[26,34-36]。金钗石斛多糖的结构信息见表3。
3 金钗石斛多糖的生物活性
3.1 抗炎
炎症与多种疾病密切相关[48]。研究显示,金钗石斛多糖可抑制脂多糖(lipopolysaccharide,LPS)诱导的小鼠腹腔巨噬细胞肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和一氧化氮(nitric oxide,NO)释放,显著抑制炎症反应[49-50],后续的研究发现,其还可显著降低大鼠脑缺血-再灌注区炎症反应[51-52]。此外,金钗石斛多糖可对抗LPS引起的大鼠海马神经元炎症反应,降低TNF-α、白细胞介素-1β(interleukin-1β,IL-1β)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)蛋白及其mRNA表达,发挥神经元保护作用[53];另有研究表明,金钗石斛多糖可保护神经元免受炎症因子的损伤,其机制为抑制核因子-κB(nuclear factor-κB,NFκB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,减少炎症因子TNF-α、IL-6、IL-1β和环氧合酶-2(cyclooxygenase-2,COX-2)的产生[54-55]。
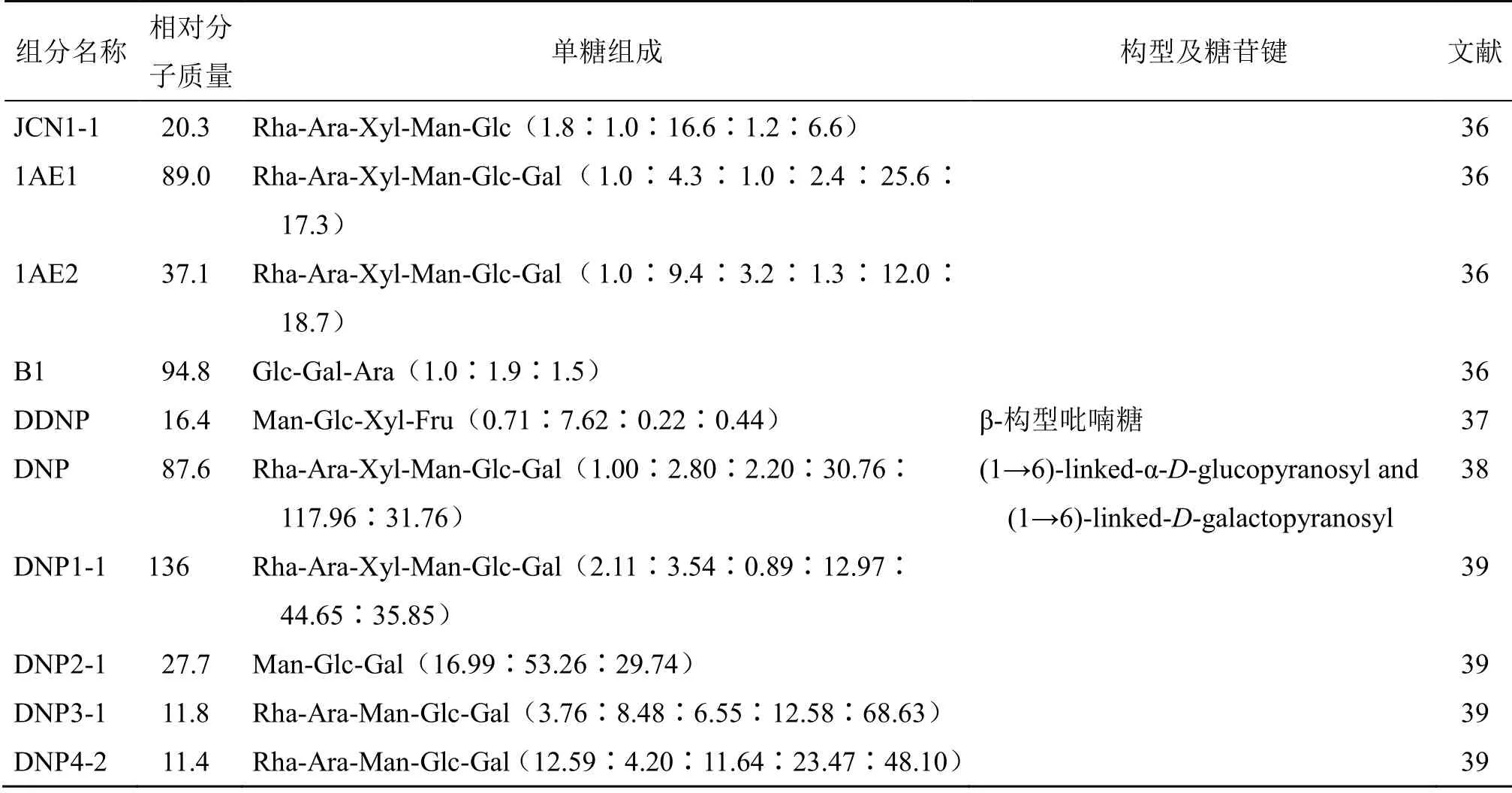
续表3
3.2 免疫调节
机体免疫功能的维持依赖体内各种免疫器官及细胞。金钗石斛精制多糖和粗制多糖均能直接促进脾细胞的增殖,并对刀豆蛋白、LPS分别诱导的脾T细胞和B细胞的增殖有促进作用[19];多项研究发现,金钗石斛多糖DNP-W1B、DNP-W、DNP-W2、DNP-W3、HDNP-W2等均对脾T细胞和B细胞具增殖作用,且呈剂量相关性[31,44,56]。此外,金钗石斛多糖DNP-W5的分支和乙酰基,具有增强T细胞和B细胞免疫活性作用[45];Fan等[57]研究了含金钗石斛多糖的血清对小鼠巨噬细胞样细胞系RAW264.7的影响,结果表明含药血清可显著提高其吞噬能力,促进细胞因子TNF-α、IL-6、IL-1的分泌,并在转录水平上促进IL-1β的表达。
3.3 抗氧化和抗衰老
金钗石斛多糖对不同的氧化体系均具有抗氧化能力,具有显著的量效关系,并对2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸+[2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)+,ABTS+]、二苯基苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟基自由基(·OH)、亚硝酸根(NO2−)有较强的清除能力[58-60],与其他石斛多糖相比,金钗石斛多糖清除·OH、NO2−能力最佳,但无明显差异[59];通过对金钗石斛等5种石斛植物多糖的ABTS+、·OH清除能力进行研究,发现各酸性多糖抗氧化活性与糖醛酸含量呈正相关,与硫酸糖含量呈负相关[60];研究显示,金钗石斛多糖可抵抗高糖诱导下的氧化应激损伤,保护细胞的氧化还原稳态,其机制为促进细胞核因子E2相关因子2(nuclear factor NF-E2-related factor 2,Nrf2)蛋白表达和核移位,上调醌氧化还原酶1(quinone oxidoreductase 1,NQO1)mRNA的表达[61]。此外,谢苗苗等[18]采用H2O2诱导的细胞损伤模型,发现金钗石斛多糖有显著的抗细胞衰老作用;亦有研究表明,金钗石斛多糖具有抗衰老作用,可拮抗D-半乳糖诱导的衰老小鼠免疫器官及组织的萎缩和病变[62];还可延缓秀丽隐杆线虫平均生存时间,其机制与提高线虫抗应激能力有关[5,63]。
3.4 抗肿瘤
抗肿瘤领域的相关研究是多糖药效研究的热点,从金钗石斛中分离得到的DNP-W1、DNP-W3多糖,对肉瘤S-180细胞和人早幼粒白血病HL-60细胞具有显著的抑制活性[64];金钗石斛水提物对人宫颈癌HelaS3细胞和肝癌HepG2细胞有不同程度的抑制作用,其可能机制是抑制原癌基因c-myc的表达[65];金钗石斛多糖可抑制BALB/c荷瘤鼠皮肤腺癌移植瘤的生长,其机制与促进肿瘤细胞凋亡有关[4];此外,多糖DNP4-2能显著提高免疫指数,并促进IL-2、TNF-α和γ干扰素(interferon-γ,IFNγ)的分泌,降低血清中丙二醛(malondialdehyde,MDA)浓度,提示DNP4-2是一个潜在的抗肿瘤药物[30];金钗石斛多糖能明显降低肾母细胞瘤WT1蛋白表达水平,对白血病细胞有一定杀伤作用[66],亦可直接抑制慢性粒细胞白血病K562细胞增殖并诱导其凋亡,其可能机制与金钗石斛多糖抑制K562细胞中BCR-ABL融合基因的表达有关[67]。
3.5 抗肝损伤
金钗石斛多糖的抗肝损伤作用主要包括抗酒精性、非酒精性和肝纤维化肝损伤。研究发现金钗石斛多糖对亚急性酒精性肝损伤有一定程度的保护作用,其机制可能为通过抑制肝组织氧化和炎性损伤[68];金钗石斛多糖对肝纤维化大鼠的肝损伤具有明显的效果,其机制与亚急性酒精性肝损伤相同[69];进一步研究显示,金钗石斛多糖抗肝纤维化的作用机制可能与下调TGF-β1、金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinases-1,TIMP-1)mRNA表达,上调基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)mRNA表达有关[70];此外,金钗石斛多糖可明显改善高脂高糖饮食诱导的非酒精性脂肪肝病大鼠肝功能和血脂,机制可能与降低炎性小体NOD样受体蛋白3的蛋白及mRNA的表达,进而调控IL-1β和IL-18,减轻炎症反应有关[71];亦有研究显示,金钗石斛多糖可以明显改善非酒精性脂肪肝病的预后,降低大鼠肝脏中细胞色素P4502E1(cytochrome P4502E1,CYP2E1)蛋白及mRNA表达,进而改善肝功能和血脂水平,提高过氧化氢酶和超氧化物歧化酶活力,最终有效缓解非酒精性脂肪肝病[72]。
3.6 抗糖尿病及其并发症
糖尿病是临床最常见的代谢性疾病,多由于胰岛素分泌缺陷或胰岛素作用障碍,以高血糖为特征,其病程缓慢,在发展过程中可导致多种并发症,尤其是易引起相关器官损害,以糖尿病心肌损伤最为常见[73-74]。研究表明,金钗石斛多糖对肾上腺素引起的高血糖小鼠有明显的降血糖作用,但对正常小鼠血糖无明显影响,其可能机制为抑制肝糖元分解和肌糖元酵解,促进外周组织对葡萄糖的摄取和利用[75];赵亨等[76-77]研究发现金钗石斛多糖能增加高糖诱导的大鼠胰岛细胞瘤细胞的胰岛素分泌量;此外,研究表明金钗石斛多糖可降低血糖和升高胰岛素含量,可明显促进糖尿病大鼠心肌细胞中B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-xL分泌,并降低Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和Bad的表达,实现心肌细胞保护作用[78];进一步的研究发现,金钗石斛多糖可提高大鼠抗氧化能力,增加心脏组织中MMP-1和MMP-9的表达,改善2型糖尿病心肌损伤大鼠心功能,且具有明显的剂量相关性[74,79];同时,王军辉[34]研究证实,金钗石斛粗多糖及各均一多糖组分都对链脲佐菌素诱导的糖尿病性白内障有一定的延缓作用,且各多糖处理组之间差异较大,以粗多糖与DNPW1A的效果最好,呈剂量相关性。
3.7 其他
金钗石斛多糖还具有其他药效,如多糖乙酰衍生化物可促进肾上腺嗜铬细胞瘤PC-12细胞神经轴突出的生长,硫酸衍生化物可抑制微血管内皮细胞HMEC-1的管腔形成、HMEC-1的迁移以及体内血管生成[36];樊小宝等[80]研究表明,金钗石斛多糖可改善多柔比星肾病大鼠的肾功能和肾纤维化。此外,金钗石斛粗多糖通过拮抗晶状体氧化损伤,发挥抗白内障的作用[81];多糖JCP-40对预防胃黏膜具有保护作用[26]。还可增加脂肪的利用,延缓乳酸的积累,起到抗疲劳作用[82]。
金钗石斛多糖的主要生物活性及其作用机制见图1。

图1 金钗石斛多糖的主要生物活性及其作用机制Fig.1 Main bioactivities and mechanisms of polysaccharides from D.nobile
4 结语
石斛入药始载于《神农本草经》,列为上品,在传统医学中应用十分广泛,被称为“九大仙草”,具有益胃生津、滋阴清热的功效,这与现代研究相近;多糖作为金钗石斛中的主要活性物质,药理研究表明具有抗肿瘤、抗炎、抗氧化、抗衰老、抗糖尿病、保肝等多方面的药理活性,无疑将会成为开发健康产品的最佳原料选择之一,存在巨大的开发价值。目前,对金钗石斛多糖的提取分离、结构鉴定、活性评价方面的研究已取得一定进展,但其多糖的结构及质量和药效评价尚存在很多问题。一方面,金钗石斛多糖的提取纯化和结构表征分析,是金钗石斛多糖产业化的重要前提,但金钗石斛的提取、分离纯化方法仍不成熟,质量控制指标和标准建设尚不完善,以致最终得到的多糖结构及活性均存在一定的差异;其次,金钗石斛多糖结构的研究不少,但是真正得到一级结构的却很少,其多糖的结构特征与各种活性之间的构效关系尚只是初步探讨,探索金钗石斛多糖的质控评价方法和高级结构解析技术,加深对其结构及生物活性之间关系的解析,是未来研究金钗石斛多糖的重点,仍需要大量的研究工作进行补充确定;此外,有关金钗石斛多糖生物活性的研究,尚处于细胞、器官和组织的初级探索阶段,许多目标靶点的分子机制仍然需要深入探讨。因此,建立高效稳定的分离纯化方法和质量标准,进一步深入研究金钗石斛多糖的结构特征、药理活性及其构效关系,将为金钗石斛资源综合开发利用和产业链延伸具有重要价值。
利益冲突所有作者均声明不存在利益冲突