基于部分药效和毒副作用探索中药汤剂抑苦掩味伴侣剂的影响:以黄连解毒汤为例
柯秀梅,周文杰,廖丽萍,肖浪浪,施汝欣,王建伟,韩 丽,张定
1.重庆医科大学中医药学院,重庆 400016
2.四川科伦药业股份有限公司安岳分公司,四川 成都 611137
3.九江学院基础医学院/九江市转化医学重点实验室,江西 九江 332005
4.成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137
中医药在疾病治疗中具有综合起效、不良反应小、预后良好的优势,尤其是中药汤剂,具有随证加减、运用灵活,能个性化精准给药的特点。在2019年开始爆发的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的防治中,中医药功不可没。临床初步证实,清热解毒解表药物及方剂如清肺排毒汤、化湿败毒方、宣肺败毒颗粒、金花清感颗粒和连花清瘟胶囊等对COVID-19疗效确切[1]。此外,黄连解毒汤(Huanglian Jiedu Decoction,HJD)被国家卫生健康委员会及各地相关单位陆续发布的多个诊疗方案推荐治疗COVID-19重症期的气营两燔证[2]。作为泻火解毒的经典方剂,HJD广泛用于中医临床[3-4]。现代药理研究表明,HJD能抗肺炎[5]、抗氧化[6]、抗炎[7]、解热[8-10]、抗血栓[11]和抗动脉粥样硬化[12]等。然而,味苦和口感差是中药的共性问题。特别是苦味成分分散度高、难以有效矫味的中药汤剂/液体制剂[13],口感差严重影响了患者服药顺应性,制约了其临床应用。为了开发有效的中药汤剂/液体制剂矫味剂,本课题组提出基于“霰弹理论”的中药汤剂掩味的研制思路,筛选出能有效改善中药如HJD口感的汤剂伴侣剂[14]。然而,有效性与安全性是药物的基本属性,是其质量控制的核心要义。矫味伴侣剂(辅料)在抑苦掩味的同时,必须以不影响药物的疗效和安全性为前提。本研究以体外抗氧化、解热、抗炎、急性毒性和肠道菌群的变化,从药效、毒性和副作用3个方面评价伴侣剂对HJD的影响。
1 仪器与材料
1.1 仪器
Spectra Max i3X酶标仪,美谷分子仪器上海有限公司;BSA124S电子分析天平,德国Sartorius AG公司;SW-CJ-2F双人双面净化工作台,苏州净化设备有限公司。
1.2 试剂
黄芩、黄连、黄柏和栀子饮片均购自四川新荷花中药饮片股份有限公司,经成都中医药大学刘晓芬讲师鉴定,为唇形科黄芩属植物黄芩Scutellaria baicalensisGeorgi的干燥根,毛茛科黄连属植物黄连Coptis chinensisFranch的干燥根茎,芸香科黄檗属植物黄柏Phellodendron chinenseSchneid除去栓皮的干燥树皮,茜草科栀子属植物栀子Gardenia jasminoidesEllis的干燥成熟果实。链霉素,上海研生生化试剂有限公司,质量浓度99%;青霉素,武汉易泰科技有限公司,质量分数99%。脂多糖(lipopolysaccharides,LPS),批号L2880,Sigma公司。纽甜,郑州阿尔法化工有限公司,质量分数95%;单甲氧基聚乙二醇-左旋聚乳酸(monomethoxy polyethylene glycol-l-poly lactic acid,mPEG2000-PLLA2000),济南岱罡生物工程有限公司,批号2019071415;γ-环糊精(γ-cyclodextrin,γ-CD),郑州阿尔法化工有限公司,批号2018122505。三羟甲基氨基甲烷盐酸[tris(hydroxymethyl) aminomethane,Tris-HCl]缓冲液,北京索莱宝科技有限公司,编号ST788。维生素C(vitamin C,VC),北京索莱宝科技有限公司,质量浓度99%。
1.3 动物
SPF级昆明小鼠,体质量(20±2)g,SCXK(赣)2008-0003,购自江西省实验动物中心。所有动物实验遵循九江学院附属医院伦理委员会有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 HJD的制备
课题组前期研究表明,中药汤剂抑苦掩味伴侣剂处方(纽甜、mPEG2000-PLLA2000、γ-CD、HJD药液质量比0.028∶0.15∶1.5∶100)能显著改善HJD的口感[13]。本实验进一步评价该抑苦掩味伴侣剂处方对HJD药效和安全性的影响。
2.1.1 HJD药液 按黄连、黄芩、黄柏、栀子3∶2∶2∶3质量比准确称取各药味饮片共100 g,混合,加10倍量水浸泡0.5 h,回流提取3次,每次1 h。合并煎液,定容至药液质量浓度为0.2 g/mL(按含生药量计),即得HJD药液。
2.1.2 HJD+伴侣剂 按“2.1.1”项方法制备HJD药液,向其中加入处方量(纽甜、mPEG2000-PLLA2000、γ-CD、HJD药液质量比0.028∶0.15∶1.5∶100)的抑苦掩味伴侣剂,超声、搅拌,使其溶解或充分分散,即得。
2.2 伴侣剂对HJD体外抗氧化的影响
2.2.1 1,1-二苯基-2-苦基肼自由基(2,2-diphenyl-1-picrylhydrazyl,DPPH)清除率的检测 于96孔板中加入190 μL DPPH溶液(0.1 μmol/L甲醇溶液)和10 μL不同质量浓度的样品溶液(40、20、10 mg/mL)。190 μL DPPH和10 μL蒸馏水为空白对照,混匀后避光震荡30 min,测定517 nm处的样品吸光度(A1)值和HJD自身吸光度(A3)值(以甲醇替DPPH溶液)及空白对照组吸光度(A2)值,每组设置3个复孔。测定样品对DPPH的清除率,计算公式为清除率=1-(A1-A3)/A2。
2.2.2 超氧阴离子清除率的检测 向96孔板中加入90 μL Tris-HCl缓冲液(50 mmol/L,pH值为8.2),分别加入不同质量浓度的样品溶液,25 ℃温育20 min。然后加入6 μL同样预热的邻苯三酚溶液(18 mmol/L)。5 min后加入2 μL盐酸溶液(10 mmol/L),每组设置3个复孔。测定325 nm处各样品的吸光度(A1)值,以蒸馏水替样品的A2和以蒸馏水替邻苯三酚的A3值。测定样品对超氧阴离子的清除率。计算公式为清除率=1-(A1-A3)/A2。
2.2.3 羟自由基清除率的检测 取系列质量浓度的样品溶液50 μL,加入6 mmol/L H2O2溶液、6 mmol/L硫酸亚铁溶液和10 mmol/L水杨酸-乙醇溶液各50 μL,37 ℃孵育10 min,测定510 nm处的吸光度(A1)值。以VC为阳性对照(A2),溶剂为空白对照(A3),每组试验设置3个复孔。测定样品对羟自由基的清除率,计算公式为清除率=1-(A1-A3)/A2。
2.2.4 统计学分析 组间差异采用Student’st检验,多重检验校正采用错误发现率(false discovery rate,FDR),Post-hoc检验方法选择Turkey-kramer,sumrank test(非参数因子克鲁斯卡尔-沃利斯秩和检验)方法,找到显著性差异类群,P<0.05表示差异具有统计学意义。
2.2.5 伴侣剂对HJD体外抗氧化的影响 结果如表1所示,伴侣剂对HJD体外清除DPPH自由基、羟自由基和超氧阴离子无显著性影响,HJD体外抗氧化作用具有剂量相关性。
表1 伴侣剂对HJD体外抗氧化的影响结果 ( , n = 3)Table 1 Effect of companion on antioxidation of HJD in vitro ( , n = 3)

表1 伴侣剂对HJD体外抗氧化的影响结果 ( , n = 3)Table 1 Effect of companion on antioxidation of HJD in vitro ( , n = 3)
与高剂量组比较:*P<0.05 **P<0.01;与中剂量组比较:##P<0.01*P < 0.05 **P < 0.01 vs high dose group; ##P < 0.01 vs medium dose group
样品 DPPH清除率/% 羟自由基清除率/% 超氧阴离子清除率/%2 mg·mL−1 1 mg·mL−1 0.5 mg·mL−1 2 mg·mL−1 1 mg·mL−1 0.5 mg·mL−1 2 mg·mL−1 1 mg·mL−1 0.5 mg·mL−1 HJD 24.3±0.9 25.7±0.5 24.3±2.8 2.7±0.3 1.6±0.5** 1.3±0.1**## 0.3±0.0 0.3±0.0 0.2±0.0**##HJD+伴侣剂 28.3±0.2 26.0±0.6 22.8±1.9** 1.8±0.1 1.2±0.0 1.0±0.1* 0.3±0.0 0.2±0.0 0.2±0.0
2.3 伴侣剂对HJD抗二甲苯致小鼠耳肿胀的影响
昆明小鼠,随机分为模型组、醋酸泼尼松组(阳性药,9.1 mg/kg),HJD与HJD+伴侣剂高、中、低剂量组(4.505、2.252、1.126 g/kg)。ig给药,每天1次,连续7 d。造模前12 h内禁食不禁水,最后一次给药40 min后,在小鼠左耳廓正、反两面涂抹二甲苯20 μL,使其致炎,右耳作为空白对照。并用打孔器分别在两耳的同一部位取下耳片(直径5.5 mm),称定质量,计算小鼠耳肿胀度和肿胀率。
肿胀度=左耳质量-右耳质量
肿胀率=(左耳质量-右耳质量)/左耳质量
结果见表2。阳性对照(泼尼松)组小鼠耳肿胀度/率显著低于模型;高剂量组抑苦掩味前后的HJD均能显著抑制二甲苯所致小鼠耳肿胀率,且与阳性组无显著性差异;高剂量组抑制耳肿胀率的效果明显优于低剂量组。最重要的是,抑苦掩味前后的HJD疗效无显著差异,表明伴侣剂对HJD抑制二甲苯致耳肿胀的效果无显著性影响。
表2 伴侣剂对HJD抑制二甲苯致小鼠耳肿胀的影响( , n = 7)Table 2 Effect of companion on inhibition of xyleneinduced ear edema of HJD in mice ( , n = 7)

表2 伴侣剂对HJD抑制二甲苯致小鼠耳肿胀的影响( , n = 7)Table 2 Effect of companion on inhibition of xyleneinduced ear edema of HJD in mice ( , n = 7)
与模型组比较:*P<0.05 **P<0.01;与泼尼松组比较:△△P<0.01;与HJD中剂量组比较:#P<0.05*P < 0.05 **P < 0.01 vs model group; △△P < 0.01 vs prednisone group; #P < 0.05 vs medium dose of HJD
组别 剂量/(g·kg−1) 肿胀度/mg 肿胀率/%模型 − 2.8±0.7 45.2±12.4泼尼松 0.009 1 1.5±0.6 19.9±9.5**HJD 4.505 2.4±0.5 23.1±12.7**2.252 2.3±0.3 27.4±9.1*1.126 3.2±0.5 44.2±11.7△△**#HJD+伴侣剂 4.505 2.3±0.4 28.0±9.7*2.252 2.3±0.5 40.0±12.1△△1.126 2.6±0.4 40.6±10.7△△*
2.4 伴侣剂对HJD抗LPS致小鼠高热的影响
2.4.1 LPS注射液的制备 临用前以氯化钠注射液将脂多糖配成20.0 mg/L溶液。
2.4.2 造模与给药 每日测量小鼠肛温2次,连续3 d。实验前连续测定3次肛温,每次间隔60 min,取平均值为基础体温(T0)。剔除单次体温超过38 ℃或2次温差超过0.5 ℃的小鼠。将符合要求的小鼠随机分为5组,即对照组、模型组、阳性药物组、HJD组和HJD+伴侣剂组。对照组和模型组ig给予蒸馏水,HJD组和HJD+伴侣剂组分别ig给予4.5 g/kg HJD和HJD+伴侣剂。给药1 h后对照组ip氯化钠注射液,其他各组ip LPS(20 μg/kg)造模致热。造模10 min后开始测体温(Ti),并分别于30、60、90、120、180 min时间点监测体温。计算ΔT(ΔT=Ti-T0),绘制体温变化ΔT-时间(t)曲线。实验结束后断颈处死小鼠。
2.4.3 伴侣剂对HJD抗LPS致小鼠高热的影响伴侣剂对HJD抗LPS致小鼠发热的影响结果见图1。与对照组相比,模型组小鼠的肛温在造模10~60 min后显著升高(P<0.05);此后温度显著下降(P<0.05)。与模型组相比,各给药组均表现出不同程度的解热作用。造模30 min后,HJD组和HJD+伴侣剂组小鼠体温均有显著性差异(P<0.05),各给药组间差异性不显著;造模60~90 min后,HJD组和HJD+伴侣剂组小鼠肛温显著低于模型组,且HJD+伴侣剂组的解热效果略优于HJD组,但差异不显著。并且,模型组小鼠肛温在造模60 min后下降显著,120 min后趋于稳定;给药组则在造模120 min后呈上升趋势,且HJD组和阳性组温度趋同于模型组,可能与小鼠机体的自愈功能有关。
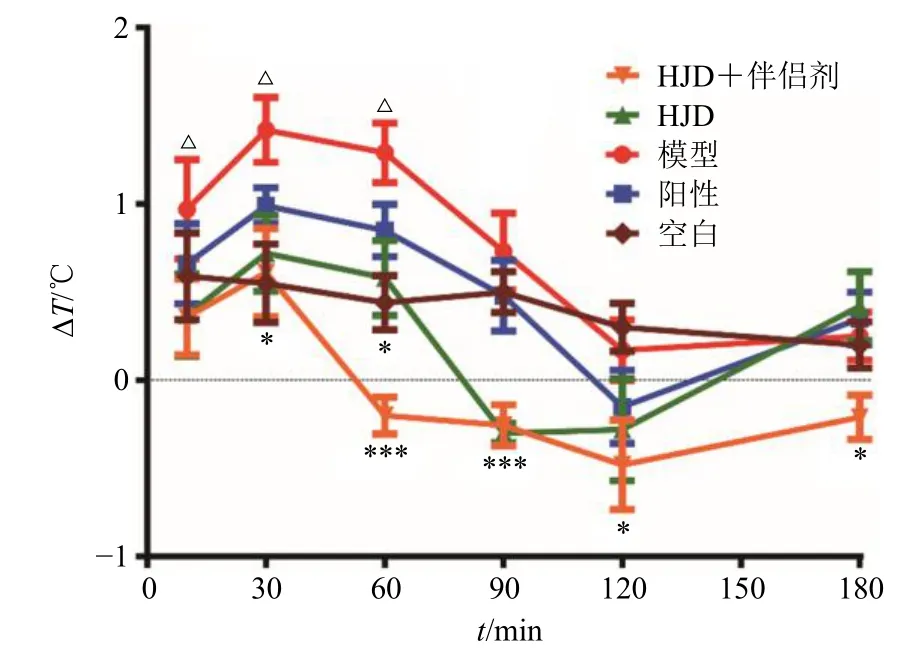
图1 伴侣剂对HJD抗LPS致小鼠发热的影响 ( , n =10)Fig.1 Effects of companion agent on anti-endotoxininduced fever in mice of HJD ( , n = 10)
2.5 伴侣剂对HJD急性毒性的影响研究
昆明小鼠,适应性饲养7 d后,随机分为HJD高剂量组(37.5 g/kg)、HJD低剂量组(25 g/kg)[15]、HJD+伴侣剂高剂量组、HJD+伴侣剂低剂量组和对照组(蒸馏水)并ig基于相应药物。给药前12 h禁食不禁水,观察7 d,记录受试动物的中毒症状、行为和死亡情况,计算死亡率;第7天傍晚禁食不禁水,次日早上行眼眶取血,分离血清,测定血糖、尿素氮、肌酐和白蛋白指标,评估HJD和抑苦掩味伴侣剂对小鼠胰腺、肾脏和肝脏功能的影响。
试验期间,每天观察小鼠行为活动3次,各实验组小鼠均无死亡,活动正常,行为活跃,无躁动、过度兴奋、精神萎靡和步态异常或者腺体分泌异常等情况,毛发整洁有光泽、无毛发脱落现象,粪便的颜色、形状和硬度均正常。据健康小鼠血液生化指标[16]判定急性毒性试验中的小鼠器官损害情况,结果见表3。各组的白蛋白、尿酸氮、肌酐、血糖均在正常值范围内:白蛋白(28.70±3.00)g/L、尿酸氮(3.46±0.98)mmol/L、肌酐(74.27±16.80)µmol/L、血糖(5.12±0.06)mmol/L,HJD和抑苦掩味伴侣剂对小鼠的胰腺、肾脏和肝脏等器官功能无明显损害。
表3 伴侣剂对HJD急性毒性的影响 ( , n = 10)Table 3 Effect of companion on acute toxicity of HJD ( , n = 10)
组别 剂量/(g·kg−1) 白蛋白/(g·L−1) 尿素氮/(mmol·L−1) 肌酐/(μmol·L−1) 血糖/(mmol·L−1)对照 − 28.44±3.06 3.70±0.91 83.41±12.27 5.21±0.56 HJD 37.5 29.44±2.74 3.68±0.75 74.39±9.01 5.13±0.05 25.0 29.99±0.81 3.53±0.69 87.74±10.28 5.13±0.17 HJD+伴侣剂 37.5 28.28±2.11 3.82±0.23 89.70±5.72 5.36±0.28 25.0 30.00±2.66 3.97±0.41 72.71±8.35 5.34±0.19
2.6 16S rDNA测序分析伴侣剂和HJD对小鼠肠道菌群的影响
2.6.1 标本收集 清洁级昆明小鼠,随机分为对照组、双抗组(链霉素1 g/kg+青霉素1 g/kg),HJD组(4.5 g/kg)与HJD+伴侣剂组(4.5 g/kg)。ig给药,每天1次,连续14 d。无菌条件下取小鼠粪便,−80 ℃保存,干冰送样,进行16S rDNA Amplicon测序。
2.6.2 测序 样品经抽提基因组的DNA并质检,设计、合成16S rDNA扩增的V3-V4通用引物区的特异性引物[341 F:forward primer(5’-3’):CCTA CGGGRSGCAGCAG和806 R:reverse primer(5’-3’):GGACTACVVGGGTATCTAATC],扩增PCR、纯化产物并进行文库质检,对质检合格的文库进行Qubit定量,最后使用Illumina Miseq PE250进行测序。测序结果按照以下流程进行生物信息分析。对原始数据执行质量控制(quailty control,QC)后,采用Usearch v11软件对合格的数据进行去嵌合体和聚类分析。得到物种丰度表,以进行后续组间和组内物种多样性、物种线性判别(linear discriminant analysis effect size,LEfSe)分析。
2.6.3 伴侣剂和HJD对小鼠肠道菌群多样性的影响 α多样性分析辛普森指数,结果表明,与对照组、HJD组、HJD+伴侣剂组相比,双抗组有所升高,但无显著性差异(图2-A)。香农指数结果表明,与对照组、HJD组和HJD+伴侣剂组相比,双抗组指数显著下降(P<0.001,图2-B)。同时,Anosim相似性分析结果表明,组间差异显著大于组内差异(图2-C),即双抗显著降低了小鼠的肠道菌群多样性,而HJD对菌群多样性的影响不显著,抑苦掩味后菌群多样性与HJD组、对照组差异亦不显著。

图2 伴侣剂和HJD对小鼠肠道菌群多样性的影响 ( ,n = 6)Fig.2 Effects of companion and HJD on intestinal flora diversity in mice ( , n = 6)
2.6.4 伴侣剂和HJD对小鼠肠道菌群丰度的影响在门水平上,各样本中丰度最高菌为拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)(表4)。且厚壁菌门/拟杆菌门比值(F to B ratio)和变形菌门/拟杆菌门比值(P to B ratio)无显著性差异。
表4 伴侣剂和HJD对小鼠肠道菌群丰度的影响 ( , n = 6)Table 4 Effect of companion and HJD on intestinal flora abundance in mice ( , n = 6)
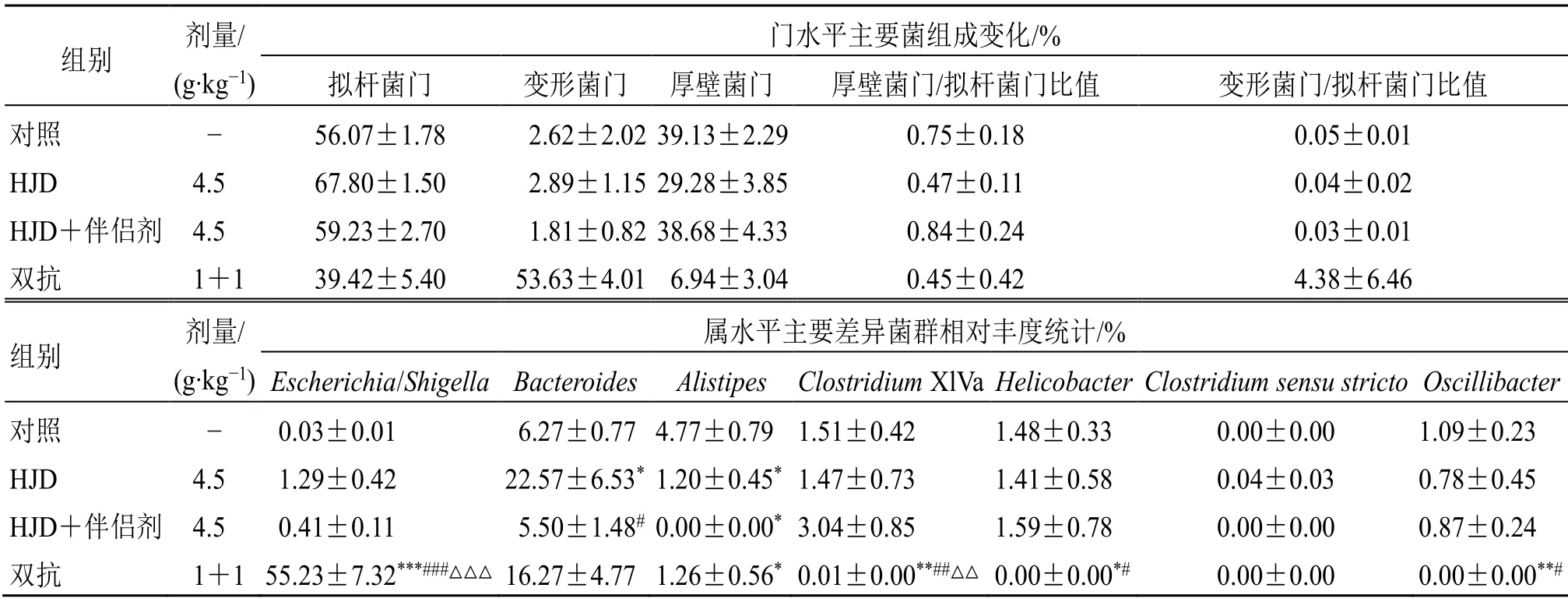
表4 伴侣剂和HJD对小鼠肠道菌群丰度的影响 ( , n = 6)Table 4 Effect of companion and HJD on intestinal flora abundance in mice ( , n = 6)
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与HJD组比较:#P<0.05 ##P<0.01 ###P<0.001;与HJD+伴侣剂组比较:△△P<0.01 △△△P<0.001*P < 0.05 **P < 0.01 ***P<0.001 vs blank group; #P < 0.05 ##P < 0.01 ###P < 0.001 vs HJD group; △△P < 0.01 △△△P < 0.001 vs HJD + taste-suppressing companion group
组别 剂量/(g·kg−1)门水平主要菌组成变化/%拟杆菌门 变形菌门 厚壁菌门 厚壁菌门/拟杆菌门比值 变形菌门/拟杆菌门比值对照 − 56.07±1.78 2.62±2.02 39.13±2.29 0.75±0.18 0.05±0.01 HJD 4.5 67.80±1.50 2.89±1.15 29.28±3.85 0.47±0.11 0.04±0.02 HJD+伴侣剂 4.5 59.23±2.70 1.81±0.82 38.68±4.33 0.84±0.24 0.03±0.01双抗 1+1 39.42±5.40 53.63±4.01 6.94±3.04 0.45±0.42 4.38±6.46组别 剂量/(g·kg−1)属水平主要差异菌群相对丰度统计/%Escherichia/Shigella Bacteroides Alistipes Clostridium XlVa Helicobacter Clostridium sensu stricto Oscillibacter对照 − 0.03±0.01 6.27±0.77 4.77±0.79 1.51±0.42 1.48±0.33 0.00±0.00 1.09±0.23 HJD 4.5 1.29±0.42 22.57±6.53* 1.20±0.45* 1.47±0.73 1.41±0.58 0.04±0.03 0.78±0.45 HJD+伴侣剂 4.5 0.41±0.11 5.50±1.48# 0.00±0.00* 3.04±0.85 1.59±0.78 0.00±0.00 0.87±0.24双抗 1+1 55.23±7.32***###△△△ 16.27±4.77 1.26±0.56* 0.01±0.00**##△△ 0.00±0.00*# 0.00±0.00 0.00±0.00**#
在属水平检测对照组与双抗组、HJD组,对照组与HJD组、HJD+伴侣剂组的菌群结构。与双抗组相比,对照组和HJD组埃希菌(Escherichia/Shigella)的相对丰度显著降低(P<0.001),另枝菌属(Alistipes)、梭菌XIVa(Clostridium XlVa)、螺杆菌属(Helicobacter)、厌氧芽孢杆菌(Clostridiumsensu stricto)相对丰度显著升高(P<0.05);与HJD组相比,HJD+伴侣剂组的Bacteroides显著降低(P<0.05),其他菌属变化不显著。
应用LEfSe分析软件判别伴侣剂对HJD多级物种差异的影响,结果表明,抑苦掩味伴侣剂对HJD给药干预1周的小鼠肠道菌群影响不显著。从门水平到属水平,在LEfSe层级树中标注共同差异基因(图3),抑苦掩味伴侣剂组目水平优势菌种为脱硫弧菌(Desulfovibrionales)。
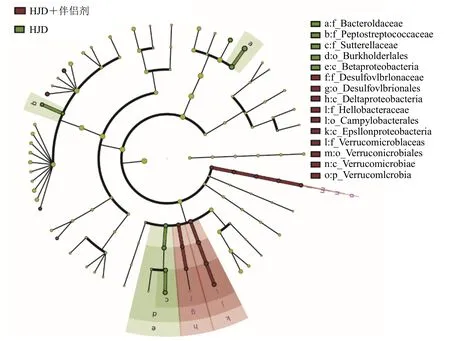
图3 LEfSe多级物种层级树图Fig.3 LEfSe multilevel species hierarchy tree
3 讨论
抑苦掩味伴侣剂能有效改善[13]中药汤剂如HJD的口感,其应用有利于提高中医临床患者服药顺应性。然而,作为辅料,在抑苦掩味的同时,必须以不影响药物疗效、安全性和主要有效成分的含量测定为前提。本课题组前期研究表明,抑苦掩味伴侣剂不影响HJD的指纹图谱和主要有效成分的含量测定。本研究表明,伴侣剂未显著影响HJD体外抗氧化、抗耳肿胀、解热、急性毒性和对肠道菌群的作用。LPS、干酵母和2,4-二硝基酚(DNP)等是发热模型常用致热原[17]。其中,LPS致热模型为最经典的炎性发热模型。研究发现,HJD对LPS致小鼠高热模型具有良好的解热作用。在ip内毒素60 min后,模型组小鼠肛温逐渐下降,甚至低于基础体温,这可能是机体自我保护作用的结果。
肠道菌群的物种多样性和丰富度是反映肠道菌群组成的重要指标[18]。本研究发现,青霉素与链霉素合用(双抗)显著降低了小鼠肠道菌群的种类和丰度,而HJD及其抑苦掩味伴侣剂对其影响不显著。小鼠肠道菌群90%由厚壁菌门、拟杆菌门、变形菌门和放线菌门组成,厚壁菌门/拟杆菌门比值和变形菌门/拟杆菌门比值可有效反应肠道菌群的紊乱情况[19]。本研究表明,双抗、HJD及其伴侣剂对厚壁菌门/拟杆菌门比值和变形菌门/拟杆菌门比值影响不显著。
拟杆菌属Bacteroides是肠道菌群的主要组成,参与机体多糖、胆汁酸和类固醇代谢、碳水化合物发酵以及维持肠道正常生理等多种功能[20],为宿主提供能源[21]。与HJD组样品相比,伴侣剂显著降低了小鼠肠道中拟杆菌的丰度(P<0.05)。脱硫弧菌(Desulfovibrionales)是一种硫酸盐还原厌氧菌,广泛存在于各种环境中,很少引起人类感染[22]。与HJD组样品相比,它是伴侣剂组中的优势菌属。综上,抑苦掩味伴侣剂不影响HJD的药效(抗炎、抗氧化和解热)、毒性和对肠道菌群的作用,安全有效。
利益冲突所有作者均声明不存在利益冲突