结直肠癌患者血清微小RNA-107和微小RNA-34a的表达情况及其诊断结直肠癌的价值▲
苏 宏 何远山 冯 霖 黄用豪
(1 青海省第五人民医院普通外科,西宁市 810000,电子邮箱:liu520bing@aliyun.com;2 海南医学院临床学院,海口市 571199)
结直肠癌是人类常见的恶性肿瘤之一,具有较高的病死率[1]。2019年全国癌症中心统计数据显示,2015年我国结直肠癌发病率在全部恶性肿瘤中位居第3位,病死率位居第5位[2],这表明结直肠癌的防治形势严峻,而早诊断、早治疗的患者的5年生存率可达90%[3]。目前,结直肠癌的早期诊断方法分为侵入性检查和非侵入性检查。非侵入性检查包括粪便检查、血液检查及放射检查,例如粪便潜血试验和肿瘤标志物检测,但这两种方法的检测敏感性和特异性均较差[4]。侵入性检查包括内窥镜检查等,可直接观察结直肠病变,并获得病理标本[5]。在许多国家(包括美国、德国、波兰、奥地利和意大利),内窥镜检查是结直肠癌筛查的主要方法[5]。但由于内窥镜很难在形态学上对病灶异型程度和是否发生浸润作出判断,因此内窥镜诊断早期癌的准确性受到影响[6]。微小RNA是一类小的单链非编码RNA,在多种生物学过程(包括细胞增殖、凋亡和器官发育)中发挥重要作用,可以用作人类疾病诊断和预后评估的重要工具[7]。目前,已发现多种微小RNA(例如微小RNA-21和微小RNA-92a)可作为结直肠癌的诊断标志物[8]。此外,有研究表明,微小RNA-107(microRNA-107,miR-107)和微小RNA-34a(microRNA-34a,miR-34a)可影响结直肠癌的发生和发展[9-10]。本研究探讨结直肠癌患者血清miR-107和miR-34a的表达情况及二者诊断结直肠癌的价值,以期为结直肠癌的早期诊断提供参考。
1 资料与方法
1.1 临床资料 选取2016年1月至2018年12月青海省第五人民医院收治的50例结直肠癌患者为结直肠癌组,50例健康人群为对照组。纳入标准:(1)结直肠癌患者均接受结直肠内窥镜活检,且经病理确诊;(2)参照第8版美国癌症联合委员会癌症分期手册[11],结直肠癌为Ⅰ~Ⅳ期;(3)未接受其他手术治疗或放化疗;(4)病例资料记录完整。排除标准:(1)伴有严重并发症;(2)病例资料记录缺失。结直肠癌组中男性27例、女性23例,年龄32~80(51.14±6.18)岁;肿瘤呈高分化15例,中分化24例,低分化11例;TNM分期Ⅰ期3例,Ⅱ期14例,Ⅲ期21例,Ⅳ期12例;有淋巴结转移31例,无淋巴结转移19例。对照组中男性29例、女性21例,年龄30~75(50.97±3.28)岁。两组研究对象的性别、年龄差异均无统计学意义(均P>0.05)。本研究获青海省第五人民医院医学伦理委员会批准,患者均对本研究知情同意并签署知情同意书。
1.2 微小RNA检测方法
1.2.1 主要仪器与试剂:超微量紫外分光光度计(型号:DS11)购自美国DeNovix公司;荧光定量PCR仪(型号:CFX96)和普通PCR仪(型号:C1000)均购自美国Bio-Rad公司;血清miRNA提取试剂盒(Lot#O3330)、miRcute增强型miRNA cDNA第一链合成试剂盒(KR211,Lot#T9998)、miRcute miRNA荧光定量检测试剂盒(FP411,产品编号:4992887)均购自天根生化科技(北京)有限公司;所有引物均由北京六合华大基因科技有限公司合成。
1.2.2 血清标本的制备:抽取所有受试者清晨空腹状态下的外周静脉血5 mL,室温静置30 min后,在4℃条件下,3 000 r/min离心10 min,取上层血清,置于-80℃冰箱中保存备用。
1.2.3 总RNA的提取与反转录:使用血清微小RNA提取试剂盒提取血清中的总RNA,使用超微量紫外分光光度计检测RNA的浓度和纯度,A260/280值在1.8~2.2之间为合格。使用miRcute增强型miRNA cDNA第一链合成试剂盒将样本总RNA反转录成单链cDNA。上述操作均严格按照试剂说明书进行。
1.2.4 血清miR-107、miR-34a相对表达水平的检测:使用miRcute miRNA荧光定量检测试剂盒,以U6作为内参基因,检测血清miR-107、miR-34a的相对表达水平。miR-107上游引物(5′-3′)为ACACTCCAGCTGGGAGCAGCATTGТACAG,下游引物(5′-3′)为CTCAACTGGTGTCGTGGA;miR-34a上游引物(5′-3′)为GGCAGTGTCTTAGCTGGTTG,下游引物(5′-3′)为GCGAGCACAGAATTAATACGAC;内参基因U6上游引物(5′-3′)为CTCGCTTCGGCAGCACATATACT,下游引物(5′-3′)为CGAATTTGCGTGTCATССTTGCG。荧光定量反应体系共20 μL,包括10 μL 2×miRcute miRNA Premix,1.6 μL 50×ROX参比染料,0.5 μL 10 μmol/L的正向引物,0.5 μL 10 μmol/L的反向引物,1.5 μL cDNA,5.9 μL ddH2O。反应条件为94 ℃ 2 min;94 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。每个样品设置3个复孔,并重复3次平行实验,最终取平均值进行计算。采用2-ΔΔCt法计算miR-107和miR-34a基因的相对表达量,其中ΔCt=Ct目的基因-CtU6,ΔΔCt=ΔCt结直肠癌组-ΔCt对照组。
1.3 统计学分析 采用SPSS 24.0软件进行统计分析。符合正态分布的计量资料以(x±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以[M(P25,P75)]表示,组间比较采用Kruskal-WallisH检验或Mann-Whitneyu检验。采用Spearman秩相关检验分析结直肠癌患者的血清微小RNA相对表达水平与临床病理特征的相关性。绘制受试者工作特征(receiver operating characteristic,ROC)曲线评估血清miR-107和miR-34a单独诊断及二者联合诊断结直肠癌的效能。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清miR-107和miR-34a的表达情况 结直肠癌组、对照组血清中miR-107的相对表达量分别为(13.65±4.26)、(5.82±1.96),miR-34a的相对表达量分别为(1.98±0.49)、(16.70±4.29)。其中,结直肠癌组miR-107的相对表达量高于对照组(t=11.807,P<0.001),miR-34a的相对表达量低于对照组(t=24.106,P<0.001)。
2.2 不同临床病理特征结直肠癌患者miR-107和miR-34a的表达情况 Ⅰ期结直肠癌患者的血清miR-107相对表达量低于Ⅳ期患者,而血清miR-34a相对表达量高于Ⅳ期患者(均P<0.05);高分化结直肠癌患者的血清miR-34a相对表达量高于低分化患者(P<0.05);有淋巴结转移的结直肠癌患者的血清miR-34a相对表达量低于无淋巴结转移患者(P<0.05)。见表1。

表1 不同临床病理特征结直肠癌患者miR-107和miR-34a相对表达量的比较[M(P25,P75)]
进一步行相关性分析,结果显示结直肠癌患者的血清miR-107相对表达量与TNM分期呈正相关,血清miR-34a相对表达量与分化程度呈正相关,与TNM分期和淋巴结转移情况呈负相关(均P<0.05)。见表2。
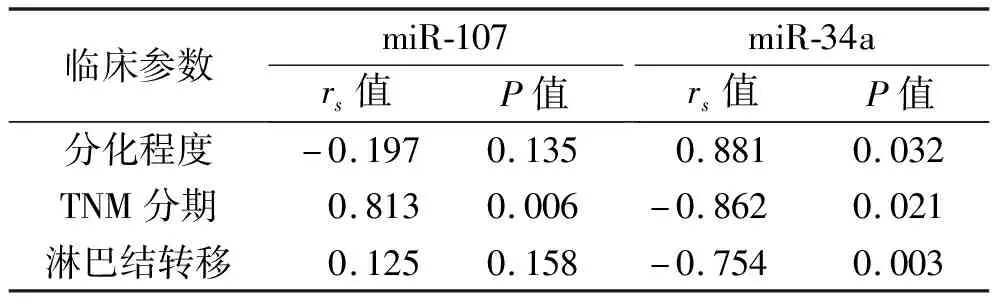
表2 结直肠癌患者血清miR-107和miR-34a相对表达量与临床病理特征的相关性
2.3 ROC曲线分析结果 以病理诊断结果为金标准,采用ROC曲线分析血清miR-107和miR-34a相对表达量对结直肠癌的诊断效能。结果显示,miR-107相对表达量诊断结直肠癌的曲线下面积为0.849(95%CI:0.793~0.905,P<0.001),诊断灵敏度和特异度分别为83.7%和81.5%;miR-34a相对表达量诊断结直肠癌的曲线下面积为0.959(95%CI:0.932~0.986,P<0.001),诊断灵敏度和特异度分别为92.9%和91.3%;二者联合诊断结直肠癌的曲线下面积为0.983(95%CI:0.977~0.991,P<0.001),诊断灵敏度和特异度分别为98.7%和97.4%。见图1。
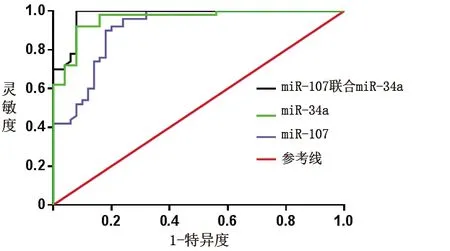
图1 血清miR-107、miR-34a相对表达量单独及联合诊断结直肠癌的ROC曲线
3 讨 论
结直肠癌是临床常见的恶性肿瘤,患者的病死率较高。微小RNA在结直肠癌中具有抑癌或致癌作用,因此,微小RNA对结直肠癌具有一定的诊断价值[12]。相关研究表明,miR-107对结直肠癌的发生和发展具有重要作用[13-14]。例如,Chen等[13]报告,在结直肠癌细胞模型中,miR-103/107通过靶向转移抑制因子死亡相关蛋白激酶(death-associated protein kinase,DAPK)和Kruppel 样因子4(Kruppel-like factor 4,KLF4)来促进结直肠癌细胞转移;此外,miR-103/107高表达、DAPK和KLF4低表达与结直肠癌患者淋巴结转移和远处转移相关。Molina-Pinelo等[14]报告,miR-107可评估结直肠癌患者对氟尿嘧啶标准化疗的反应。此外,miR-34a也与结直肠癌的发生和发展密切相关。miR-34家族由miR-34a、miR-34b和miR-34c组成,其参与细胞周期和细胞凋亡过程,具有抑制肿瘤的特性[15]。miR-34a可通过靶向原癌基因Fra-1抑制结肠癌细胞的迁移和侵袭;结肠癌组织中缺乏miR-34a也会导致P53突变和缺乏,从而加速癌症的发展[16]。因此,本研究探讨miR-107和miR-34a在结直肠癌患者血清中的表达及其诊断结直肠癌的价值。
Liu等[17]的研究表明,miR-107在结直肠癌的癌组织和细胞株中均呈高表达。另外,邹德胜等[18]报告,结直肠癌患者血清miR-107的表达量高于正常人群,miR-107的表达量与结直肠癌患者的TNM分期有关。本研究中,结直肠癌患者血清miR-107的相对表达量高于正常人群,且血清miR-107的相对表达量与结直肠癌患者的TNM分期呈正相关(均P<0.05),这与邹德胜等[18]的研究结果相似。这表明miR-107与直肠癌的发生和发展相关。另外,张肖丽等[19]发现,除了TNM分期,miR-107的表达量还与结直肠癌患者的肿瘤分化程度、淋巴结转移有关。但本研究中,结直肠癌患者的血清miR-107的相对表达量与肿瘤分化程度、淋巴结转移并无相关性(均P>0.05),这可能与本研究收集的结直肠癌样本肿瘤分化程度及淋巴结转移的占比与上述研究不同有关。
Badr等[20]报告,与健康对照者相比,结直肠癌患者miR-34a的表达量显著降低,且TNM分期Ⅰ期结直肠癌患者miR-34a的表达量最高,Ⅲ期结直肠癌患者miR-34a的表达量最低。Ma等[10]也报告,与健康对照者相比,结直肠癌患者miR-34a的表达量显著降低。这些研究均表明,miR-34a基因也与结直肠癌的发生密切相关。本研究中,结直肠癌患者血清miR-34a的相对表达量低于正常人群,且miR-34a 相对表达量与结直肠癌患者的TNM分期、分化程度和淋巴结转移均相关(均P<0.05),这与雒亚蒙等[21]的研究结果相似。以上研究结果提示,miR-34a低表达不仅与结直肠癌的发生有关,还能反映肿瘤的进展情况。
目前,还没有公认的诊断结直肠癌灵敏度和特异度均较高的微小RNA,因此,多个标志物的联合检测对疾病的诊断有更大的参考价值。本研究的ROC曲线分析结果显示,血清miR-107和miR-34a相对表达量诊断结直肠癌的曲线下面积分别为0.849、0.959,灵敏度分别为83.7%、92.9%,特异度分别为81.5%、91.3%,提示两者对结直肠癌具有较好的诊断效能;而二者联合诊断时,ROC曲线下面积可达0.983,诊断灵敏度和特异度可提高至98.7%和97.4%,提示联合检测血清miR-107和miR-34a的相对表达量,可进一步提高对结直肠癌的诊断效能。此外,血清微小RNA的检测不具有创伤性,有利于重复检测,可用于疾病的监控和评估。
综上所述,结直肠癌患者血清中miR-107的表达上调,而miR-34a的表达下调,二者均可反映肿瘤的进展情况且均可用于结直肠癌的辅助诊断,二者联合应用时的诊断效能更高。

