行维持性血液透析的尿毒症患者发生血管钙化与外周血微小RNA-21、微小RNA-155-5p表达的关系▲
纪伟超 刘 杰 王晓静
(河北省以岭医院肾病科,石家庄市 050051,电子邮箱:jiweichao2244@163.com)
尿毒症是慢性肾功能衰竭的终末阶段,维持性血液透析(maintenance hemodialysis,MHD)是目前治疗尿毒症的手段之一,可有效延长患者生命[1]。研究表明,MHD治疗虽有效,但并发症发生率高,其中血管钙化是MHD患者最常见的并发症[2]。血管钙化与尿毒症所致心血管并发症的关系较为密切,可影响患者的生存质量和长期生存率[3]。微小RNA是一类长度为21~25个核苷酸的非编码RNA,在转录后水平参与调节机体的生物学功能,在细胞增殖和分化、炎性反应、纤维化等过程中发挥着重要作用。有学者发现,miR-21与miR-155-5p在肾脏疾病中发挥着重要作用,尤其是miR-21参与了急性肾损伤、肾脏纤维化、肾脏肿瘤等疾病的发展[4]。行血液透析的尿毒症患者体内存在调节性T淋巴细胞(regulatory T lymphocyte,Treg)/辅助性T淋巴细胞17(helper T lymphocyte 17,Th17)失衡,这可导致血管钙化的发生或加剧[5]。而有研究表明,miR-21与miR-155-5p在调节Treg/Th17平衡中发挥着重要作用:促炎症消退介质Maresin 1可通过miR-21改善类风湿关节炎患者的Treg/Th17失衡[6];慢性牙周炎患者外泌体中的miR-155-5p可通过组蛋白去乙酰化酶调节Treg/Th17平衡[7]。因此,我们认为miR-21、miR-155-5p也许能通过调节Treg/Th17平衡从而改善行MHD的尿毒症患者的血管钙化情况。但目前未发现有关miR-21、miR-155-5p在行MHD的尿毒症患者外周血中的表达情况及其与血管钙化之间关系的研究。为此,本研究采用实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR)法检测行MHD的尿毒症患者外周血miR-21、miR-155-5p的表达情况,并探讨二者与血管钙化的关系。
1 资料与方法
1.1 临床资料 选择2018年1月至2019年12月在我院血液净化中心行MHD的100例尿毒症患者,其中男性68例、女性32例,年龄28~75(57.60±9.40)岁,透析龄8~42(28.30±12.50)个月。纳入标准:(1)符合尿毒症的诊断标准[8];(2)临床资料完整;(3)均对本研究知情同意并签署知情同意书。排除标准:(1)伴有急慢性感染、恶性肿瘤或者处于自体免疫性疾病活动期者;(2)近期使用糖皮质激素或免疫抑制剂治疗者;(3)发生心脏瓣膜钙化者;(4)存在严重低白蛋白血症(血清白蛋白<30 g/L)、贫血(血红蛋白≤59 g/L)者。通过腹部侧位X 线片评估所有患者的血管钙化情况,根据腹主动脉钙化评分(abdominal aortic calcification score,AACS)[9],将患者分为无血管钙化组(AACS=0分)43例和血管钙化组(AACS≥1分)57例。本研究已通过我院医学伦理委员会审批。
1.2 主要试剂与仪器 RNA提取试剂盒(批号:9112)、反转录试剂盒(批号:RR036A)、qRT-PCR试剂盒(批号:RR820A)均购自大连TaKaRa公司;miR-21、miR-155-5p引物由上海吉玛公司合成;CD25-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)单克隆抗体(批号:11-0250-41)、CD4-藻红蛋白(phycoerythrin,PE)单克隆抗体(批号:25-4714-80)、CD3-别藻蓝蛋白(allophycocyanin,APC)单克隆抗体(批号:47-0032-82)、PE-白细胞介素(interleukin,IL)-17单克隆抗体(批号:25-7179-41)、PE-叉头框蛋白P3(forkhead box protein P3,Foxp3)单克隆抗体(批号:12-5773-82)均购自美国eBioscience公司;Ficoll 淋巴细胞分离液(批号:LTS1077-1)购自天津市灏洋生物制品科技有限责任公司;CD4-多甲藻黄素-叶绿素-蛋白质(Peridinin-Chlorophyll-Protein, PerCP)复合物抗体购自Abcam公司(批号:ab210374);全段甲状旁腺激素(intact parathyroid hormone,iPTH)试剂盒(批号:E-EL-H6076)、转化生长因子(transforming growth factor,TGF)-β试剂盒(批号:E-EL-0162c)均购自Elabscience公司;IL-6(批号:ab178013)、IL-10(批号:ab185986)、IL-17(批号:ab119535)、骨形成蛋白2(bone morphogenetic protein 2,BMP-2;批号:ab119581)、C反应蛋白(C-reactive protein,CRP;批号:ab260058)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α;批号:ab181421)试剂盒均购自美国Abcam公司。ABI7500型荧光定量PCR仪购自美国ABI公司,FACSCalibur型流式细胞仪购自美国BD公司,7600型自动生化仪购自日立公司。
1.3 研究方法
1.3.1 样品采集及保存:采集患者透析前空腹静脉血12 mL,其中5 mL室温静置20 min,2 000 r/min离心15 min后收集血清,于-80℃环境中保存,用于检测血清中白蛋白、磷、钙、iPTH、IL-6、IL-10、IL-17、BMP-2、CRP、TNF-α水平。2 mL全血用于检测血红蛋白。将剩余5 mL血液置于抗凝管,用Ficoll 淋巴细胞分离液行密度梯度离心,分离得到外周血单个核细胞(peripheral blood mononuclear cell,PBMC),置于-80℃环境中保存,用于检测Treg、Th17。
1.3.2 qRT-PCR法检测外周血miR-21、miR-155-5p相对表达水平:采集患者透析前的空腹静脉血2 mL。根据RNA提取试剂盒说明书操作要求提取外周血RNA,用紫外分光光度计检测总RNA纯度,以A260/280值在1.8~2.0之间为纯度较好,以纯度较好的总RNA进行后续实验。使用反转录试剂盒进行反转录得到cDNA,使用qRT-PCR试剂盒检测外周血miR-21、miR-155-5p相对表达水平。引物序列见表1。PCR的反应体系共25 μL,包括上下游引物各0.5 μL、cDNA 2 μL、SYBR Green Mix 8 μL,加双蒸水至25 μL。反应条件为95℃ 120 s,95℃ 60 s,65℃ 45 s,72℃ 30 s,共40个循环。每个样品设置3个复孔。用U6作为内参,采用2-ΔΔCt法计算外周血miR-21、miR-155-5p相对表达水平。
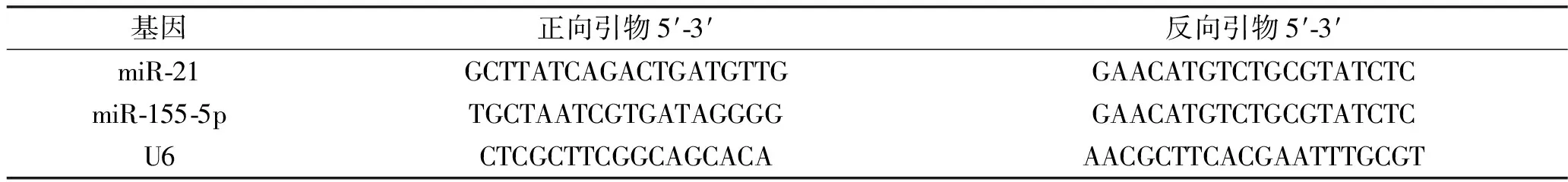
表1 qRT-PCR引物序列
1.3.3 流式细胞术检测Treg、Th17 水平:(1)检测PBMC中Treg水平。取200 μL的PBMC悬液,依次加入CD25-FITC、CD4-PerCP、PE-Foxp3单克隆抗体各10 μL,37℃避光孵30 min,磷酸缓冲盐溶液洗涤3次,室温下1 500 r/min离心10 min,再加入0.5 mL磷酸缓冲盐溶液重悬,使用流式细胞仪检测PBMC中Treg水平(即CD4+CD25+Foxp3+T淋巴细胞占CD4+T淋巴细胞的比例)。(2)检测PBMC中Th17水平。取200 μL的PBMC悬液,依次加入CD3-APC、CD4-PE、PE-IL-17单克隆抗体各10 μL,37℃避光孵20 min,磷酸缓冲盐溶液洗涤3次,室温下1 500 r/min离心10 min,再加入0.5 mL磷酸缓冲盐溶液重悬,使用流式细胞仪检测PBMC中Th17水平(即CD3+CD4+IL-17+T淋巴细胞占CD4+T淋巴细胞的比例)。
1.3.4 其他指标的检测:采用自动生化分析仪检测血清白蛋白水平,血细胞分析仪检测外周血血红蛋白水平,化学发光法检测血清钙、血清磷水平;采用ELISA检测血清iPTH、IL-6、IL-10、IL-17、BMP-2、CRP、TNF-α水平,按照相应试剂盒说明书进行操作。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。计数资料以例数和百分比表示,组间比较采用χ2检验;正态分布的计量资料以(x±s)表示,组间比较采用独立样本t检验;变量的相关性分析采用Pearson检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者基线资料、代谢和炎症指标的比较 两组患者年龄、性别、体质指数、透析龄、全血血红蛋白和血清白蛋白水平比较,差异均无统计学意义(均P>0.05),组间具有可比性。血管钙化组患者血清磷、钙、BMP-2、iPTH、CRP、TNF-α水平均高于无血管钙化组患者(均P<0.05)。见表2。
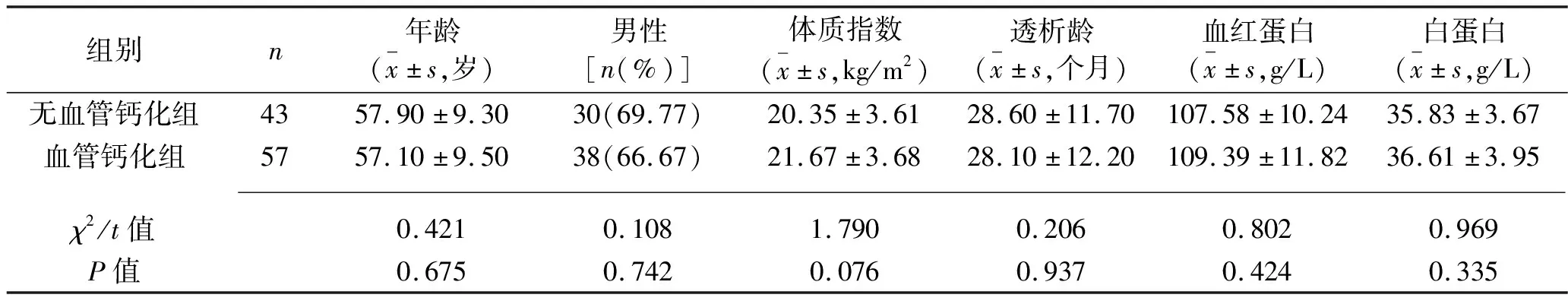
表2 两组患者基线资料、代谢和炎症指标的比较
2.2 两组患者PBMC中Treg、Th17水平和外周血miR-21、miR-155-5p相对表达水平的比较 血管钙化组患者PBMC中的Th17水平、Th17/Treg比值,以及外周血miR-155-5p相对表达水平均高于无血管钙化组,而PBMC中的Treg水平与外周血miR-21相对表达水平均低于无血管钙化组(均P<0.05),见表3。
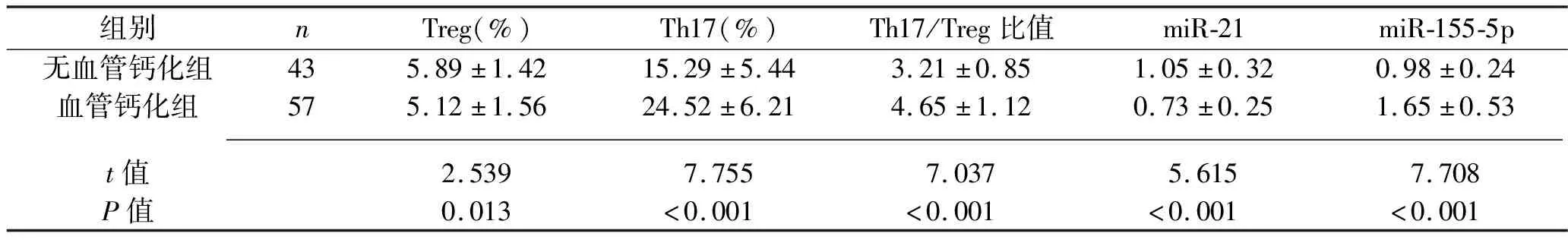
表3 两组患者Treg、Th17水平和miR-21、miR-155-5p相对表达水平的比较(x±s)
2.3 两组患者血清中Th17和Treg相关细胞因子水平的比较 血管钙化组患者血清IL-17、IL-6水平均高于无血管钙化组,血清IL-10、TGF-β水平均低于无血管钙化组(均P<0.05),见表4。
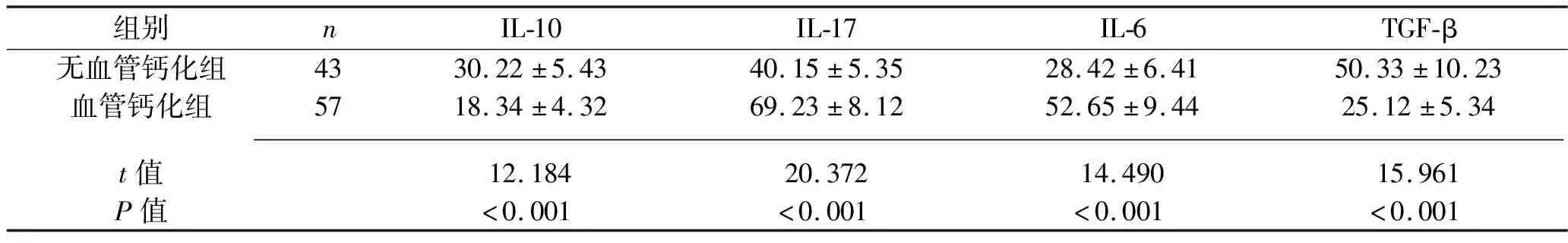
表4 两组患者血清Th17和Treg相关细胞因子水平的比较(x±s,ng/L)
2.4 AACS与miR-21、miR-155-5p及代谢指标的相关性 在行MHD的尿毒症患者中,AACS与外周血miR-155-5p 相对表达水平,以及血清磷、钙、BMP-2、iPTH水平均呈正相关,与外周血miR-21相对表达水平呈负相关(均P<0.05),见表5。
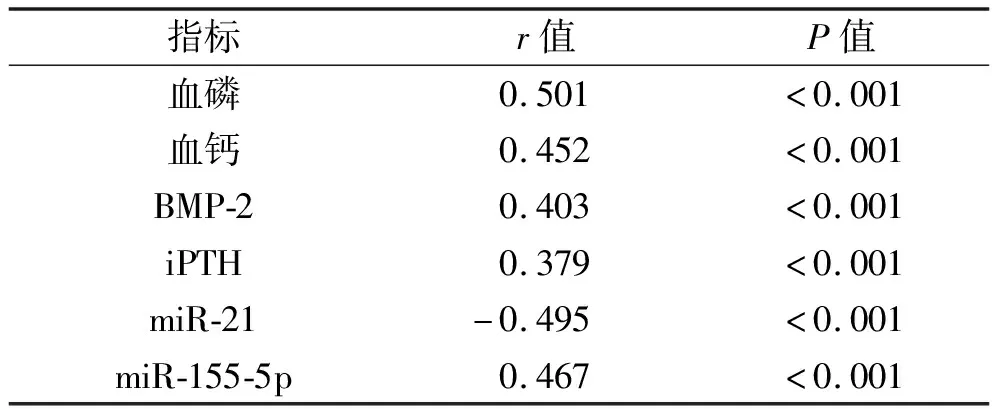
表5 AACS与miR-21、miR-155-5p及代谢指标的相关性
2.5 外周血miR-21、miR-155-5p相对表达水平与Th17/Treg比值的相关性 在行MHD的尿毒症患者中,外周血miR-21相对表达水平与Th17/Treg比值呈负相关(r=-0.505,P<0.05),外周血miR-155-5p相对表达水平与Th17/Treg比值呈正相关(r=0.523,P<0.05)。
3 讨 论
研究表明,尿毒症患者经MHD治疗后死亡率仍然很高,死亡原因主要是心血管相关并发症,而血管钙化是心血管病致死的重要病理变化,也是MHD患者死亡的独立危险因素[8,10]。血管钙化的发生机制复杂,可能与钙磷不平衡、软骨分化、血管弹性蛋白退化等有关[11]。BMP-2为血管钙化促动剂,iPTH是体内调节钙、磷代谢的肽类激素,本研究结果显示,血管钙化组患者血清磷、钙、BMP-2、iPTH水平均高于无血管钙化组患者(均P<0.05),说明在行MHD的尿毒症患者中,发生血管钙化者体内存在钙磷失衡,这与姜瑞丰等[12]报告的结果相似。相关性分析显示,AACS与血清磷、钙、BMP-2、iPTH水平均呈正相关(均P<0.05),表明血磷、血钙、BMP-2、iPTH水平与血管钙化密切相关。本研究还显示,血管钙化组患者的血清CRP、TNF-α水平均高于无血管钙化组患者(均P<0.05)。研究显示,行血液透析的尿毒症患者体内微炎症因子水平异常,与血管钙化有关[5]。由此可见发生血管钙化的患者机体的炎症反应较无血管钙化患者严重。
微小RNA能调节多数基因,miR-21、miR-155-5p在多种疾病中分别发挥抗炎和促炎作用,因此在炎症反应中均具有重要调节作用[13-14]。研究表明,过敏性紫癜患儿miR-21表达水平降低,对IL-10有调节作用[15];在脂多糖诱导的人肾皮质近曲小管上皮细胞炎症反应中,miR-21表达水平降低,过表达miR-21可减轻炎症反应[16]。而有学者发现,脓毒症心肌损伤患者血清miR-155-5p表达水平升高,miR-155-5p对脓毒症患者心肌损伤有一定的诊断价值[17];慢性肾脏病患者血浆miR-155-5p表达水平升高[18]。本研究结果显示,血管钙化组患者外周血miR-155-5p相对表达水平高于无血管钙化组患者,而外周血miR-21相对表达水平低于无血管钙化组患者;相关性分析显示,行MHD的尿毒症患者AACS与外周血miR-155-5p相对表达水平呈正相关,与外周血miR-21相对表达水平呈负相关(P<0.05)。以上结果提示miR-21、miR-155-5p与行MHD的尿毒症患者发生血管钙化有关,然而其作用机制尚不清楚。
Treg、Th17分别是较为重要的抗炎细胞、促炎细胞,前者分泌IL-10、TGF-β等抗炎因子并发挥抑制炎症、免疫调节的作用,后者主要通过分泌IL-17 等细胞因子以促进炎症反应与免疫反应的发生,Th17/Treg失衡可促进动脉粥样硬化及心血管事件的发生[19]。本研究结果显示,与无血管钙化组患者相比,血管钙化组患者PBMC中的Th17水平和Th17/Treg比值均升高,而PBMC中Treg水平降低,同时血清促炎细胞因子IL-17、IL-6水平升高,而血清抗炎细胞因子IL-10、TGF-β水平降低,这说明在行MHD的尿毒症患者中,发生血管钙化的患者存在Th17/Treg失衡,机体可能处于微炎状态。Zheng等[20]的研究表明,在胃癌切除患者中miR-21可通过程序性死亡受体-1/程序性死亡受体-1配体途径参与Th17/Treg细胞失衡的调节。唐桥斐等[21]研究发现,在变应性鼻炎小鼠模型中,miR-155-5p过表达可加重小鼠鼻炎症状,并促进Th17相关细胞因子的表达,抑制Treg相关细胞因子的表达;而沉默miR-155-5p表达后,小鼠鼻炎症状评分显著下降,Th17/Treg免疫失衡得到缓解。以上研究表明miR-21、miR-155-5p对Th17/Treg平衡具有调节作用。本研究的相关性分析显示,外周血miR-21相对表达水平与Th17/Treg比值呈负相关,外周血miR-155-5p相对表达水平与Th17/Treg比值呈正相关(均P<0.05)。由此我们推测,在行MHD的尿毒症患者中,miR-21、miR-155-5p水平表达异常可能导致Th17/Treg失衡,从而引起血管钙化。
综上所述,在行MHD的尿毒症患者中,发生血管钙化的患者外周血miR-21呈低表达,而外周血miR-155-5p呈高表达;两者的异常表达与血管钙化的发生关系密切,而作用机制可能与两者异常表达引起的Th17/Treg失衡有关,但具体作用机制仍需进一步研究。

