枯草杆菌二联活菌肠溶胶囊联合艾塞那肽对非酒精性脂肪肝炎患者的疗效研究
薛士梅,胡艳丽,刘英
(天津市滨海新区大港中医医院药剂科1.内分泌科2.消化科3.天津 300270)
非酒精性脂肪肝炎是指除去乙醇或其他明确的肝脏损害原因,以弥漫性肝细胞脂质贮积以及脂肪变性为主要特征的一种病理综合征[1]。研究发现[2],成人非酒精性脂肪肝炎尚未发病率大约为20%~33%。该病发病机制尚未完全阐明,多与脂异常、肥胖、胰岛素抵抗以及糖耐量异常等并存,与2 型糖尿病紧密相关[3]。艾塞那肽不但可控制体质量,还能改善血糖,是治疗非酒精性脂肪肝的新型药物,但单用效果并不佳[4]。当前研究发现[5],小肠细菌移位、细菌过度生长,以及肠黏膜通透性改变等所引起的肠源性内毒素血症在非酒精性脂肪肝炎的发病中具有重要作用。本研究采取枯草杆菌肠球菌二联活菌胶囊进行治疗,分析其对血清内毒素、肠道通透性、肝功能和血脂的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择2018 年1 月—2020 年12 月我院收治的98 例非酒精性脂肪肝炎患者,纳入标准:均符合相关的诊断标准[2],且经实验室检查、CT 或肝胆超声等确诊;排除标准:治疗前1 个月使用过能影响肠道通透性的药物(抗生素、促消化道动力药和微生态制剂等);长期饮酒者;血清丙氨酸转氨酶(ALT)水平超过80 U/L 的患者;患有药物性肝病、病毒性肝炎、全胃肠外营养、自身免疫性肝病和肝豆状核变性等会引起脂肪肝的特定疾病。无脱落病例。采用抽签法随机分为两组。观察组49 例,男30 例,女19 例;年龄22~67 岁,平均年龄(41.32±7.49)岁;病程1~12 年,平均病程(4.83±0.76)年。对照组49 例,男29 例,女20 例;年龄22~67 岁,平均年龄(41.79±6.24)岁;病程1~12 年,平均病程(4.75±0.64)年。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,患者均知情并签署同意书。
1.2 方法
对照组:在早晚饭前1 h 皮下注射艾塞那肽(注册证号H20090382,广州粤迅康药业,规格:5 μg),5 μg/次,2 次/d;4 周 后 将 剂 量 增 加 为10 μg/次,2 次/d。观察组:口服枯草杆菌二联活菌肠溶胶囊(国药准字S20030087,北京韩美药品公司,规格:0.25 g),500 mg/次,3 次/d。两组均治疗3 个月。
1.3 观察指标
采用贝克曼库尔特AU5800 全自动生化分析仪测定血脂指标[甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)]、肝功能指标[γ-谷氨酰转肽酶(γ-GT)、ALT],试剂盒购自武汉华美生物。采取ELISA 法检测血清高迁移率族蛋白B1(HMGB1)、人尾肢同源蛋白2(Pygo2)以及人缺氧诱导因子1α(HIF-1α)水平,采取分光光度法测定二胺氧化酶(DAO)水平,采取基质偶氮显色法检测血清内毒素水平,采取酶学分光光度法检测D-乳酸水平;试剂盒均购自武汉华美生物。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析。计量资料以(±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组血脂指标比较
两组治疗后HDL-C、LDL-C、TG、TC 较治疗前改善,且观察组优于对照组(P<0.05),见表1。
表1 两组血脂指标比较[(±s),mmol/L]

表1 两组血脂指标比较[(±s),mmol/L]
注:与对照组比较,*P<0.05;与治疗前比较,#P<0.05
组别 例数 时间 HDL-C LDL-C TG TC对照组 49 治疗前 0.96±0.23 5.03±0.96 3.89±0.65 7.83±0.64治疗后 1.32±0.34# 4.13±0.75# 2.35±0.57# 6.24±0.57#观察组 49 治疗前 0.97±0.24 5.04±0.97 3.87±0.64 7.84±0.69治疗后 1.65±0.49*# 3.44±0.63*# 1.93±0.42*# 5.59±0.31*#
2.2 两组肝功能指标比较
两组治疗后血清γ-GT、ALT 水平较治疗前降低,且观察组低于对照组(P<0.05),见表2。
表2 两组肝功能指标比较[(±s),U/L]

表2 两组肝功能指标比较[(±s),U/L]
注:与对照组比较,*P<0.05;与治疗前比较,#P<0.05
组别 例数 时间 γ-GT ALT对照组 49 治疗前 72.63±14.27 65.73±15.29治疗后 59.43±11.28# 46.39±12.77#观察组 49 治疗前 72.65±13.89 64.38±16.14治疗后 43.26±10.18*# 39.42±11.43*#
2.3 两组血清HMGB1、Pygo2、HIF-1α 水平比较
两组治疗后血清HMGB1、Pygo2、HIF-1α 水平较治疗前降低,且观察组低于对照组(P<0.05),见表3。
表3 两组血清HMGB1、Pygo2、HIF-1α 水平比较[(±s),μg/L]

表3 两组血清HMGB1、Pygo2、HIF-1α 水平比较[(±s),μg/L]
注:与对照组比较,*P<0.05;与治疗前比较,#P<0.05
组别 例数 时间 HMGB1 Pygo2 HIF-1α对照组 30 治疗前 60.34±11.29 51.37±12.48 57.34±13.87治疗后 27.38±3.24# 47.32±10.13# 33.28±12.61#观察组 31 治疗前 59.73±12.45 52.64±13.89 56.32±14.15治疗后 16.59±2.13*# 41.32±10.33*# 25.14±10.32*#
2.4 两组血清内毒素、D-乳酸、DAO 水平比较
两组治疗后血清内毒素、D-乳酸、DAO 水平较治疗前降低,且观察组低于对照组(P<0.05),见表4。
表4 两组血清内毒素、D-乳酸、DAO 水平比较(±s)
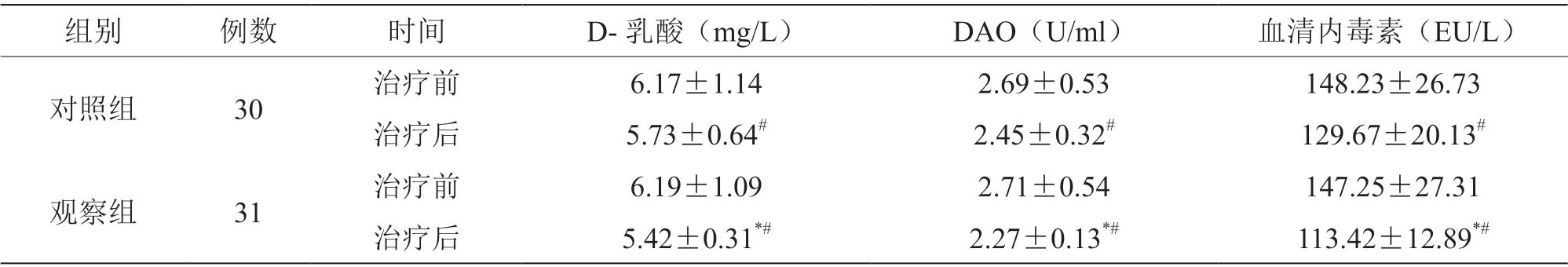
表4 两组血清内毒素、D-乳酸、DAO 水平比较(±s)
注:与对照组比较,*P<0.05;与治疗前比较,#P<0.05
组别 例数 时间 D-乳酸(mg/L) DAO(U/ml) 血清内毒素(EU/L)对照组 30 治疗前 6.17±1.14 2.69±0.53 148.23±26.73治疗后 5.73±0.64# 2.45±0.32# 129.67±20.13#观察组 31 治疗前 6.19±1.09 2.71±0.54 147.25±27.31治疗后 5.42±0.31*# 2.27±0.13*# 113.42±12.89*#
3 讨论
3.1 可降低炎症反应,抑制纤维化,并改善患者肝功能
观察组血清HMGB1、Pygo2、HIF-1α 水平低于对照组(P<0.05),表明联用枯草杆菌二联活菌肠溶胶囊能更有效地降低患者机体的炎症反应和抑制肝纤维化。HMGB1 在细胞迁移、炎症反应和肿瘤的发生、侵袭、发展过程中具有重要的作用;Pygo2 参与了肝纤维化的发生过程,其血清含量能判断非酒精性脂肪肝炎患者的肝纤维化程度;HIF-1α 在肿瘤、慢性肺病以及酒精性肝病中均具有较高的表达水平,其可以诱导核因子κB(NF-κB)的表达,而NF-κB 可以促进炎症反应[6]。观察组血清γ-GT、ALT 水平明显低于对照组(P<0.05),表明联用枯草杆菌二联活菌肠溶胶囊能更有效地改善肝功能。进入肝脏的血液70%是来自于肠道-门静脉系统,所以肝脏经常暴露与于自肠道的抗原相互刺激下,且肝脏富含大量的免疫细胞,可参与其对肠道抗原的免疫耐受。若打破免疫平衡将会加重肝脏炎症和损伤,进而进一步加重肠道菌群失调。枯草杆菌二联活菌肠溶胶囊由枯草杆菌及屎肠球菌复合而成,能够经胃酸屏障作用于肠道,刺激活性菌的释放,增加机体生理活菌活性提高肠道的防御功能使肠道内病毒细菌的繁殖受到抑制,从而纠正肠道菌群,起到消炎抗菌目的。另外,枯草杆菌二联活菌肠溶胶囊能够影响T 细胞及巨噬细胞对炎性因子的释放,引起免疫耐受,阻止炎症反应的过度进展,修复肠道的免疫功能[7]。
3.2 有利于修复肠黏膜屏障,减轻肠源性内毒素血症
肠黏膜的通透性与肠屏障功能紧密相关。疾病、肠腔内渗透压改变、饮食、药物、激素和细胞因子等都能导致肠黏膜的通透性发生改变,进而影响肠屏障功能[8]。两组治疗后血脂明显改善,观察组优于对照组(P<0.05);观察组血清内毒素、D-乳酸、DAO 水平低于对照组(P<0.05),分析可知:当发生肝炎时,肠道微生态发生不同程度失衡,肠道菌群的数量、组成或定位均可产生极大的变化。肝硬化患者肠道益生菌如双歧杆菌、拟杆菌等显著减少,大肠埃希菌和产气荚膜杆菌等革兰阴性杆菌则明显增多。肝炎患者的肠道屏障功能障碍可引起疾病的进一步恶化,并促进肝性脑病的发生。肠黏膜通透性的变化可准确地反映肠黏膜的受损程度,通过检测血清DAO 和D-乳酸水平,能间接地评估肠道黏膜的通透性及完整性的改变情况。枯草杆菌二联活菌肠溶胶囊对促进肝脏功能的恢复有辅助作用,促进肠道菌群的平衡和修复,其机制可能是通过降低肠道通透性和血清内毒素水平,改善了肠道屏障功能,在一定程度上缓解肠道革兰阴性杆菌过度生长和肠道菌群失调现象,有效改善微生态失衡,使受到损伤的肠黏膜屏障得到修复,明显降低肠黏膜的通透性,进而减轻对肝细胞的破坏,促进肝功能的恢复[9]。
综上所述,枯草杆菌二联活菌肠溶胶囊联合艾塞那肽能明显减轻非酒精性脂肪肝炎患者的肠源性内毒素血症,降低肠道通透性,改善肝功能,降低血脂。但本文存在一定不足,如样本量较少,且未进行机制分析,将在后续深入探究。

