NCAPG 促进成骨肉瘤细胞增殖的研究
史君,陈坤峰,李桂石,赵志坚
(1.商丘市第一人民医院急诊创伤外科,商丘 476100;2.烟台毓璜顶医院关节矫形外科,烟台 264000)
成骨肉瘤是一种侵袭性的原始骨间充质肿瘤[1],发病率在原发性骨恶性肿瘤中居于首位,早期表现隐匿而且早期即可发生转移,一直是骨科界的难题之一[2]。非染色体结构维护亚基凝聚素Ⅰ复合物亚基G(non-structural maintenance of chromosomes condensin I complex subunit G,NCAPG)是一种有丝分裂相关的染色体凝缩蛋白,广泛存在于真核细胞中。NCAPG 在多种癌症中异常表达,且通过相关分子机制与肿瘤细胞的侵袭、转移、凋亡及耐药等过程密切相关[3-4]。以往研究发现,NCAPG 基因诱导G0/G1 细胞周期,从而促进细胞分裂[5]。在肝细胞性肝癌中,通过靶向调节NCAPG 可以抑制肝细胞性肝癌的生长和转移[6-7],但是NCAPG 基因在成骨肉瘤中的作用尚不可知。本研究主要探讨NCAPG 基因对成骨肉瘤细胞增殖的影响及其与成骨肉瘤临床指标的关系。
1 对象和方法
1.1 研究对象及分组 选择商丘市第一人民医院和烟台毓璜顶医院2010 年7 月—2021 年1 月收治的成骨肉瘤患者58 例。其中,男性23 例,女性35例,年龄16~25 岁。全部病例均已经过病理证实,且具有完整的病例资料。选择患者的成骨肉瘤组织为实验组,相应配对的成骨肉瘤旁正常组织为对照组。在58 例成骨肉瘤病例中,临床分级为Ⅰ~Ⅱ级者33例,Ⅲ级者25 例;肿瘤直径<5 cm 者22 例,肿瘤直径≥5 cm 者36 例。所有患者均接受MAP 化疗方案(大剂量氨甲喋呤+顺铂+阿霉素)治疗,所有患者均行全面术前体检,并进行了原发性肿瘤手术。
1.2 方法
1.2.1 免疫组化检测 采用免疫组化试剂盒进行免疫组化的检测,将肿瘤组织切成约3 mm 厚,在福尔马林中固定24 h,后嵌入石蜡中,切片,每片厚度为4 μm,置于70℃环境下烤30 min,随后放入二甲苯溶液浸泡30 min 进行脱蜡,之后依次分别放入95%、85%和75%的乙醇溶液中各30 min。之后,将切片标本在PBS 缓冲液中洗涤2 次,每次2 min。之后将切片置于枸橼酸钠缓冲液中并放入微波中加热20 min 后提取抗原。然后,将切片置于室温下放置2 h,并用PBS 缓冲液洗涤2 次,每次2 min。在除去多余的水分后,切片在室温下加入H2O2后在湿箱中放置20 min,再次洗涤,滴入NCAPG 抗体(ab251864,Abcamplc,Cambridge,UK 1∶100),并在4℃环境下过夜。
次日,将切片室温放置1 h,用磷酸盐(PBS)缓冲液洗涤2 次,每次2 min。之后,在室温下滴加IgG二级抗体,静置2 h。再用PBS 缓冲液再次洗涤,滴加3,3-二氨基苯联胺(Diaminobenzidine,DAB)(用A 液和B 液预先配制),室温下染色约5~15 s。用水冲洗掉表面染料,然后用苏木精溶液染细胞核5~8 s,用水冲洗约2 min。最后,用中性树胶封片后在显微镜下观察。
免疫组化结果判定: 2 名病理医师双盲状态下,高倍镜(400×)观察肿瘤细胞,细胞核或细胞质中出现明显染色颗粒判为阳性细胞。染色程度评分规则:无染色,0 分;轻微染色,1 分;中等染色,2 分;强染色,3 分。染色细胞所占比例评分:无染色,0 分;染色面积<25%,1 分;染色面积26%~50%,2 分;染色面积51%~75%,3 分;染色面积>75%,4 分。最终评分为染色强度与染色面积的乘积,分数≥4 为高表达,分数<3 为低表达。
1.2.2 试剂和仪器 抗NCAPG(ab251864,Abcam Cambridge,UK 1∶100)、山羊抗兔HRP(辣根过氧化物酶)次级抗体(ab6721,Abcam,1∶5 000 武汉proteintech 公司),IgG 二级抗体(北京中杉金桥生物技术有限公司)。Trizol 试剂(15596026,Invitrogen,USA),β-肌动蛋白(ab179467,Abcam,1∶1 000),第一链cDNA 合成试剂盒(K1621,Thermo,USA),Fast Start Universal SYBR Green Master(ROX)(Roche,Switzerland);本研究中涉及的仪器如下:ABI 7900HT QPCR Cycle,微板阅读器(ThermoMultiskanGO,USA),PVDF 膜(北京智杰方远科技有限公司)。
2 细胞实验
2.1 细胞培养、转染与分组 成骨肉瘤细胞MG-63(EMEM)用含10%FBS 和1%青霉素-链霉素双抗体的EMEM 培养,U-2 OS 用含10%FBS 和1%青霉素-链霉素双抗体的McCoy 的5a 改良培养基和1%青霉素-链霉素双抗体在37℃和5%CO 的培养箱中培养。采用基因法(中国上海)收集慢病毒载体(5′-CCAGAACCAGGCGAAGCTGGTGG-3′)和对照载体的shRNA。构建了一个慢病毒质粒pll3.7,插入shRNA 用于敲减人NCAPG。在聚烯存在的情况下,用shNCAPG 慢病毒感染MG-63(EMEM)和U-2 OS,在细胞感染慢病毒的第3 天,加入2 μg/mL 嘌呤霉素(P8230,白菌)筛选阳性细胞,始终保持药物浓度。并将未进行NCAPG 基因敲减的细胞为对照组(control 组),敲减NCAPG 基因作为实验组(shRNA 组)。
2.2 方法
2.2.1 RNA 提取和逆转录聚合酶链反应(qRTPCR) 应用Trizol 试剂从转染了NCAPG shRNA 的MG-63 细胞和U-2 OS 细胞中提取总RNA,用第一链cDNA 合成试剂盒(K1621,Thermo,Waltham,USA))合成cDNA,随后将反转录产物加入试剂盒中,使用Fast Start Universal SYBR Green Master(ROX)进行qPCR 实验,反应条件为94℃条件下15 s 及94℃条件下5 s 变性,60℃条件下25 s 退火,72℃条件下10 s 延展,共40 个循环。GAPDH 已经被规范化,并使用2-ΔΔCt计算方法计算相对表达式。引物序列见表1。

表1 qRT-PCR 中基因的引物序列Tab 1 Primers of genes in qRT-PCR
2.2.2 Western 印迹 从MG-63 和U-2 OS 细胞中提取总蛋白后,进行蛋白定量,加上样缓冲液,10%SDS-PAGE 电泳后,转移到PVDF 膜中,并在室温下用10%的牛奶阻断1 h。然后,将膜与抗NCAPG(ab251864,1∶100)、β-肌动蛋白(ab1794671∶1 000)在4℃过夜孵育。用TBST 缓冲液洗涤3 次后,用山羊抗兔HRP 二抗(ab6721,1∶5 000)孵育PVDF,PBS反复冲洗,然后加ECL 发光液,采用图像分析系统对目的条带进行扫描分析,蛋白的相对表达用相对密度表示。
2.2.3 集落形成试验 培养使用6 孔板在37℃内培养MG-63 和U-2 OS 细胞14 d。然后在室温下用多聚甲醛固定30 min,用0.2%晶紫染色20 min,并分别用PBS 洗涤。克隆细胞的数量由人工计数并绘制出来。
2.2.4 细胞增殖检测(CCK-8) 采用MTT 法确定MG-63 和U-2 OS 细胞的生存能力。将细胞培养在6 孔板上,用shRNA-NCAPG 质粒转染24 h,48 h后用MTT 溶液处理3 h,用PBS 清洗2 次后,加入150 μL 二甲基硫砜(DMSO)培养4 h。最后使用微板阅读器(ThermoMultiskanGO,美国)在570 nm 处测量光学密度(OD)。
2.3 统计学处理 采用GraphPad8.0 软件(Graph-Pad 软件,美国)进行了统计分析和图表绘制。通过Pearson 相关分析、χ2检验和Spearman 相关分析NCAPG 与成骨肉瘤之间的关系。P<0.05 为差异具有统计学意义。
3 结果
3.1 免疫组化检测成骨肉瘤组织及正常组织NCAPG 蛋白的表达 与癌旁正常组织相比,成骨肉瘤中NCAPG蛋白的表达水平明显高于正常组织(图1)。
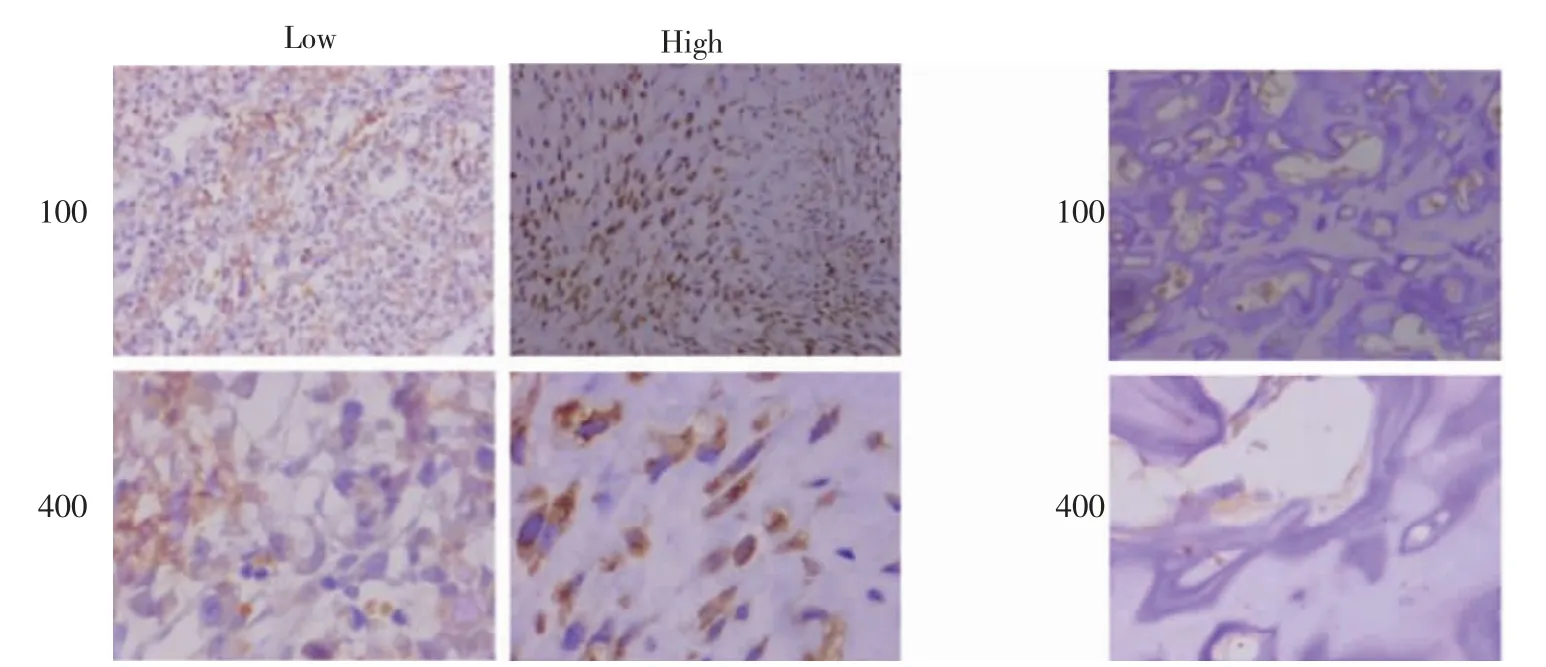
图1 NCAPG 在成骨肉瘤中的高表达(苏木精染色法,100×和400×)Fig 1 The high expression of NCAPG in osteosarcoma(hematoxylin staining,100×and 400×respectively)
3.2 NCAPG 的表达与临床病理特征的关系 结果表明,NCAPG 的表达与临床分期(P=0.042)和肿瘤大小(P=0.012)密切相关,见表2。
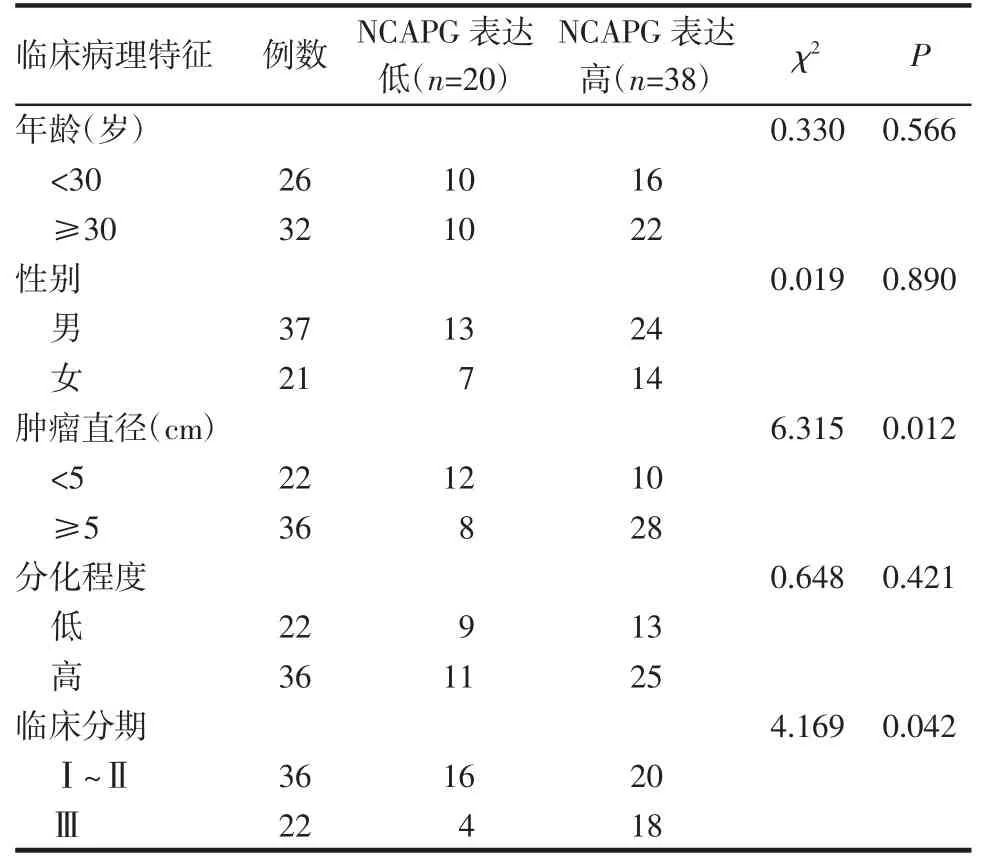
表2 58 例成骨肉瘤患者NCAPG 表达与临床病理特征的关系(n)Tab 2 The relationship between NCAPG expression and clinicopathological features in 58 patients with osteosarcoma(n)
3.3 定量PCR 及Western 印迹检测MG-63 和U-2 OS细胞NCAPG基因敲减后NCAPG基因及蛋白的表达 与对照组(control 组)相比,实验组(shRNA 组)NCAPG mRNA 表达水平明显受到抑制(P<0.000 1)(图2)。
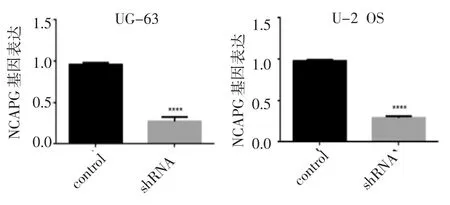
图2 定量PCR 检测MG-63 和U-2 OS 细胞NCAPG 基因敲减后NCAPG 基因的表达Fig 2 Detection of NCAPG gene expression after NCAPG gene knockdowninMG-63andU-2OScellsbyquantitativePCR
与对照组(control 组)相比,转染shRNA 组的NCAPG 蛋白表达明显低于对照组(P<0.000 1)(图3)。
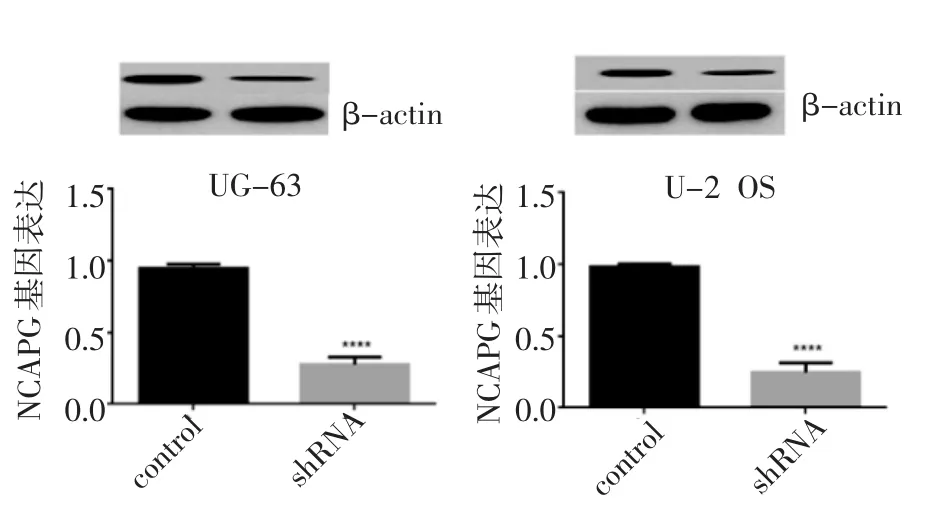
图3 Western 印迹检测MG-63 和U-2 OS 细胞NCAPG 基因敲减后NCAPG 蛋白的表达Fig 3 Expression of NCAPG protein after NCAPG gene knockdown in MG-63 and U-2 OS cells by Western blotting
3.4 敲减NCAPG 基因对成骨肉瘤细胞增殖的影响 集落形成实验结果显示,与对照组(control 组)相比,实验组(shRNA 组)MG-63 和U-2 OS 细胞的集落形成能力受到明显抑制(图4)。
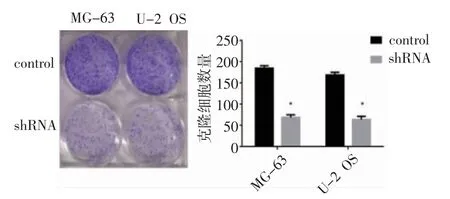
图4 敲减NCAPG 基因抑制成骨肉瘤MG-63 和U-2OS 细胞的增殖Fig 4 The proliferation of osteosarcoma MG-63 and U-2 OS cells inhibited by NCAPG knockdown
CCK8 检测细胞增殖情况,结果显示,实验组(shRNA 组)MG-63 和U-2 OS 细胞的增殖能力也较对照组(control 组)明显下降(图5)。
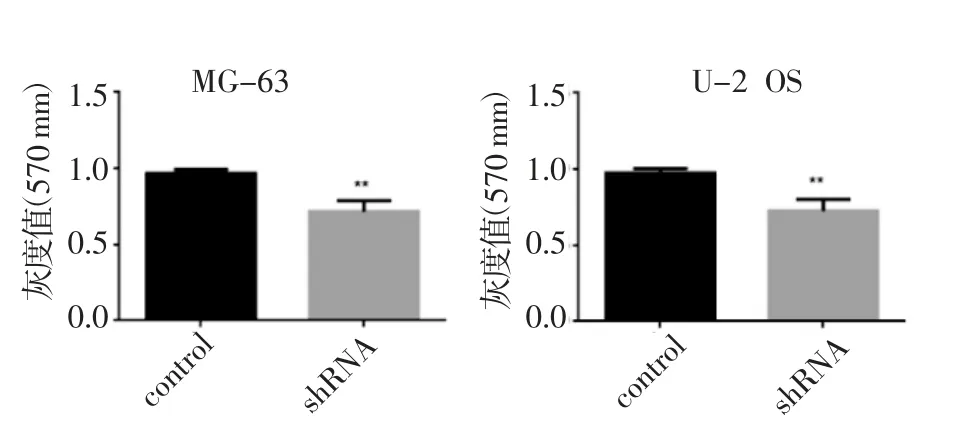
图5 敲减NCAPG 基因抑制成骨肉瘤MG-63 和U-2 OS 细胞的增殖Fig 5 The proliferation of osteosarcoma MG-63 and U-2 OS cells inhibited by NCAPG knockdown
4 讨论
成骨肉瘤由于其高死亡率和强侵袭性,导致许多成骨肉瘤患者失去了手术切除的机会[7]。肿瘤的早期诊断是确保治疗效果的关键,但因成骨肉瘤早期缺乏特异性症状,发现时病情往往已经进一步发展。延误治疗时机、早期转移和化疗耐药等是成骨肉瘤患者生存期短、预后不佳的主要原因[8]。但是,传统的治疗方法,如放化疗疗效有限。近年来,靶向治疗因其精准性表现出极大的优势,各种治疗靶点也陆续被发现。为了改善成骨肉瘤患者的预后,需要寻找更多的治疗靶点。
在本研究中,免疫组化检测发现,NCAPG 基因在肉瘤组织中异常高表达。又通过对58 例成骨肉瘤患者的临床病理特征分析发现,NCAPG 基因的表达与肿瘤直径、分期等临床特征相关。因此,认为NCAPG基因可以作为成骨肉瘤的治疗靶点。
在本研究中发现,NCAPG 基因的高度表达与成骨肉瘤密切相关,这与之前的研究结果一致,认为NCAPG 基因与上皮性卵巢癌组织、卵巢癌细胞株、前列腺癌、儿童胶质瘤、多发性骨髓瘤等肿瘤发生密切相关[9-12]。并且NCAPG 基因的高表达与成骨肉瘤的分期和直径有关,这也与其他研究对于肝细胞癌结论高度吻合,认为NCAPG 基因呈现高表达,在癌旁组织中弱表达,且表达情况与分化程度和TNM分期密切相关[13]。
为进一步验证NCAPG 基因对成骨肉瘤的影响,用NCAPG shRNA 转染成骨肉瘤MG-63 和U-2 OS细胞,发现NCAPG 基因敲减组NCAPG mRNA 表达水平和蛋白质表达水平明显下降,并且通过CCK-8测定和集落形成实验表明抑制NCAPG 基因的表达会显著降低成骨肉瘤细胞的增殖。因此,证实了NCAPG基因可能参与了成骨肉瘤细胞的增殖。研究表明,NCAPG 基因的高表达促进多种肿瘤细胞的增殖,如在肝细胞性肝癌中,通过靶向调节NCAPG 可以抑制肝细胞癌的增殖[5],证实NCAPG可以作为一种新的、有前景的肿瘤治疗靶点。
在肝细胞癌中,NCAPG 通过磷脂酰肌醇3 激酶-蛋白激酶B 信号通路发挥作用[12-13]。在贲门腺癌中,NCAPG 通过促进cyclins(CDK4、CDK6 和cyclin D1)过表达和下调细胞周期抑制剂(P21 和P27),调控细胞异常凋亡[6]。但是NCAPG 促进成骨细胞瘤进程的机制尚待进一步探讨。
综上所述,NCAPG 基因可能是促进和介导成骨肉瘤进展的内在机制。在成骨肉瘤组织,NCAPG 基因的表达明显上调,并且通过敲减NCAPG 基因,成骨肉瘤细胞的增殖速度明显下降,因此,可以通过抑制NCAPG 基因的表达来治疗成骨肉瘤改善患者预后。但本研究也存在一定局限性,单中心、小样本弱化了这一结论,因此需要更多的体内、体外研究进一步验证结论。

